瓜类褪绿黄化病毒对黄瓜叶片营养及防御反应的影响
张泽龙,张蓓蓓,何海芳,闫明辉,李静静,闫凤鸣
(河南农业大学植物保护学院,河南 郑州 450002)
瓜类褪绿黄化病毒(Cucurbit chlorotic yellows virus,CCYV)属长线形病毒科(Closteroviridae)毛形病毒属(Crinivirus),由烟粉虱以半持久性方式特异性传播,主要危害黄瓜、甜瓜、西瓜等瓜类作物,能在黄瓜和甜瓜等瓜类作物上引起典型的褪绿黄化症状[1]。目前,CCYV在中国大部分地区普遍发生,给瓜类作物生产造成严重的经济损失。CCYV结合在其介体烟粉虱的前肠[2],烟粉虱在刺吸植物细胞汁液时分泌唾液,病毒随唾液进入植物叶片。田间烟粉虱种群爆发往往会伴随病毒病的流行。研究病毒是否对寄主植物次生物质与营养物质产生影响,是直观解释媒介昆虫寄主选择偏好的基础,有助于进一步理解病毒的传播机制,从而为培育抗虫作物品种或制定综合防治策略提供理论基础。病毒在生态系统中传播与媒介昆虫的空间活动密切相关。然而寄主植物品质是媒介昆虫选择寄主的主要参考因素。植物感染病毒之后,叶片挥发物的成分及含量发生变化,媒介昆虫趋向于取食感染病毒的寄主植物[3]。前期有研究表明媒介昆虫在感染病毒的寄主植物上有更高的取食量,可能是病毒调控寄主植物的代谢过程,降低了植物苦味物质的含量,从而提升了寄主植物的适口性[4]。媒介昆虫在感染病毒的寄主植物上较健康植物有更高的存活率、产卵量和更长的寿命等生物学特性[5],从而使得媒介昆虫在感染病毒的寄主植物上种群发生更快[6-8]。昆虫的生长发育与植物化学组分密切相关,病毒编码的蛋白能够通过改变不同植物激素的合成从而调控植物的代谢。目前,已发现TuMV、PLRV、CMV等多种病毒不同程度地影响水杨酸及茉莉酸的生物合成,CAT、PRs(Pathogens related genes,PRs)基因是植物激素合成途径中关键的调控基因,防御相关基因的表达量能够间接反应植物的防御反应状态[9-11]。
唐雪飞[12]已经证明在健康和感毒的寄主植物上取食的烟粉虱存在生物学性状的差异,在感染CCYV植株上取食的烟粉虱,从卵到成虫的存活率都显著低于在健康植株上取食的烟粉虱,且在感毒黄瓜植株上,烟粉虱发育历期显著延长。宋丹阳等[13]研究发现,在感染CCYV的黄瓜植株上,烟粉虱的解毒酶和保护酶都有不同程度的升高,这说明感毒植物不同程度地激发了烟粉虱的生理调控机制,从而间接影响了其媒介昆虫烟粉虱的代谢适应调节。病毒如何影响寄主植物的生理指标从而间接影响昆虫的生长发育目前还不清楚。感染病毒后寄主植物产生的防御性物质和营养物质的变化是影响媒介昆虫取食行为和生长发育的重要因素,其含量的差异可能影响媒介昆虫的取食偏好,并影响种群发展及空间活动,进而影响病毒病的流行。
本研究以烟粉虱半持久性传播的CCYV及其寄主植物黄瓜为研究对象,考察病毒对寄主植物营养和主要防御物质的影响,从而为病毒对媒介昆虫产生定位寄主趋向和取食趋向的原因提供例证,同时为阐明农田生态系统中的植物病毒传播发生机制提供依据。
1 材料与方法
1.1 植物与昆虫培养
试验在河南农业大学化学生态实验室进行,所用烟粉虱、黄瓜植株均在化学生态实验室温室进行培养。黄瓜(Cucumissativus)(品种为博杰-107)栽培于塑料营养钵中(d=10 cm,h=12 cm),每钵1株。在光周期为L∶D=16∶8,温度为(27±3)℃,相对湿度为(70±5)%的温室防虫笼中培养。当植株长到3~4片真叶期时用携毒成虫侵染植物,使其感毒。
带毒烟粉虱(Bemisiatabaci)为Q型(Q-biotype,地中海隐种MED)于人工温室内用黄瓜植株饲养以维持带毒烟粉虱种群。在微虫笼里放入100只带毒烟粉虱,然后夹到健康植株叶片上[14],待烟粉虱取食 3 d后,将其移除;然后用小毛笔将烟粉虱的卵及若虫轻轻剔除,再将处理后的黄瓜苗转移至温室培养。培养5、15 d后,选取长势一致的感毒植株进一步试验。
1.2 植物RNA提取与感毒鉴定
100 mg 新鲜植物叶片组织用液氮磨至粉末状,加入1 000 μL Trizol(Tarkara,Japan)试剂,静置10 min后,12 000 r·min-1离心取上清液(离心机:Thermo,D-37520),加入200 μL RNA提取液(V(苯酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1,pH<5.0,Solarbio),震荡仪上涡旋15 s,静置10 min,12 000 r·min-1离心15 min,取上清液于新的离心管中,加入等体积的4 ℃异丙醇(纯度>99%,天津永大化学试剂有限公司),缓慢颠倒离心管,静置10 min,12 000 r·min-1离心15 min,取沉淀。DEPC配置的75%的乙醇洗沉淀3次,沉淀晾干后加入20 μL RNAase free H2O(Biosharp)。用qRT-PCR法检测病毒[2],与阳性克隆对比,确认植物感毒。
1.3 qRT-PCR测定相关防御基因表达量
PR1、PR3和CAT是与植物防御密切相关的基因。利用qRT-PCR检测这些基因在CCYV感染5 d和15 d后黄瓜叶片中的表达量。1 μg RNA用于反转录,步骤参考PrimeScript RT reagent kit (Takara,Janpan)使用说明。相关引物序列见表1[15-16],qRT-PCR反应体系参考TB Green Premix Ex Taq Ⅱ (Takara,Japan),仪器为Appliedbiosyestems 7 500,基因表达分析依据2-△△CT值的组间差异,每组3个重复。

表1 相关基因引物序列Table 1 Primers of related genes
1.4 测定方法
1.4.1 可溶性糖 准确称取叶片样品0.1 g,置于离心管中,16 mL 80%乙醇浸提2次,每次30 min,冷却后于4 000 r·min-1离心5 min,收集上清液,将上清液定容至100 mL。取提取液l mL加蒽酮试剂(纯度≥ 98%,国药集团化学试剂有限公司)5 mL,放入沸水浴中显色10 min,待取出后立即冷却,于625 nm波长处测定吸光值(全波长酶标仪,Thermo 1510),用D-葡萄糖绘制标准曲线,每组3个生物学重复[17]。
1.4.2 游离氨基酸 取新鲜植物0.1 g,用5 mL醋酸水研磨提取,离心取上清液0.5 mL,用pH 5.4醋酸缓冲液定容至10 mL为待测液。吸取2 mL待测液加3 mL茚三酮(纯度≥ 98%,国药集团化学试剂有限公司)和0.5 mL 0.1%的抗坏血酸溶液,置于沸水浴中加热15 min,冷却15 min后在580 nm波长下比色,在标准曲线上查得氨基酸含量(用亮氨酸绘制标准曲线)[15]。
1.4.3 单宁(F-D 法) 将100 mg植物干粉加入10 mL蒸馏水中,在60 ℃条件下浸提12 h,5 000 r·min-1离心5 min后取上清液,用于单宁检测,单宁含量测定根据F-D试剂显色法(中国·派尼化学试剂厂·郑州),在波长680 nm下测吸光值,根据不同浓度单宁酸在同等条件下的吸光值绘制标准曲线[18-19]。
1.4.4 总酚 称取粉碎过筛样品100 mg于10 mL离心管中,加入5 mL 80 ℃蒸馏水,于沸水浴浸提30 min,冷却,定容过滤,滤液即为待测液。取2 mL待测液于25 mL试管中,再加入2 mL福林试剂(纯度>99%,阿拉丁),摇匀。3 min后加入10%碳酸钠2 mL振荡。静置1 h后700 nm处比色测定,以2 mL蒸馏水代替待测液作为空白。根据标准曲线计算总酚含量[16]。
2 数据统计分析
本实验所有数据均采用SPSS 22.0数据处理系统进行统计分析,由GraphPad Prism 5.0制作图表。对照与处理差异显著性采用T测验分析。显著性水平分别设为P<0.05,P<0.01,P<0.001。
3 结果与分析
感染CCYV的植株表现为褪绿黄化,但叶脉仍保持绿色(图1A,),RT-PCR检测结果表明,褪绿黄瓜植株感染了该病毒(图1B)。

‘+’为阳性对照;‘-’为阴性对照;V代表感毒植株;H为健康植株。‘+’ means positive control;‘-’ means negative control;‘V’ represents CCYV-infected plants;‘H’ represents healthy plants.图1 感染CCYV症状及感毒鉴定Fig.1 CCYV induced symptom and identification
3.1 CCYV对黄瓜植株可溶性糖和氨基酸含量的影响
CCYV感染后,黄瓜叶片中的可溶性糖和游离氨基酸含量有所变化(图2)。感染CCYV 5 d和15 d时,游离氨基酸在感毒植株的含量均显著低于健康植株(图2A,P5<0.05,n=3,T=4.647;P15<0.05,n=3,T=8.869)。对于可溶性糖,感染CCYV 5 d时,由于病毒在植物体内含量较低,健康和感毒植物叶片可溶性糖含量差异不显著(图2B,P=0.263,n=3,T=1.302),而感染15 d时,黄瓜叶片的可溶性糖含量显著降低(P<0.05,n=3,T=3.838)。
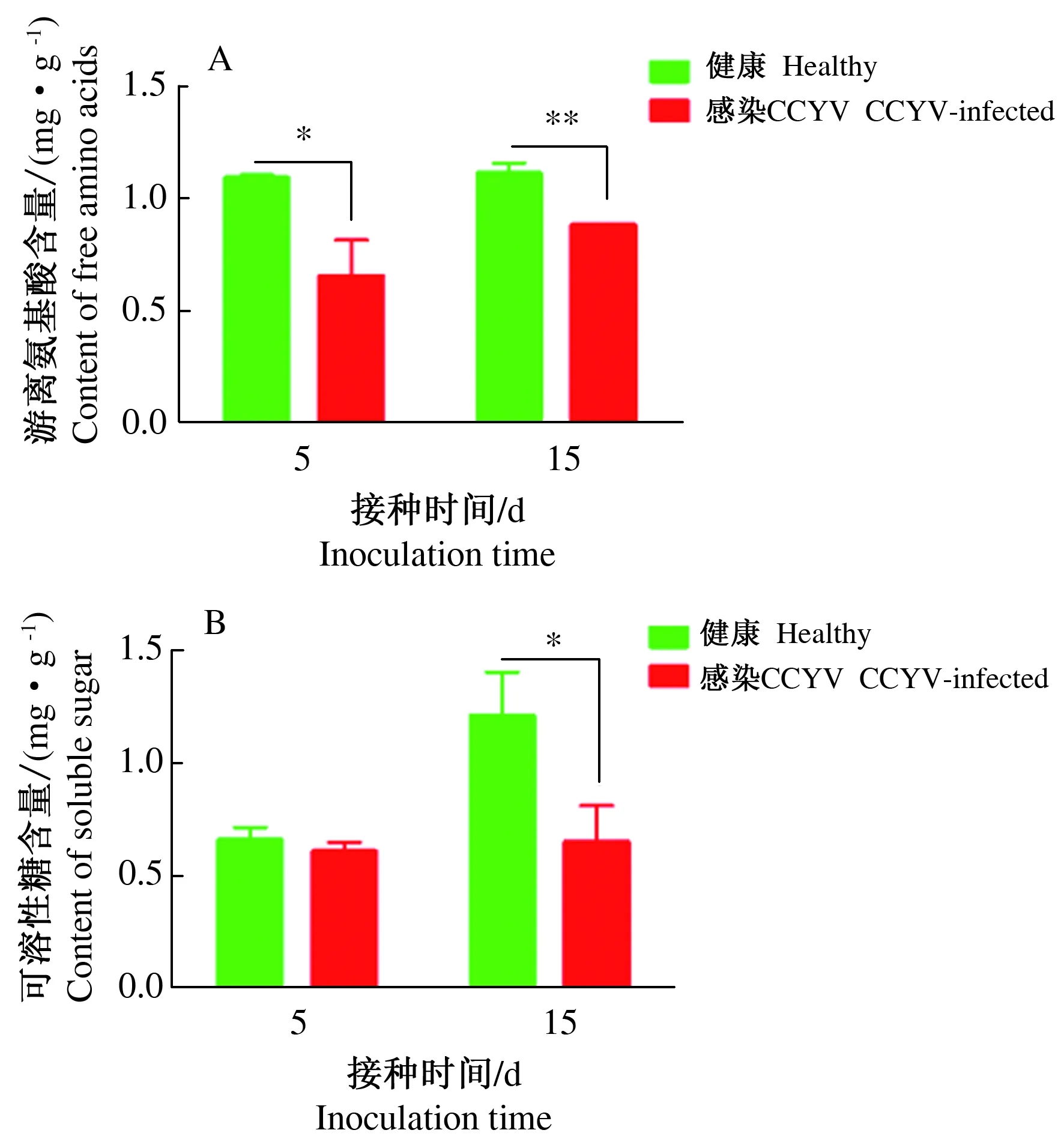
图2 CCYV对寄主植物叶片营养物质含量的影响Fig.2 Effects of CCYV infection on the content of nutrients in cucumber leaves
3.2 CCYV对黄瓜叶片防御物质含量的影响
在感染病毒5 d和15 d时,感毒黄瓜叶片内的总酚和单宁含量都显著低于健康植株(图3A,单宁P5<0.05,n=3,T=3.353,P15<0.01,n=3,T=5.689;图3B,总酚P5<0.05,n=3,T=2.922,P15<0.01,n=3,T=6.204)。随着病毒在寄主体内复制数的增加,这种差异更加显著。单宁和总酚是一类苦味物质,其含量的变化影响介体昆虫的取食行为,CCYV显著降低了单宁和总酚含量,这种变化能够直接促进烟粉虱的韧皮部取食,无论是获毒还是传毒阶段,都直接促进病毒的传播。
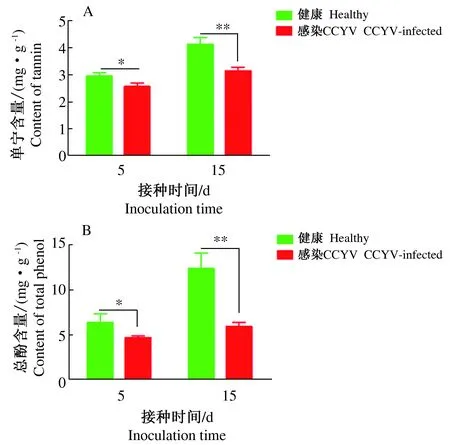
图3 CCYV对黄瓜叶片防御物质含量的影响Fig.3 Effects of CCYV infection on the content of defensive chemicals in cucumber leaves
3.3 CCYV对黄瓜叶片相关防御基因表达量的影响
利用qRT-PCR检测3个防御基因在CCYV感染5 d和15 d后黄瓜叶片中的表达量(图4A为5 d,图4B为15 d)。PR1基因在感染CCYV 5 d和15 d表达量均下调(P5<0.01,n=3,T=-5.261,P15<0.05,T=-4.154),PR3基因在感染CCYV 5 d时差异显著下调(P5<0.001,n=3,T=-23.575),但在15 d时差异不显著(P=0.498,n=3,T=4);而CAT基因在感染CCYV 5 d和15 d均显著上调(P5<0.001,n=3,T=14.254,P15<0.001,n=3,T=17.785)。PR1、PR3、CAT基因位于不同的代谢通路,三者的差异表达说明CCYV不同程度地激发或抑制了植物的防御反应。
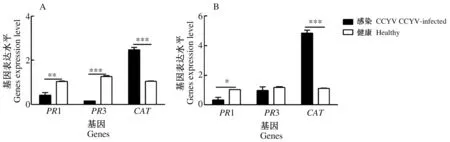
图4 感染CCYV 5 d(A)和15 d(B)对黄瓜防御基因相关表达量的影响Fig.4 Effects of CCYV infection on defense related genes expression level of 5 d (A) and 15 d(B)
4 结论与讨论
可溶性糖、游离氨基酸是植物体内基础的营养物质,营养水平影响介体的生长发育和产卵量等生物学特性[20]。不同传播方式的病毒有不同的调节机制促进自身传播,非持久性传播的病毒所需的获毒时间较短,介体昆虫在试探性取食阶段即可满足获毒,因此寄主植物营养水平降低能够迫使介体昆虫转移寄主,进行病毒传播[21-22]。CCYV降低了寄主植物游离氨基酸和可溶性糖的含量,在这一方面与非持久性病毒造成的影响类似。酚类通常被认为是一种阻碍昆虫取食、对昆虫产卵和生长发育有害的植物次生防御物质,能够与昆虫消化酶结合,降低昆虫的消化能力以及取食量和产卵量[23],且有研究表明单宁对病毒有抑制活性,能够降低病毒的侵染率[24]。CCYV降低了酚类化合物的含量,有利于介体昆虫韧皮部取食行为,能够有效提升病毒的侵染效率。PRs、CAT其表达量的影响间接反映了植物防御强度的强弱,3个基因在感毒状态下的不同表达,可能是病毒不同程度地影响了茉莉酸和水杨酸途径,本试验数据显示CCYV可能抑制了水杨酸途径,而激发了茉莉酸途径。病毒抑制或促进植物防御反应在其他病毒的研究中已有报道[9-11]。总之,在以上研究中发现CCYV不同程度地影响了植物的激素合成,从而间接改变了植物初生及次生物质的代谢过程,这些化学组分的变化可能是影响介体昆虫取食行为的关键因素,同时也是影响介体获毒、传毒的因素之一,感染CCYV的寄主植物产生了利于介体韧皮部刺探行为的变化,有利于病毒的获取,而植物营养素含量的降低可能是驱动介体转移寄主的因素之一。
但目前还不清楚是CCYV编码的哪个蛋白在致力于改变植物的这些次生代谢途径,推测可能是P22,P22是CCYV编码的沉默抑制子[25-26],是病毒侵染过程中不可缺少的作用元件,CMV、TuMV等病毒的也沉默抑制子2b、NIa Pro蛋白已被证明干涉多个生理过程或代谢途径,在三者互作关系中扮演着重要角色[27-30]。

