原子中电子的四个量子数
黄永义
(西安交通大学 物理学院,陕西 西安 710049)
原子中电子的4个量子数是大家熟知的,它们的引入过程也是很熟悉的.通过求解氢原子的定态薛定谔方程得到电子的3个量子数,分别是主量子数n,轨道角动量量子数l,轨道磁量子数ml,它们的取值为n=1,2,…;l=0,1,2,…,n-1;ml=0,±1,±2,…,±l,再加上乌伦贝克和哥德斯密特引入的自旋磁量子数ms=±1/2,共4个量子数(n,l,ml,ms).如果考虑到自旋轨道相互作用,需要使用新的4个量子数(n,l,j,mj),其中j为总角动量量子数,mj为总磁量子数.实际上原子中电子的4个量子数在1922年已经提出了,比1926年的波动力学早了好几年,本文就来谈谈4个量子数是怎样提出的,简要介绍它们的应用:原子的电子壳层结构和泡利不相容原理.
1 4个量子数
1913年玻尔在定态假设和跃迁假设的基础上利用对应原理提出了氢原子理论,给出了氢原子的能级公式
(1)
式中Z为类氢离子的核电荷数,n是取自然数的主量子数,它决定了原子的主要能量,是原子中电子的第一个量子数[1].1916年索末菲就将玻尔的圆轨道推广到椭圆轨道,进一步又考虑电子运动的相对论效应给出了氢原子能级的精细结构[2].如图1所示.

图1 电子绕核运动的椭圆轨道


(2)
式中α≈1/137为精细结构常数,而氢原子的能级依赖于主量子数n,还依赖于方位角量子数k1,因此方位角量子数k1是原子中电子的第二个量子数[3].对比碱金属原子的光谱线系的跑动项,k1=1,2,3,…n也可以用英文字母为s、p、d、f、g…,其中前4个字母有确切的含义,为sharp(锐线系),principal(主线系),diffuse(漫线系),fundamental(基线系)的首个字母.
如果原子处于磁场中,电子的轨道运动不再是平面,而是三维空间的曲线.磁场不是很强,它对电子运动的影响不是很大,电子的运动仍可以近似地看作是一个平面上的运动,轨道平面绕着磁场方向缓慢旋进,此时三维运动实际上是研究在磁场下电子轨迹的取向问题.如图2所示,Ze表示原子核,-e表示电子,电子的位置可以用3个球坐标(r,θ,ψ)表示,对应的线动量角动量分别为(pr,pθ,pψ),它们满足的量子化条件为∮prdr=nrh,∮pθdφ=nθh,∮pψdψ=nψh,量子数nr、nθ、nψ都取整数.

图2 有磁场时电子做三维运动,摘自[4]
显然角动量pψ为上文极角动量的分量
pψ=pφcosα
(3)
cosα=nψ/k1
(4)
式中k1=nθ+nψ,由-1≤cosα≤1,得
nψ=-k1,-k1+1,…,Ø,…,k1-1,k1
(5)

1916年徳拜和索末菲使用玻尔-索末菲理论引入磁量子数成功解释了正常塞曼效应,这个磁量子数恰好就是nψ[6,7].磁量子数的引入使得人们认识到仅有两个量子数还不能完全描述电子的状态,碱金属原子的光谱更能说明这一点.到1922年通过高分辨率光谱仪观察到光谱人们已经很清楚知道了元素原子的能级重数,如碱金属原子是双重态,碱土金属原子是单态和三重态,第三列元素原子是双重态和四重态等等.光谱证据表明并不是所有的光谱线都满足频率的里兹组合定律,如碱金属原子的漫线系光谱项d向光谱项p跃迁,应该有4条光谱,而实验只观察到3条谱线.而这些未出现的谱线给索末菲提供了重要的线索:应该还存在某种选择定则禁止了那些未出现的光谱线。为了发现这个选择定则,索末菲在两个量子数的基础上试探性的引入第3个量子数——内部量子数[8].这样原子的能级就用3个量子数来标记,如n=5,k1=1,k2=3,则有光谱项符号5s3.分析了碱金属原子双层能级和漫线系光谱的3条精细结构,索末菲总结出了内部量子数的选择定则Δk2=0,±1,朗德很快指出k2=0到k2=0的跃迁是禁止的[9].此时,选择定则还没有揭示出内部量子数的物理含义.
索末菲和朗德还提出了和当时实验数据吻合的磁性原子实假说(magnetic-core hypothesis),认为原子实具有角动量和对应的磁矩[10-15].类比于经典物理角动量合成的矢量模型,早在1919年朗德提出了原子的角动量合成的矢量模型[16],将原子多重能级归因于原子实磁矩和外层电子磁矩的相互作用.原子角动量合成的矢量模型揭示了内部量子数的物理内涵,事实上,原子实的角动量为R(大小为s·ћ),价电子的角动量为K(大小为k1·ћ),原子总的角动量为J=R+K,而索末菲的内部量子数k2被认为是总角动量的量子数,总角动量J的大小为k2·ћ,因为内部量子数k2代表了原子总角动量的大小,其物理的重要性也由此确立.由经典的矢量合成规则,就可以得到内部量子数的量子的取值范围|k1-s|≤k2≤k1+s.价电子角动量和原子实角动量的耦合产生了分立的附加能量(正比于R·K),此即碱金属原子能级的精细结构.朗德用原子实、电子的角动量矢量模型研究了反常塞曼效应,取得了相当不错的结果.内部量子数k2到底取什么值呢?事实上k2可能取整数,也可能取半整数.索末菲设定s谱项的单态k2=0,三重态单态k2=1,五重态单态k2=2等;p谱项的单态k2=1,三重态单态k2=2,1,0,五重态单态k2=3,2,1等;d谱项的单态k2=2,三重态单态k2=3,2,1,五重态单态k2=4,3,2,1,0等[8].而谱项为偶数重时k2必须取半整数,这些结果和现代是一致的。由双重态碱金属原子的反常塞曼效应的谱线可以推测出,给定方位角量子数k1的能级,其内部量子数k2有两个值k1和k1-1[15].通过双重态的碱金属原子确定内部量子数是比较重要的,因为由碱金属原子一个价电子和一个原子实的构型确定的内部量子数可能更简单也更基本.
原子放在磁场中会发生塞曼效应,原子的总角动量J(大小为k2·ћ)在磁场中也会出现角动量空间量子化.可以用总磁量子数,即第四个量子数m1,描述总角动量在磁场方向的分量,它表示弱磁场存在时原子能级分裂的个数(原子总磁矩在外磁场中附加磁能的个数).总磁量子数m1取什么值呢?方位角量子数k1对应的轨道角动量k1·ћ是空间量子化的,在外磁场方向的投影共有2k1个.由碱金属原子确定的内部量子数k2有两个值k1和k1-1,对应两个轨道角动量k1·ћ和(k1-1)·ћ,因此总角动量k2·ћ的两个角动量在外磁场方向分别有2k1和2(k1-1)个投影,统一表示成2k2个投影,显然这个结果已经考虑到了玻尔的意见.总磁量子数即第四个量子数m1有2k2个取值也和碱金属原子能级在磁场中分裂的个数完全一致.
4个量子数齐全了,主量子数n取自然数,表示原子的粗能级,方位角量子数k1取值为k1=1,2,3…n,表示电子轨道角动量的大小,由碱金属原子确定的内部量子数k2,只能取k1,k1-1,表示原子的总角动量的大小,总磁量子数m1有2k2个取值,表示总角动量在外磁场方向的空间量子化.4个量子数(n,k1,k2,m1)的现代符号为(n,l,j,mj),它们的取值不完全相同.具体来说,主量子数n和现代值一样;方位角量子数k1和现代的轨道角动量量子数l的关系为l=k1-1;由碱金属原子确定的内部量子数k2和总角动量量子数j的关系为j=k2-1/2,碱金属原子可以取两个值j=k1-1/2或k1-3/2;总磁量子数m1有2k2个取值,将k2=j+1/2代入2k2,就得到现代总磁量子数mj有2j+1个取值.
2 4个量子数的应用-原子的电子壳层结构
1922年玻尔提出了多电子原子的电子壳层结构,为元素周期律提供了物理解释,元素的周期律来源于原子核外电子在不同壳层填充的周期性[17].根据原子光谱的数据,玻尔给出了主量子数n所在的(主)壳层最多能容纳的电子数为2n2,例如从碱金属原子光谱的实验数据发现锂原子(Z=3),钠原子(Z=11)基态电子组态分别为2s,3s,因此锂原子第3个电子,钠原子第11个电子分别在2s,3s能级上,由此可以推断n=1的壳层最多只能容纳2个电子,而n=2的壳层最多只能容纳10-2=8个电子,玻尔还经验的导出了n=3时的壳层最多能容纳18个电子,玻尔将这些填满的稳定壳层称为闭壳层.而每个方位量子数k1对应n个不同的值表示轨道的形状,电子在每个椭圆轨道(支壳层)k1如何填充呢,玻尔相当主观认定将填充2n个电子,这样闭壳层总共容纳的电子数就是2n×n=2n2,表1是玻尔给出的原子轨道能容纳的电子数.电子填充壳层方式,玻尔只考虑了两个量子数(n,k1),主观认定支壳层容纳的电子数依赖于主量子数n.

表1 玻尔提出的占有数
表中数据和2n2不完全符合的原因是原子中外层电子感受到的场与库伦场不完全相同,3d、4d、5d、…4f、5f轨道对电子束缚松弛,能量较大,外层电子4s之后才能填3d,5s之后填4d,6s和5d之后才是4f,实验测得结果也与玻尔直觉给出的填充规则一致.玻尔从他的原子的电子壳层结构预测了72号元素铪应和锆矿石共存,这为实验发现铪指明了方向;另外玻尔对稀土族元素的解释今天还在使用,这些都是玻尔原子的电子壳层结构成功的地方,也是他的理论被人们接受的原因.
1924年斯通纳采用了元素特征X射线量子数的标记方法,对玻尔的壳层填充电子的方式重新划分[18].由于特征X射线发射谱和碱金属原子光谱的类似之处,斯通纳对特征X射线光谱的分析方法也可以适用于碱金属原子.描述特征X射线的量子数有3个(n,k1,k2),n为主量子数,k1为方位角量子数,k2为内部量子数,用来标记类似于碱金属的特征X射线的双线结构(3个量子数的现在的符号(n,l,j)).斯通纳的划分方法使得轨道容纳的电子数不再依赖于n,而只依赖于方位量子数k1,其轨道容纳电子数列表2所示.

表2 斯通纳提出的占有数
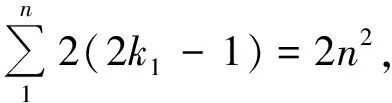
3 4个量子数的应用——泡利不相容原理
从碱金属双线结构(特征X射线双线结构)出发斯通纳将k2的值设定为k1-1,k1,认定这种非单值性来自于原子实的某种特性(磁性原子实假说),原子实非单值性导出了磁反常(反常塞曼效应中与原子能级洛仑兹正常3分裂的偏差).1925年泡利的一篇重要文章将磁反常归因为电子的一种非单值性,对碱金属而言采用索末菲做法定义个总角动量j=k2-1/2,则2j+1=2k2(此时的j和现代总角动量量子数j的符号完全一致),j表示角动量在外磁场中分量m1的最大值,m1共有2j+1个取值.这样电子的量子态用四个量子数(n,k1,k2,m1)表示.泡利提出了不相容原理:原子中不可能有两个或两个以上电子具有完全相同的4个量子数(n,k1,k2,m1),(现在的符号为n,l,j,mj)电子具有某组四个量子数,这个量子态就被占据了[19].对于给定的k1,k2可取k1-1和k1,当k2=k1-1时,m1最大值为k2=k1-3/2,当k2=k1时,m1最大值为k2=k1-1/2,所以m1总共的取值为
2(k1-3/2)+1+2(k1-1/2)+1=2(2k1-1);

在强磁场(帕邢-巴克效应)情况下泡利还用了另一组量子数描述原子中电子的状态(n,k1,m1,m2)(类似于现代符号(n,l,mj,ms)).m2表示价电子磁矩在外磁场方向的分量,它决定了电子在磁场中附加的能量,m2的值只能取两个m1+1/2和m1-1/2,磁反常和碱金属原子光谱的双线结构预示着表征电子自身磁矩的第四自由度的出现,区别于电子轨道角动量磁矩的量子数.泡利预测表征电子的第四自由度的量子数应该是半整数,由第四自由度的量子数计算出的碱金属s谱项的朗德因子等于2,第四自由度的磁量子数应该是双值的,电子的第四自由度应该是经典物理无法描述的.泡利几乎预测了电子自旋的所有特征,就是没提自旋两个字.后来乌伦贝克和哥德斯密特提出:泡利预测的电子的第四自由度就是电子自旋角动量[20].
斯通纳没有提出不相容原理而泡利能提出不相容原理,主要的原因是斯通纳仅研究具体问题:原子的电子壳层结构,没有进一步把电子壳层结构和电子的量子态(4个量子数)联系起来,很可能斯通纳没有意识到角动量空间量子化存在的事实,因而斯通纳的工作没有普适性;泡利敏锐地意识到并且使用了四个量子数来描述电子的量子态,特别是斯通纳忽略的角动量空间量子化的总磁量子数,这样不但能得到玻尔和斯通纳的占有数,还解决了其他的问题,如也能给出多电子原子态的相关信息,如碱土金属最低的原子态是1S0,而非3S1,两个等效电子p2的原子态数目.泡利不相容原理还预测了电子自旋的存在,而后来费米-狄拉克统计也是基于泡利不相容原理导出来的,泡利不相容原理一下子上升到原理的地位.
4 小结
本文较详细地阐述了原子中电子的四个量子数的来源,简要介绍了原子的电子壳层结构和泡利不相容原理.旧量子论是量子力学的必经阶段,玻尔在氢原子理论基础上提出了对应原理,海森堡由对应原理创立了矩阵力学;德布罗意在光量子和玻尔氢原子理论的启发下提出了物质波的概念,薛定谔在物质波的基础上创立了波动力学.在量子力学建立前,由于没有可遵循的范式,物理学家使用旧量子论探索新规律时具有相当的主观猜测性.虽然如此,旧量子论依然能产生经受住时间考验的研究成果,原子中电子的4个量子数构成了原子中电子量子态的完备描述,泡利不相容原理也是量子力学的基本原理,这是十分难得和可贵的.

