纳米氧化铈长期胁迫下对好氧颗粒污泥基本性质的影响
卢 丹,朱思谕,郑晓英
(1.中交第三航务工程勘察设计院有限公司,上海 200032;2.浅水湖泊综合治理与资源开发教育部重点实验室河海大学环境学院,江苏 南京 210098)
0 引言
稀土元素因其特殊的原子结构,几乎可以与所有元素发生反应,形成多价态、多配位数的化合物,具有许多优异的磁、光和电等特性,被称为“现代工业的维生素”和神奇的“新材料宝库”[1-3]。纳米氧化铈(CeO2NPs)不仅具有氧化性,还具有还原性。因此,CeO2NPs 被广泛应用于化妆品、精密仪器抛光、涂料和燃料电池等领域。随着生活环境中人们与CeO2NPs 的接触机会增多,其生物安全性逐渐引起了人们的关注,对环境和人类健康影响的争议也愈来愈多。但目前有关CeO2NPs 对活性污泥处理系统的影响鲜有报道。
好氧颗粒污泥(AGS)是在好氧条件下微生物通过细胞自固定而形成坚固的颗粒形微生物结构[4],其结构密实、沉降性好,利用自身结构优势为不同微生物的共存构建多种微环境,并具有良好的抗有机负荷冲击和脱氮除磷能力。另外,好氧颗粒污泥不仅对污水中的难降解有机物具有较好的适应性,还具有良好的吸附能力,其吸附容量大、效率高、选择性较好,去除废水中的重金属和纳米颗粒能取得较好的处理效果[5-6]。在抵御人工纳米材料(MNMs)胁迫影响方面具有显著优势与应用潜力。
本文通过研究不同浓度的CeO2NPs 长期暴露对好氧颗粒污泥理化性质,如污泥形态结构、粒径分布、沉降性以及胞外聚合物(EPS)等的影响,探讨CeO2NPs 与好氧颗粒污泥的相互作用机制。为降低CeO2NPs 的环境风险和促进污水处理系统稳定运行提供新的理论依据和技术支持。
1 材料与方法
1.1 试剂与仪器
试剂:CeO2NPs 由Sigma-Aldrich 有限公司生产;好氧颗粒污泥取自课题组自行运行的SBR 装置,MLSS 为5 000±100 mg/L。
仪器:B5A124S-CW 电子分析天平;202-2(AS)电热恒温干燥箱;GWA-UNI-10 超纯水仪;DS-8510DT超声波清洗仪;纳米粒度仪;pB-10 型pH 计。
1.2 实验方法
称取质量为100 mg 的CeO2NPs 置于1 L 超纯水(pH 值为6.9)中超声1 h(25 ℃,250 W,40 kHz),制成质量浓度为100 mg/L 的CeO2NPs 悬浮液,再根据本试验所需纳米浓度进行稀释,最终获得质量浓度为1 和10 mg/L 的CeO2NPs 溶液。
自行设计并联运行的SBR 反应器动态模拟试验装置3 套,进水采用实验室自配模拟生活废水,接种好氧颗粒污泥后在3 组SBR 装置进水中分别投加质量浓度为0(R0),1(R1)和10mg/L(R2)的CeO2NPs,进行以下试验研究。
(1)对不同浓度的CeO2NPs 胁迫下的好氧颗粒污泥稳定运行开展连续性试验研究。跟踪检测污泥中混合液挥发性悬浮固体浓度(MLSS)、污泥体积指数(SVI)和胞外聚合物(EPS);
(2)采用扫描电镜(SEM)和马尔文激光粒度仪(Mastersizer 3000)观察好氧颗粒污泥的微观形态、结构、孔径分布、颗粒粒径;
(3)使用维荧光光谱(Excitation-Emission-Matrix Spectra)和傅立叶红外光谱(Fourier transform infrared,FTIR)分析胞外聚合物(EPS)荧光特性组分及官能团变化,建立CeO2NPs 对好氧颗粒污泥的基本性质影响机制。
1.3 指标及分析方法
(1)观察污泥形态
采用扫描电镜对好氧颗粒污泥的外观形态进行观察。含水率较低的样品进行扫描电镜前只需简单干燥即可,但是本试验培养的好氧颗粒污泥含水量较大,需进行脱水处理,处理时采用课题组常规方法[7]。
(2)提取和测定颗粒污泥中的EPS
好氧颗粒污泥中的EPS 采用阳离子树脂交换法进行提取,操作步骤如下。
①取一定量污泥,用高速冷冻离心机离心10 min(4 000 r/min),静置一段时间等待好氧颗粒污泥沉淀后,倒去上清液,重复此步骤3 遍;
②将清洗干净后的好氧颗粒污泥重新溶解,投加阳离子树脂后在磁力搅拌器中提取l h,并维持容器内的温度低于4 ℃;
③用高速冷冻离心机离心30 min(8 000 r/min),获得的上清液用醋酸纤维滤膜过滤,即可获得EPS提取液;
④EPS 中的蛋白质(PN)含量采用考马斯亮蓝法测定[8],多糖(PS)含量采用蒽酮法测定[8],两者之和即为EPS 总量。
(3)采用三维荧光法和傅里叶红外光谱法分析EPS 的结构
①利用三维荧光光谱法(Excitation-Emission Matrix,EEM)分析活性污泥中EPS 的结构。试验采用F-7 000Hitachi 型分光光度计(Japan)进行检测。EEM 测定前,采用聚四氟乙烯膜(0.45 μm)将EPS 提取液屮的颗粒物过滤掉。激发光与发射光的扫描范围分别为200~450 nm 与210~550 nm,步长均为5 nm。设置狭缝宽为5 nm,扫描速度为4 800 nm/min。
②将污泥中EPS 的提取液放置在冷冻真空干燥机(24 h),将干燥后的固体放在石英研钵中仔细研磨,并按质量比为1∶100 与光谱纯的KBr 混合,并在压强10 kPa 下压片,最后使用傅里叶红外光谱仪(Brukes IFS 48,德国)进行红外分析。
2 结果与讨论
2.1 CeO2 NPs 对AGS 的形态结构影响
3 组反应器(R0,R1,R2)连续2 个月(60 d )投加CeO2NPs。宏观上可发现,试验组反应器(R1,R2)内颗粒污泥颜色与空白组(R0)内污泥颜色相比较浅,且颗粒污泥颜色随CeO2NPs 浓度增加而逐渐变浅,呈浅黄色,颗粒结构松散,体积增大。为进一步从微观角度分析CeO2NPs 对活性污泥影响,对不同浓度CeO2NPs 作用下的好氧颗粒污泥进行扫描电镜分析见图1。

图1 不同质量浓度CeO2 NPs 作用下的颗粒污泥表面扫描电镜照片
由图1可以看出,质量浓度为1 mg/L 的CeO2NPs长期暴露后,颗粒污泥表面基本未见CeO2NPs 颗粒;CeO2NPs 质量浓度增至10 mg/L 时,污泥表面吸附大量乳白色CeO2NPs 颗粒。由图1(a)可以看出,空白组中颗粒污泥以球菌和杆菌为主,且污泥表面有大量沟壑存在,这些沟壑是细胞外部营养物质和内部代谢产物的传输通道。但是,在高质量浓度的CeO2NPs(10 mg/L)作用下,好氧颗粒污泥表面结构发生变化。由图1(c),(d)可以看出,在质量浓度为10 mg/L 的CeO2NPs 作用下颗粒污泥表面分泌大量粘液状物质包裹活性污泥,堵塞了污泥细胞外部营养物质和内部代谢产物的传输通道,使得颗粒污泥表面沟壑逐渐增加,不利于微生物生长所需的物质传输。
2.2 CeO2 NPs 对AGS 的粒径分布及沉降性影响
不同质量浓度CeO2NPs 作用下的颗粒污泥粒径分布及沉降性变化趋势(第60 天)见图2。
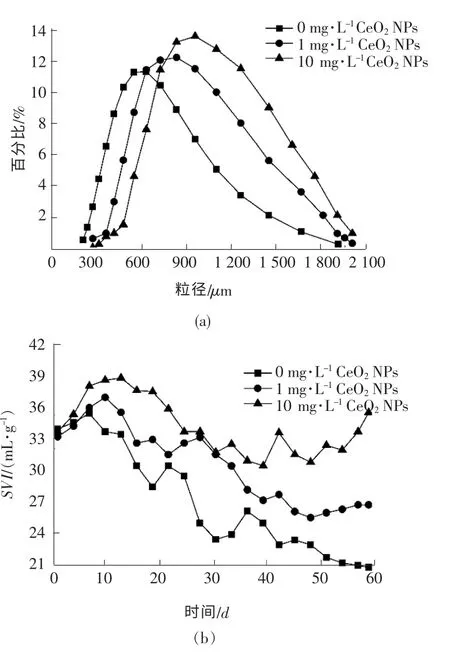
图2 不同浓度CeO2 NPs 作用下的颗粒污泥粒径分布及沉降性变化趋势(第60 天)
3 组反应器初期接种的好氧颗粒污泥平均粒径约为600 μm。由图2(a)可以看出,第60 天时,空白组内好氧颗粒污泥粒径主要分布在400~900μm,平均粒径约为633 μm,相对初期略微增大。当CeO2NPs质量浓度为1 mg/L 时,颗粒污泥粒径主要分布在630~1 100 μm,平均粒径约为774 μm;当CeO2NPs质量浓度为10 mg/L 时,颗粒污泥粒径主要分布在720~1 300 μm,平均粒径约为1 070 μm。可见,随着CeO2NPs 暴露浓度增加,污泥平均粒径呈增大趋势。这是因为在高浓度的CeO2NPs 刺激下,颗粒污泥分泌大量粘液状胞外聚合物(EPS),多种微生物聚集于颗粒表面,并吸附大量CeO2NPs 颗粒附着于污泥上,导致颗粒污泥粒径增长。
污泥体积指数(SVI)是衡量活性污泥密实度和沉降性能的重要指标。好氧颗粒污泥的SVI 值通常在40~50 mL/g 范围内,远低于活性污泥的SVI 值(120~150 mL/g),较低的SVI 值使好氧颗粒污泥具有良好的沉降性,用于污水处理时可极大缩减沉淀池容积,减少基建费用投入。由图2(b)可以看出,在CeO2NPs 长期胁迫下,颗粒污泥的SVI 值先升后降,这是因为纳米材料初期暴露时颗粒污泥无法适应其毒性,导致其沉降性变差,但随着暴露时间的延长,颗粒污泥逐渐适应微毒环境做出相应调整,沉降性能得到较大改善。
随着CeO2NPs 浓度的增加,第40 天时,质量浓度为10 mg/L 的CeO2NPs 系统内颗粒污泥SVI 值呈上升趋势,这是因为高浓度的CeO2NPs 产生的毒性超过了颗粒污泥耐受能力,使其沉降性下降。此外,第60 天时,3 个反应器内好氧颗粒污泥的SVI 值分别为24.12,29.87 和35.67 mL/g,表明随着CeO2NPs浓度的升高,好氧颗粒污泥的SVI 值也在增加,而污泥沉降性则变差。这是由于高浓度的CeO2NPs 刺激颗粒污泥过量分泌粘液状EPS 导致的结果。许多研究结果表明:EPS 属于亲水型物质,污泥间的空隙以及营养物质传输通道吸附较多水体,导致泥水分离困难,污泥沉降速度大幅度减慢[9]。
2.3 CeO2 NPs 对AGS 生物量及活性的影响
目前,一般采用混合液悬浮固体浓度(MLSS)和混合液挥发性悬浮固体浓度(MLVSS)这2 个指标来表征污水处理系统中微生物的量。此外,挥发性悬浮固体/悬浮固体(VSS/SS)能够更加精确表示污泥活性部分数量。不同浓度的CeO2NPs 对颗粒污泥生物量及耗氧速率(SOUR)的影响见图3。通过测定污水系统中的SOUR 来表征反应器内微生物活性。由图3(a)可以看出,连续投加纳米颗粒60 d 后,在投加质量浓度为1 mg/L 的CeO2NPs 系统中,微生物MLSS,MLVSS 及VSS/SS 与空白组相比并未产生明显变化;而在投加质量浓度为10 mg/L 的CeO2NPs系统中,微生物MLSS,MLVSS 及VSS/SS 与前2 组反应器相比均呈下降趋势。其中,当CeO2NPs 质量浓度从0 mg/L 增至10 mg/L 时,MLSS 及ρ(VSS)/ρ(SS)分别由5 016 mg/L 和0.75 降至4 481 mg/L 和0.68。结果表明,在低质量浓度的CeO2NPs(约1 mg/L)长期作用下对颗粒污泥生长并未产生抑制作用,且会轻微促进颗粒污泥生物量增长,这是因为低浓度的CeO2NPs 产生的微毒性在颗粒污泥的耐受能力之内,污泥受刺激反而加快增长。但是,质量浓度为10 mg/L 的CeO2NPs 会抑制微生物生长,原因是污泥无法适应高浓度CeO2NPs 长期胁迫,生物活性降低,致使污泥增长速率减慢。
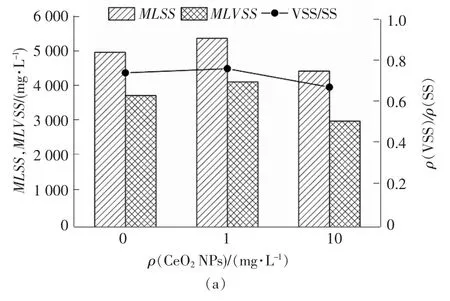

图3 不同浓度的CeO2 NPs 对颗粒污泥生物量及SOUR的影响
由图3(b)可以看出,在不同浓度的CeO2NPs协迫下颗粒污泥系统内SOUR 值。连续投加质量浓度为1 mg/L 的CeO2NPs 60 d 后,微生物呼吸抑制率为1.66%,与空白组相比基本无变化。王玉琳等[10]研究显示,低质量浓度的CeO2NPs(1 mg/L)长期胁迫对絮状污泥呼吸作用的抑制率约为6%,远高于本试验呼吸抑制率(1.66%)的原因是颗粒污泥具有三维密实结构,低毒性只对最外层微生物产生抑制作用,而内层生物由于传质受阻并未受影响。当CeO2NPs质量浓度为10 mg/L 时,系统内微生物SOUR 降至27.63 mg/(g·h),呼吸抑制率为29.37%。可见高浓度的CeO2NPs 长期暴露会对颗粒污泥代谢活性产生抑制,且浓度增大对微生物代谢活性抑制程度增强,这是因为氧化铈具有典型萤石结构,可扰乱微生物呼吸抑制机制从而影响污泥活性[11]。
2.4 CeO2 NPs 对好氧颗粒污泥中EPS 的影响
2.4.1 CeO2NPs 对AGS 中EPS 组成的影响
不同浓度的CeO2NPs 作用下好氧颗粒污泥中的EPS 的多糖(PS)和蛋白质(PN)含量变化趋势见图4。由图4可以看出,质量浓度为1 mg/L 的CeO2NPs长期暴露后,颗粒污泥中的EPS,PN 及PS 含量与对照组相比无明显差异,即该浓度的CeO2NPs 长期暴露对污泥中EPS 没有影响。但是当CeO2NPs 质量浓度增至10 mg/L 时,颗粒污泥中的EPS 总量质量分数从对照组的170 mg/g 迅速增至212 mg/g。由此可知,当CeO2NPs 质量浓度增至10 mg/L 时污泥微生物量降低,但其颗粒粒径仍增加,一方面是因为纳米颗粒吸附导致,更重要的是因为EPS 含水高,EPS 吸附的大量水分包裹在颗粒外表导致污泥粒径增加。
当CeO2NPs 质量浓度为10 mg/L 时,颗粒污泥中EPS 的PN 和PS 质量分数相对对照组分别增加了20 和22 mg/g,占比相应增加约20%和28%。可见污泥中EPS 含量增加并不是其中一种成分增加导致,而是由PN 和PS 共同增加产生的结果,且以PS增加为主。相关文献[10]指出,PN 具有抵御毒性的热类蛋白结构,而PS 则可以提高纳米颗粒流体动力学直径并促进其聚集,CeO2NPs 粒径增大难以进入污泥絮体并表现出较小毒性,这是PS 含量显著增加的原因。
2.4.2 CeO2NPs 对AGS 中EPS 荧光特性的影响
不同浓度的CeO2NPs 作用下各系统污泥中EPS 三维荧光光谱分析结果见表1。类蛋白质吸收峰A(230/330~340)和吸收峰C(230/305)分别由芳香蛋白色氨酸类物质和芳香蛋白酪氨酸类物质引起。吸收峰B(275/335~355)对应物质为溶解性微生物代谢产物。

表1 不同质量浓度的CeO2 NPs 作用下好氧颗粒污泥EPS 三维荧光光谱分析结果
由表1可以看出,相同峰的荧光强度在不同浓度的CeO2NPs 作用下发生了变化,由此可见,好氧颗粒污泥中EPS 不仅组成物质发生了变化,同时各组分浓度也随之变化。当CeO2NPs 质量浓度从0 mg/L 增至10 mg/L 时,峰A(芳香蛋白色氨酸)的荧光强度从7 951 逐渐增至9 017,一方面是由于EPS中PN 浓度增加,更重要是因为四价铈离子可氧化色氨酸和酪氨酸,生成强荧光物质促使峰A 荧光强度增大[8]。此外,铈离子能够与溶解性微生物代谢产物发生络合作用并出现荧光猝灭现象[8],这恰好也解释了本试验中CeO2NPs 的浓度增加会导致峰B(溶解性微生物代谢产物)荧光强度呈下降趋势的原因。本试验三维荧光光谱图中峰A、峰B 和峰C 出现了蓝移和红移现象。蓝移现象可能是因为链结构上芳香环和共轭键数量减少导致,红移则可能是因为含有羰基取代基、羟基、烷氧基、氨基和羧基等成分。这些变化意味着在CeO2NPs 长期胁迫下导致颗粒污泥中EPS 化学性质发生变化。
2.4.3 CeO2NPs 对AGS 中EPS 官能团的影响
前述三维荧光光谱分析结果表明颗粒污泥中的EPS 化学性质已发生变化,本节将借助傅里叶红外光谱(FT-IR)进一步分析EPS 中主要官能团与CeO2NPs的相互作用机制。CeO2NPs 暴露前后好氧颗粒污泥EPS 的红外光谱见图5。由图5可以看出,EPS 的FT-IR 光谱显示多个波段,表明EPS 内部官能团的多样性。根据其发生的波段,把FT-IR 光谱条带分配到各个组:3 438~3 377 cm-1的强条带源自EPS里羟基-OH 和胺基-NH2的伸缩振动;2 966~2 944 cm-1的弱光谱带是烷基C-H 的伸缩振动;1 656~1 654 cm-1谱带为N-H 的变形振动与蛋白质中C=O 伸缩振动的结果;1 401~1 452 cm-1谱带为C-H 的弯曲振动与C-N(酰胺Ⅲ)伸缩振动的共轭;1 111~1 113 cm-1谱带则是由于聚磷中P-O-P的伸缩振动;991~1 086 cm-1谱带可归因于多糖中C-O-C 的伸缩振动,指纹区谱带则是因为磷和硫等官能团的存在产生的结果。
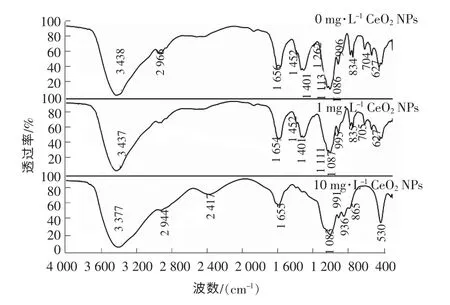
图5 不同质量浓度CeO2 NPs 作用下EPS 的红外光谱
CeO2NPs 暴露后颗粒污泥中EPS 的光谱图与对照组相比出现了明显不同,具体表现为波长3 438 cm-1的某些峰转移并变弱甚至消失。污泥中EPS 的峰位从3 438 cm-1移至3 377 cm-1,同时峰强度变弱,说明-OH 和-NH2官能团与CeO2NPs 或铈离子发生了反应。此外,1 401~1 452 cm-1对应的峰在质量浓度为1 mg/L 的CeO2NPs 暴露后发生轻微偏移,而其在质量浓度为10 mg/L 的CeO2NPs 暴露后消失了,可见高浓度CeO2NPs 与PN 含有的C-N(酰胺Ⅲ)之间发生了反应或结合,这与前述四价铈离子可氧化芳香蛋白色氨酸和酪氨酸结果相一致。质量浓度为10 mg/L 的CeO2NPs 暴露后,聚磷谱带(P-O-P)1 111~1 113 cm-1和指纹区谱带627~704 cm-1消失,可见高浓度的CeO2NPs 会促使好氧颗粒污泥中EPS 内聚磷/磷形式发生改变或浓度降低。以上差异表明EPS 中羟基、胺基、羧基和酰胺等官能团参与了CeO2NPs 颗粒/铈离子与颗粒污泥之间的相互作用。
3 结论
(1)低质量浓度(1 mg/L)的CeO2NPs 长期暴露对颗粒污泥的理化性质基本无影响。而在高质量浓度(10 mg/L)的CeO2NPs 长期作用下,颗粒污泥的平均粒径和SVI 值呈增长趋势,污泥沉降性能变差。当CeO2NPs 的质量浓度逐渐增至10 mg/L 时,微生物呼吸抑制率增至29.37%。可见,高浓度的CeO2NPs会抑制颗粒污泥代谢活性,且随其浓度增加抑制程度增强。
(2)质量浓度为10 mg/L 的CeO2NPs 颗粒污泥中PN 和PS 的质量分数分别增加了20 和22 mg/g,污泥系统通过增加PN 和PS 以抵御CeO2NPs 毒性。三维荧光光谱结果显示当CeO2NPs 质量浓度从0 增至10 mg/L 时,峰A(芳香蛋白色氨酸)的荧光强度逐渐从7 951 增至9 017,这是因为四价铈离子氧化色氨酸和酪氨酸产生的结果。
(3)1 401~1 452 cm-1对应的峰在质量浓度为10 mg/L 的CeO2NPs 暴露后消失,说明高浓度的CeO2NPs 与PN 含有的C-N(酰胺Ⅲ)之间发生了反应或结合。质量浓度为10 mg/L 的CeO2NPs 暴露后,聚磷谱带(P-O-P)1 111~1 113 cm-1和指纹区谱带627~704 cm-1消失,说明高浓度的CeO2NPs 会导致颗粒污泥中EPS 内聚磷/磷形式发生改变或浓度降低。

