BRD4抑制剂JQ1联合醋酸甲羟孕酮对子宫内膜癌细胞增殖和凋亡的影响*
张丽华,林千涵,庞迎新
(山东大学齐鲁医院妇产科,济南 250012)
子宫内膜癌(endometrial cancer,EC)是最常见的女性生殖系统肿瘤之一[1]。随着人口老龄化和肥胖发病率的升高,其发病率呈逐年上升趋势[2]。约15%~20%的子宫内膜癌存在转移或复发的高危因素,预后较差[3]。本课题组前期实验发现,表观遗传因子溴结构域蛋白4(bromodomain-containing protein 4,BRD4)在内膜癌组织中的表达水平较正常内膜组织高,(+)-JQ-1(后文简称JQ1)是BRD4的抑制剂,能抑制包括子宫内膜癌在内的多种肿瘤的生长[4]。文献报道,JQ1单一用药有一定的局限性,如耐药的产生和体内血药浓度不稳定[5-6]。Khalil等[7]在肿瘤免疫治疗的近期综述中,认为未来肿瘤的治疗不是单一治疗方式的应用,多靶点的联合治疗可能更有效[7]。本研究拟探讨JQ1与醋酸甲羟孕酮(medroxyprogesterone acetate,MPA)联合应用对子宫内膜癌细胞增殖和凋亡的影响,拓展子宫内膜癌治疗的新领域。
1 材料与方法
1.1 材料
1.1.1 细胞株 子宫内膜样腺癌细胞株Ishikawa和HEC-1A均购自上海中科院细胞库。Ishikawa细胞表达孕激素受体(progestin receptor,PR),被认为是孕激素敏感的内膜癌细胞系,HEC-1A细胞不表达PR,为孕激素耐药的内膜癌细胞。
1.1.2 主要试剂 BRD4抗体购自美国Abcam公司,cleaved caspase-3、PARP抗体购自Santa Cruz biotechnology。mTOR、p-mTOR、Akt、p-Akt、GAPDH抗体购自美国Cell Signaling Technology。Annexin V-PI细胞凋亡检测试剂盒系BD公司产品。JQ1购自美国MedChemExpress公司,MPA购自Sigma-Aldrich西格玛奥德里奇(上海)贸易有限公司,两种药物均用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解后,分装冻存。四甲基噻唑蓝(methylthiazoletetrazolium,MTT)系碧云天公司产品。LipofectamineTM 2000购自美国Invitrogen公司。其余生化试剂均购自北京索莱宝技术有限公司。
1.1.3 主要仪器设备 日本Olympus-LX70倒置显微镜;美国Nunaire公司细胞培养箱;德国Berthold Technologies公司酶标分析仪;美国BD公司的FACS Calibur流式细胞仪;美国BIORAD公司的电泳仪和电转仪。
1.2 方法
1.2.1 细胞培养及传代 Ishikawa细胞用含10%胎牛血清的DMEM培养基培养,HEC-1A细胞用含10%胎牛血清的McCoy's 5A培养基培养,处理后的细胞置于37℃含5% CO2的恒温湿培箱。细胞覆盖率达80%左右时进行传代,0.25% EDTA胰酶消化传代;次日待细胞贴壁后,取对数生长期细胞进行实验。
1.2.2 MTT法测定细胞增殖率 将Ishikawa和HEC-1A细胞按103细胞/孔接种于96孔板,隔日更换含相应处理浓度JQ1和(或)MPA的培养基,对照组加等体积DMSO,每组设至少6个重复孔,继续培养48h。每孔加20μL MTT,使其终浓度为0.5mg/mL。培养4~6h弃上清,每孔加100μL DMSO,振荡混匀,使结晶溶解。酶标仪490nm处测定吸光度。重复3次实验,统计并分析细胞增殖率。
1.2.3 流式细胞术检测不同处理后的细胞凋亡率 将子宫内膜癌细胞胰酶消化后接种于6孔板,浓度为2×104细胞/孔,培养24h,更换含相应处理浓度的JQ1和(或)MPA培养基,对照组加等体积DMSO,继续培养48h后收集细胞。用胰酶消化细胞,PBS洗2遍,100μL Annexin V-FITC binding buffer悬浮细胞,每组加Annexin V-FITC 5μL和PI 5μL,轻轻混匀,并单设一组无任何染料的作为阴性对照。室温孵育15min,避光。期间上下颠倒混匀2~3次。流式细胞仪上机检测,每份标本收集10000个细胞,检测早期凋亡、晚期凋亡及坏死细胞的表达率。使用WinMDI 2.9软件分析凋亡率。
1.2.4 Western blot 收集各药物处理组的细胞,处理条件同前,PBS洗2遍,加细胞裂解液冰上裂解30min,4℃离心,收集上清,用BCA试剂盒测定蛋白浓度。上样,电泳,转膜,脱脂奶粉室温封闭1h,与相应蛋白的特异一抗4℃孵育过夜,洗膜,室温孵育二抗45min,洗膜后用ECL试剂盒增强信号,凝胶成像仪曝光。
1.2.5 细胞干扰 BRD4 siRNA购自上海吉玛,3条中选择效果最佳1条进行后续实验,序列为5'-CUCCCUGAUUACUAUAAGATT-3'。将细胞接种于6孔板,培养过夜,待其密度至30%时,进行siRNA转染。BRD4 siRNA浓度为5μL/孔(约50nmol/L),对照组转等量的阴性对照,所有操作均用DEPC水处理的枪头及Ep管。按LipofectamineTM2000转染说明,进行操作。培养4h,更换新鲜完全培养基。

2 结 果
2.1 JQ1联合MPA对子宫内膜癌细胞增殖作用的影响 用浓度为1μmol/L JQ1单独或联合应用20μmol/L MPA处理子宫内膜癌Ishikawa及HEC-1A细胞48h,MTT法检测细胞增殖能力,见图1。在PR阳性的Ishikawa细胞中,与对照组相比,MPA组、JQ1组、MPA+JQ1组的细胞增殖率降低,差异均有统计学意义(P均<0.05)。析因方差分析结果显示:MPA、JQ1抑制增殖率的主效应差异均有统计学意义(FMPA=476.54,FJQ1=69.64,P均<0.001),MPA和JQ1联合应用的效应差异有统计学意义(F=29.11,P=0.001)。在PR阴性的HEC-1A细胞中,与对照组相比,MPA组、JQ1组、MPA+JQ1组的细胞增殖率降低,差异均有统计学意义(P均<0.05)。析因方差分析结果显示:MPA、JQ1抑制增殖率的主效应差异均有统计学意义(FMPA=13.620,P=0.006;FJQ1=37.240,P<0.001),MPA和JQ1联合应用的效应差异无统计学意义(F=3.798,P=0.087)。见图1。
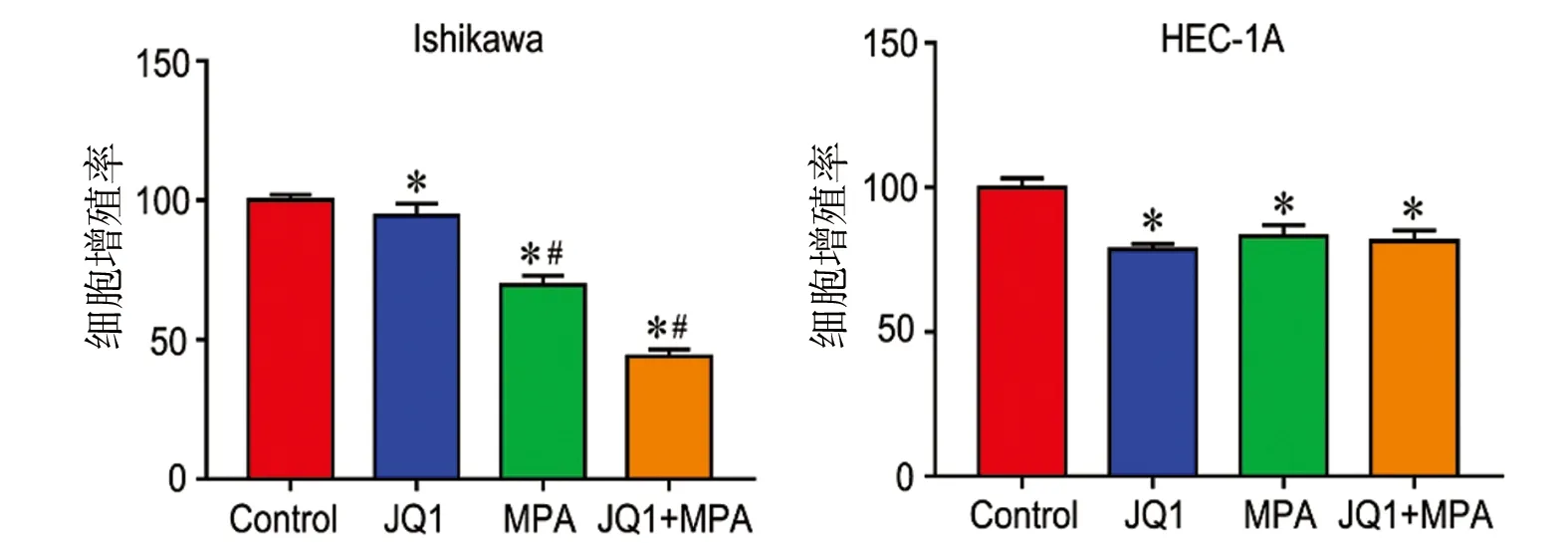
图1 JQ1联合MPA作用48h对子宫内膜癌细胞增殖率的影响
2.2 JQ1联合MPA对子宫内膜癌细胞凋亡作用的影响 1μmol/L JQ1与20μmol/L MPA单独或联合作用于Ishikawa细胞48h,对照组、JQ1组、MPA组和JQ1+MPA组的细胞凋亡率分别为(4.46±2.81)%、(14.42±3.59)%、(28.52±2.38)%和(44.05±4.78)%。与对照相比,MPA组、JQ1组、MPA+JQ1组的细胞凋亡率增加,差异均有统计学意义(P均<0.05)。析因方差分析结果显示: MPA、JQ1诱导凋亡率的主效应差异均有统计学意义(FMPA=211.55,FJQ1=51.165,P均<0.001),MPA和JQ1联合应用的效应差异有统计学意义(F=6.228,P=0.037)。Western blot检测结果显示,与对照组相比,MPA组、JQ1组、MPA+JQ1组的caspase-3和PARP的剪切形式(cleaved caspase 3和cleaved PARP)增加,差异有统计学意义(P均<0.05)。析因方差分析结果显示:MPA、JQ1上调cleaved caspase 3和cleaved PARP的主效应差异均有统计学意义(FMPA=441.679、119.250,FJQ1=203.201、1818.039,P均<0.001),MPA和JQ1联合应用的效应差异有统计学意义(F分别为9.146、15.850,P分别为0.016、0.004)。见图2。

图2 JQ1联合MPA对子宫内膜癌细胞凋亡作用的影响
2.3 JQ1与MPA对子宫内膜癌mTOR/Akt通路的影响 1μmol/L JQ1与20μmol/L MPA单独或联合作用于Ishikawa细胞48h,与对照组相比,MPA组、JQ1组、MPA+JQ1组的p-mTOR和p-Akt表达降低,差异均有统计学意义(P均<0.05)。析因方差分析结果显示:MPA、JQ1降低p-mTOR和p-Akt表达的主效应差异均有统计学意义(FMPA=464.023、56.765,FJQ1=260.576、142.719,P均<0.001),MPA和JQ1联合应用的效应差异有统计学意义(F=5.774、8.397,P=0.043、0.020)。见图3。
2.4 BRD4沉默联合MPA对子宫内膜癌细胞增殖的影响 转染BRD4 siRNA的细胞内BRD4蛋白表达明显降低(图3),表明干扰有效。与对照组相比,BRD4 siRNA组、MPA组、BRD4 siRNA+MPA组的细胞增殖率降低,差异均有统计学意义(P均<0.05)。析因方差分析结果显示:MPA、BRD4 siRNA抑制增殖率的主效应差异均有统计学意义(FBRD4 siRNA=58.191,FMPA=241.199,P均<0.001),MPA和BRD4 siRNA联合应用的效应差异有统计学意义(F=24.453,P=0.001)。见表1及图4。

图3 JQ1与MPA对子宫内膜癌mTOR/Akt通路的影响

表1 BRD4 siRNA联合MPA作用后各组细胞增殖率
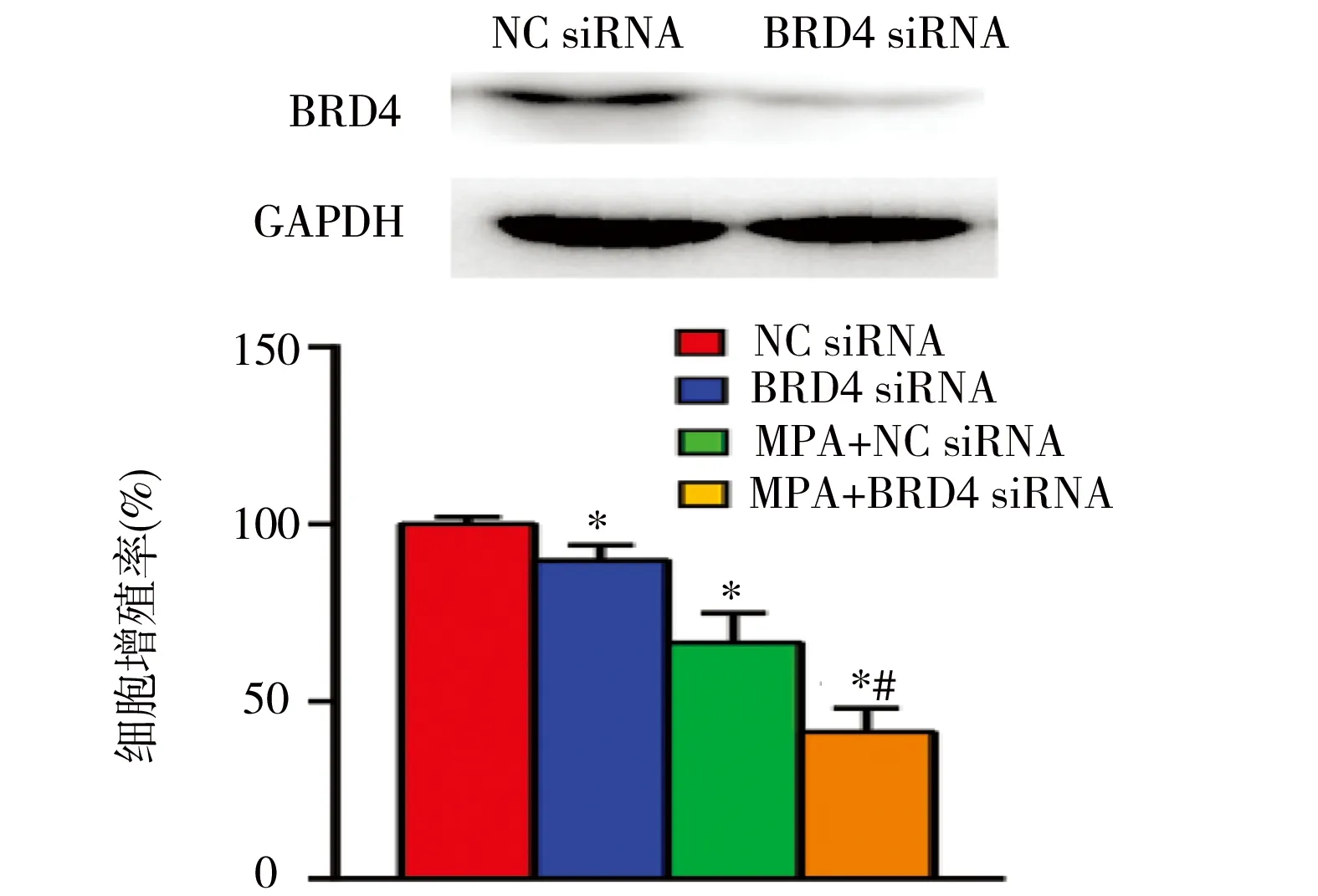
图4 BRD4 siRNA联合MPA作用对子宫内膜癌Ishikawa细胞增殖率的影响
3 讨 论
目前在发达国家,子宫内膜癌的发病率已超过宫颈癌,其发病率在女性生殖系统恶性肿瘤中居于首位,其可能原因与肥胖、高血压、人口老龄化、绝经延迟等有关[1-2]。年轻女性的子宫内膜癌发病率也较前增加,对于有生育要求的年轻患者,高效、大剂量孕激素治疗是保守治疗的主要手段[8],而晚期子宫内膜癌患者亦可应用孕激素治疗[9]。但子宫内膜癌患者因孕激素耐药使得治疗效果不佳,长期应用高效孕激素具有明显毒副作用[10]。因此探索能增强子宫内膜癌对孕激素敏感性的新型药物具有重要的临床意义。
BET(bromodomain and extraterminal domain,BET)是一类含有溴结构域的蛋白质分子,结合乙酰化赖氨酸、募集其他转录因子,参与染色体重塑,促进目的基因的转录[11]。BET蛋白家族包括4个成员:BRD2、BRD3、BRD4和BRDT,其中以BRD4研究最多。BRD4是一种广泛表达的核蛋白,含有两个串联的溴结构域(BD1和BD2),结构上高度保守,但功能差异较大[12]。研究表明,BRD4在乳腺癌、卵巢癌、肺癌、黑色素瘤等多种恶性肿瘤中表达较高[13];BRD4能募集多种转录因子,如NF-κB、AR、Twist、TP53、c-Myc、c-Jun、Stat3等调控Cyclin D、Wnt5a、Bcl2、IL-6以及HMOX1等下游基因的表达,从细胞周期、增殖、炎症以及氧化应激反应等多方面参与癌症的发生发展[11,14]。JQ1是BRD4高效特异抑制剂,竞争结合BRD4转录激活结构域,使转录复合物从染色质解离,进而抑制下游结构基因的转录[15]。研究表明,JQl能显著抑制血液系统肿瘤、胰腺癌、卵巢癌等肿瘤的发生和发展,而且对II型子宫内膜浆液性癌也有显著抑制作用[16-18]。但浆液性癌在子宫内膜癌中仅占1%~10%,JQ1是否对其他高危类型子宫内膜癌也有抑制作用,未见报道。
本课题组选用孕激素敏感型的Ishikawa细胞和孕激素非敏感型的HEC-1A细胞为实验对象[19],结果表明JQ1单独作用能抑制Ishikawa细胞和HEC-1A细胞的增殖,这表明BET抑制剂能抑制子宫内膜癌的生长。JQ1对多种肿瘤具有较好的抑瘤效果,但最近文献报道,单纯应用BET抑制剂在卵巢癌和前列腺癌中可通过激酶重编程或改变BRD4的去泛素化获得耐药性[5,20]。另有研究发现,JQ1不仅抑制BRD4,同时对BRD2和BRD3有一定作用,因BET家族不同成员在细胞内环境中所起的作用不同,使得JQ1疗效具有不确定性[21]。因此,近年来科学家多次强调药物联合应用能达到减少给药剂量,提高疗效降低副反应的目的[7,22]。本课题在前期研究基础上探讨了JQ1联合醋酸甲羟孕酮MPA对细胞增殖和凋亡的影响,发现在Ishikawa细胞中,JQ1联合MPA能明显增强细胞增殖抑制作用和凋亡作用,而对激素非敏感型细胞HEC-1A作用不显著,这提示JQ1与MPA的作用可能与PR相关信号通路有关。 Lian等[23]对125例乳腺癌组织和50例癌旁组织进行免疫组化分析,发现BRD4与ER、PR表达呈负相关。ER、PR是否为BRD4下游的直接靶基因,JQ1的作用是否与直接调控PR基因的转录还是调控其相关通路,尚需进一步的实验研究。
mTOR/Akt通路是细胞重要的存活通路,肿瘤细胞中常存在该通路的异常活化,抑制Akt通路常产生强大的抑瘤效果[24]。近年来研究表明,子宫内膜异位症和子宫内膜癌中Akt通路与PR功能之间存在相互作用[25]。本课题应用MPA和JQ1联合处理子宫内膜癌细胞发现,两者均能抑制mTOR和Akt的磷酸化,联用效果更为显著,表明MPA和JQ1可能通过mTOR/Akt通路抑制细胞的增殖并诱导细胞凋亡,而且联合给药组抑制效果更强。
近年来药物联合治疗恶性肿瘤越来越得到关注,本课题结果证明JQ1能抑制子宫内膜癌细胞增殖并诱导细胞凋亡,与MPA联用后内膜癌细胞增殖抑制和细胞凋亡增加,两者发挥作用的机制可能与抑制mTOR/Akt通路相关。本实验的结果初步探讨了BRD4抑制剂JQ1和MPA联合应用的抑癌机制,为今后进行深入的研究奠定了基础。

