海藻酸钠复合多能诱导干细胞修复椎间盘研究△
周逸驰,张 丹,张 沛,金 祺,孙承军*
(1.武汉科技大学附属华润武钢总医院骨科,湖北武汉 430080;2.武汉大学中南医院超声影像科,湖北武汉 430000)
椎间盘突出是临床上较为常见的脊柱疾病之一,主要原因是随着年龄增长,纤维环及髓核的含水量逐渐降低,蛋白粘多糖含量逐年下降,胶原纤维逐渐溶解,髓核失去弹力及膨胀性能,在受外力时椎间盘发生萎缩、弹性减弱等退行性病变,髓核从而外突[1,2]。在临床上,目前尚无治疗椎间盘退变的有效药物,主要是以改善患者疼痛症状为主,而退变严重或影响日常生活者则需行手术治疗。但手术治疗毕竟是一种终末治疗方法,且为开放性,创伤大。如何有效地阻止和逆转椎间盘退变是目前临床和基础研究的热点。多能诱导干细胞(induced pluripotent stem cells,IPS)的研究成果为治疗椎间盘退变提供了一种新的有效方法及途径[3,4]。在体外,可将IPS细胞定向诱导分化出功能性的多种成熟细胞,如造血和神经细胞、心肌细胞、血管内皮细胞、平滑肌细胞、成骨细胞、上皮细胞、肝细胞[5~10]。IPS细胞的良好生长、分化增殖和分泌细胞外基质需要良好的微环境。但目前尚无一种人工材料具有完全类似天然椎间盘基质材料的结构和良好的生物学活性。近年来,随着组织工程技术的发展,海藻酸钠盐作为支架材料的运用越来越广泛[11]。本研究拟在前期研究的基础上,通过将IPS定向分化的髓核细胞与海藻酸钠盐微球凝胶复合修复退变椎间盘,旨在为临床上治疗椎间盘退变提供新的途径。
1 资料与方法
1.1 实验动物与分组
怀孕13 d C57/B6小鼠和50只8周龄清洁级新西兰大白兔[体重(1.5±0.2)kg]购自上海斯莱克实验动物有限公司,饲养于SPF级动物房,适应环境1周。怀孕3 d C57/B6小鼠的胚胎用于提纯MEF细胞。50只大白兔随机分为对照组、材料组、细胞组和联合组。
1.2 实验处理
1.2.1 IPS制备
取怀孕13 d的胚胎组织,采用胰蛋白酶消化胚胎组织,分离胚胎成纤维细胞,将分离的成纤维细胞分为2份,一份用于诱导IPS细胞,一份用于饲养层细胞。将分离的成纤维细胞采用包装OCT4、SOX2、KLF4和C-myc的慢病毒感染,培养于DMEM高糖培养基(15% FBS、1%非必需氨基酸、1%丙酮酸钠、1%谷丙氨酸二肽、55 μM β-巯基乙醇、25 μg/ml庆大霉素、0.55 mM丙戊酸、100 U/ml LIF细胞因子),形成IPS细胞克隆,并用CD24+磁珠纯化。将纯化的IPS细胞采用胰酶消化,PBS洗涤细胞,将细胞重悬于髓核细胞分化培养基中,每周更换培养基2次,细胞连续培养28 d后髓核细胞分化成功。
1.2.2 IPS与海藻酸钠复合盐微球凝胶复合
将诱导分化的髓核细胞采用0.25%胰酶消化,重悬于PBS溶液中将细胞密度调整为1×108/ml;将1%医用海藻酸钠盐微球凝胶2 mg/L,按l∶1比例配置髓核细胞与海藻酸钠盐微球凝胶混合溶液。
1.2.3 椎间盘退变模型建立
40只新西兰大白兔采用髓核抽吸法建立L3/4、L4/5和L5/6椎间盘退变模型。采用3%巴比妥耳缘静脉注射全麻,并取侧卧腰椎侧前方手术入路,沿第12肋术向下至髂嵴作6 cm长纵切口,可见胸腰筋膜后层。切开胸腰筋膜后层,在骶棘肌和腰方肌内缘间行钝性分离。剪开胸腰筋膜前层,纵行分离腰大肌,暴露椎体和椎间盘。以髂嵴连线通过L5/6椎间盘来定位,用4号线于L3/4、L4/5、L5/6椎间盘水平软组织打结做标记,并用2lG针头针在上述椎间盘侧前方穿刺,用持针器夹持针头使尖端保留5 mm,平行终板方向刺入,接10 ml注射器带负压抽吸髓核组织,依次逐层关闭切口。造模后2周随机法取40只实验兔进行腰椎间盘MRI扫描,判断造模情况。对照组实验兔只做暴露椎间盘,不吸取髓核组织。
1.2.4 体内干预处理
50只新西兰大白兔分为5组,10只作为对照组,40只建立兔椎间盘退变模型,并随机分为4组,联合组采用微量注射器在兔退变椎间盘注入IPS定向分化的髓核细胞与海藻酸钠盐微球凝胶材料复合物,材料组在退变椎间盘注入不含髓核细胞的海藻酸钠盐微球凝胶材料,细胞组在L5/6退变椎间盘注射诱导分化的髓核细胞,治疗8周后,开始进行后续实验。
1.3 检测指标
1.3.1 番红O染色和组织学评分
取5组实验兔的软骨组织,采用10%多聚甲醛进行固定,脱钙,并制备石蜡切片。常规脱蜡至水,将组织标本至于新鲜配置的WEIGERT染液中染色5 min,结束后再酸性乙醇分化液中分化15 s,用蒸馏水洗涤10 min,在固绿染色液中染色5 min,蒸馏水洗涤1 min,置入Safranin O染色液中染色2 min,蒸馏水洗涤2 min,然后采用95%乙醇和无水乙醇脱水,二甲苯透明后封片。评分方法采用国际骨关节炎研究协会评分系统的改良OARSI评分。评分标准:正常关节软骨为0分;聚蛋白聚糖、基质、软骨细胞丢失及基质出现纤维化改变,占全部软骨5%~10%,评1分;占全部软骨11%~25%,评2分;占全部软骨26%~50%,评3分;占全部软骨51%~75%,评4分;占全部软骨75%以上,评5分。总分范围为0~30分。
1.3.2 免疫组化检测
取5组实验兔的软骨组织,采用10%多聚甲醛进行固定,脱钙,并制备石蜡切片。然后按照常规染色方法对椎间盘组织Ⅱ型胶原和MMP3蛋白进行染色,最后切片采用中性树脂封片,显微镜下观察。并对免疫组化进行评分。
1.4 统计学方法
所有数据均采用SPSS 19.0统计学软件进行分析,计量数据采用平均值±标准差表示,计量数据比较采用方差分析,组间两两比较采用LSD法,P<0.05表示差异有统计学意义。
2 结果
2.1 IPS细胞鉴定
本研究在成纤维细胞MEF中过表达转录因子成功诱导产生了IPS细胞,采用磁珠分选CD24+iPS细胞,在低氧条件下诱导产生了髓核细胞。低氧诱导分化的细胞能够表达髓核细胞的标记物integrin α6,cytokertin5/8和vimetin等,而未经诱导分化的细胞则不表达。
2.2 组织学评分结果
将IPS诱导分化的髓核细胞与海藻酸钠盐微球凝胶复合注射退变椎间盘,组织学椎间盘软骨的变化见图1,表1。与对照组软骨退变评分比较,模型组、材料组、细胞组和联合组椎间盘软骨退变评分明显增加,差异有统计学意义(P<0.05)。与模型组比较,细胞组和联合组椎间盘软骨退变水平显著改善,差异有统计学意义(P<0.05)。与细胞组比较,联合组椎间盘改善更为显著,差异有统计学意义(P<0.05)。模型组和材料组比较,椎间盘软骨退变评分无统计学意义(P>0.05)。
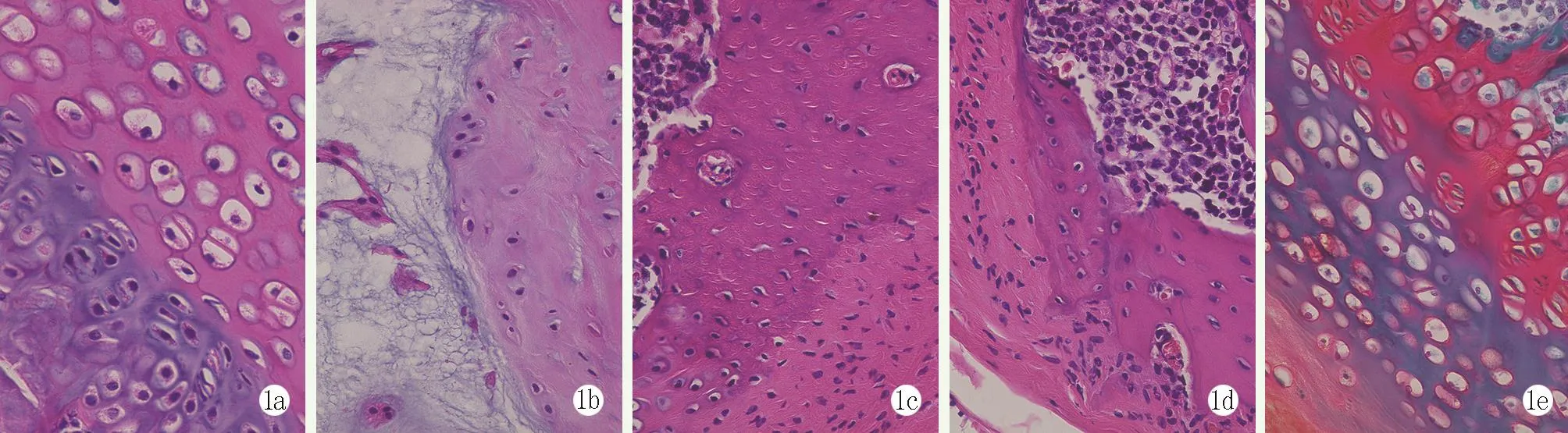
图1 5组椎间盘软骨退变情况组织学观察(HE,×200) 1a:对照组,椎间盘软骨表面基质和软骨细胞紧密排列,表面光滑 1b:模型组,兔椎间盘可见基质与软骨细胞丢失,软骨细胞表面出现纤维化改变 1c:材料组,对椎间盘退变无影响1d:细胞组也有一定程度改善 1e:联合组,椎间盘经治疗后基质和软骨细胞退变得到很大程度改善
2.3 免疫组化检测结果
免疫组织化学分析5组兔椎间盘组织Ⅱ型胶原和MMP3蛋白的表达水平见表1。与对照组Ⅱ型胶原比较,模型组、细胞组、材料组和联合组Ⅱ型胶原蛋白表达水平显著下调,差异有统计学意义(P<0.05);与模型组比较,细胞组和联合组Ⅱ型胶原蛋白表达水平显著上调,其中联合组增加更显著,差异有统计学意义(P<0.05)。与对照组MMP3蛋白表达水平比较,模型组、细胞组、材料组和联合组MMP3蛋白表达水平显著上调,差异有统计学意义(P<0.05);与模型组比较,细胞组和联合组MMP3蛋白表达水平显著下调,其中联合组下调更显著,差异有统计学意义(P<0.05)。
表1 5组动物椎间盘组织检测结果(±s)与比较

表1 5组动物椎间盘组织检测结果(±s)与比较
images/BZ_69_205_3017_506_3083.png组织学评分(分)II型胶原(OD值)images/BZ_69_506_3017_804_3083.png1.27±0.19 8.59±2.01images/BZ_69_804_3017_1103_3083.png19.43±3.48 2.18±1.15images/BZ_69_1103_3017_1418_3083.png18.59±4.01 2.87±1.38images/BZ_69_1418_3017_1755_3083.png13.11±3.81 4.59±1.84images/BZ_69_1755_3017_2099_3083.png5.90±2.01 6.94±2.31images/BZ_69_2099_3017_2276_3083.pngimages/BZ_69_205_3150_506_3216.pngimages/BZ_69_506_3150_804_3216.pngimages/BZ_69_804_3150_1103_3216.pngimages/BZ_69_1103_3150_1418_3216.pngimages/BZ_69_1418_3150_1755_3216.pngimages/BZ_69_1755_3150_2099_3216.pngimages/BZ_69_2099_3150_2276_3216.png0.003 0.011
3 讨论
细胞治疗为椎间盘退变提供了一种全新的治疗理念。椎间盘退变的本质是髓核细胞减少,导致椎间盘出现退化。目前研究证实采用向椎间盘注射髓核细胞可显著缓解椎间盘退变;另有研究采用骨髓来源的间充质干细胞也可以缓解椎间盘退变,达到治疗椎间盘退变的功能[12,13]。多能诱导干细胞为临床细胞治疗提供了新的途径。目前采用不同的诱导条件可将IPS细胞诱导分化成多种成熟细胞[14]。本研究采用在成纤维细胞中过表达转录因子诱导产生IPS细胞,并通过筛选和优化分化条件,成功在低氧条件下产生了髓核细胞。采用免疫荧光分析发现,IPS诱导分化的细胞均表达髓核细胞的标记物,这一研究为后续试验奠定了基础。
虽然直接采用髓核细胞注射治疗能够起到治疗椎间盘退变的作用,但是研究发现,髓核细胞治疗退变椎间盘还需要为其提供良好生长、不断分化增殖和分泌细胞外基质的微环境[15]。天然的椎间盘基质材料不仅需要具备良好的强度,而且能通过特定的细胞信号传递系统对细胞的粘附和向髓核定向分化进行精确的调控。随着组织工程技术的发展,海藻酸钠盐作为支架材料的运用越来越广泛。海藻酸钠盐支架稳定性好,具有良好的生物降解性和生物相容性,能够支持种子细胞分布,并为其提供了良好的微环境[16]。本研究将海藻酸钠盐微球凝胶和IPS定向分化的髓核细胞复合,分析了其对兔退变椎间盘的修复作用。
研究结果显示,海藻酸钠盐微球凝胶和IPS定向分化的髓核细胞复合治疗8周后,可见兔椎间盘软骨退变得到显著缓解,明显优于单纯材料和单纯细胞治疗的效果。椎间盘退变主要表现为胶原蛋白的丢失和细胞外基质降解的增加。II型胶原主要由软骨细胞表达,也被称为软骨胶原,主要存在于软骨,角膜,椎间盘髓核等组织中,在椎间盘承受压力方面发挥主要作用。在椎间盘发生退变时,II型胶原会逐渐减少[17]。MMP-3是基质降解酶亚家族之一,是降解细胞外基质的主要酶类,在细胞外基质的降解中起重要作用,可裂解II型胶原的非螺旋区以及其他种类胶原,最近导致软骨降解[20]。本研究结果说明海藻酸钠盐微球凝胶和IPS定向分化的髓核细胞复合治疗显著改善了椎间盘的内环境,使得软骨组织开始重新合成,降解减少。此外,本研究也观察到单纯IPS定向分化的髓核细胞注射液具有一定的治疗作用,但是效果远逊于联合治疗法。
综上所述,海藻酸钠盐微球凝胶和IPS定向分化的髓核细胞复合对兔退变椎间盘具有治疗作用。

