棕榈酸诱导BRL-3A细胞产生胰岛素抵抗的作用机制*
崔敏萱,沈歆,盖守昌,井娟,王力彬,张生勇,刘雪英
(中国人民解放军空军军医大学1.基础医学院四大队;2.药学系药物化学教研室,西安 710032)
胰岛素抵抗(insulin resistance,IR)是糖尿病发展进程中首先出现的临床表现。长期IR会诱发一系列代谢性疾病,如肥胖、糖调节损伤、2型糖尿病、脂肪肝、脂代谢紊乱等[1]。肝脏是胰岛素作用的主要靶器官,能够储存大量肝糖原,通过糖异生途径将乳酸等代谢产物转变为葡萄糖,维持机体血糖稳定。研究表明,2型糖尿病患者的肝脏糖异生水平较正常人明显升高,因此肝脏糖异生是糖尿病治疗中不可忽视的重要环节[2]。
建立IR肝细胞模型有助于深入研究IR发生机制,筛选抗IR药物。目前已成熟应用的、最常见的肝细胞模型是高胰岛素诱导HepG2肝癌细胞IR模型[3]。大鼠正常肝细胞IR模型较少见,目前国内仅有少量文献报道,笔者尚未见国外文献关于系统建立大鼠正常肝细胞IR模型及机制研究的报道,所以筛选出诱导正常肝细胞IR模型的条件有重要意义。
脂肪酸是构成人体脂肪和类脂的基本物质,大量流行病学研究表明,肥胖者血清游离脂肪酸(free fatty acid,FFA)水平普遍升高。高游离脂肪酸血症是肥胖引发IR的重要致病因素[4]。高浓度FFA能够抑制基础状态和胰岛素刺激状态的组织对葡萄糖的摄取与利用,造成组织对胰岛素的敏感性降低。利用FFA的这种特性,可以将其作为诱导不同类型细胞产生IR的工具。油酸、硬脂酸和棕榈酸是血液中FFA常见的3种类型,均属饱和长链脂肪酸。研究报道,利用棕榈酸可以建立HepG2和3T3-L1细胞的IR模型[3,5]。
BRL-3A是大鼠正常肝细胞系,是研究正常肝细胞增殖及氧化损伤常用细胞模型。胰岛素受体底物1(insulin receptor substance 1,IRS-1)与胰岛素受体作用后,参与胰岛素及其信号通路传导,是胰岛素信号通路上游的一个重要分子。IRS-1被抑制后,进一步抑制磷脂酰肌醇-3'-羟基激酶(phosphoinositide-3-kinase,PI3K)途径,使葡萄糖转运蛋白4(glucose transporter 4,GLUT4)被抑制,从而使组织不能有效利用葡萄糖,发生IR[6]。本实验以BRL-3A细胞为研究对象,通过棕榈酸诱导系统建立大鼠正常肝细胞IR模型,并初步探索其发生机制。
1 材料与方法
1.1主要仪器Western blotting系统(Bio-Rad,美国);酶标仪(Molecular Devices,美国);高速低温离心机(Eppendorf,美国);二氧化碳细胞培养箱(Thermo Electron,美国);YI-875SA医用超净工作台(江苏吴江市净化设备总厂)。
1.2试药与试剂棕榈酸(美国Sigma公司,批号:1001002747,含量≥99%);胰岛素(美国Sigma公司,批号:18883664,含量≥99%),MEM培养基(美国Gibco公司,批号:AD21573269);胎牛血清(美国Hyclone公司,批号:P140022);牛血清清蛋白(albumin from bovine serum,BSA,美国Sigma公司,批号:CO0332,含量≥98%);CCK8检测盒(七海生物科技有限公司);葡萄糖检测盒(南京建成生物工程研究所);二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(碧云天生物技术研究所,批号:P00125);十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrop-horesis,SDS-PAGE)试剂盒(碧云天生物技术研究所,批号:P0012A);IRS-1、PI3K、磷酸化丝氨酸-苏氨酸激酶(phosphorylated serine-threonine kinase,p-AKT)、AKT、GLUT4抗体(美国Abcam公司,批号分别为:GR95405-23,GR266942-1,GR242901-23,GR242901-21,GR262376-1)。
1.3细胞BRL-3A大鼠正常肝细胞(陕西帆昌生物科技公司)。
1.4棕榈酸、胰岛素储备液配置取棕榈酸25.6 mg[7]溶于无水乙醇1 mL中,制成100 mmol·L-1棕榈酸溶液,溶解时加热至50 ℃,取0.25 mL 加入预热55 ℃的10% BSA溶液4.75 mL 溶解,得到终浓度为5 mmol·L-1的棕榈酸母液。经孔径0.2 μm水相滤膜滤过后,-20 ℃保存,实验前37 ℃预热后按比例稀释。取胰岛素固体2.904 mg溶于5 mL、pH值2~3的盐酸(HCl)中,制成1×10-4mol·L-1胰岛素母液。经孔径0.2 μm水相滤膜滤过后,-20 ℃保存,实验前按比例稀释。
1.5BRL-3A细胞培养 BRL-3A细胞复苏后,培养于含10% 胎牛血清、100 kU·L-1青链霉素的MEM培养基中,在5%二氧化碳(CO2)、37 ℃的细胞培养箱中培养。待汇合度达90%后,1:2传代,或按每孔约1×104个接种于96孔培养板,汇合度超过80%后分组实验。
1.6棕榈酸、胰岛素对BRL-3A细胞增殖的影响(CCK8实验) 将细胞以每孔约1×104个接种于96孔培养板中。按“1.5”项方法培养至汇合度超过80%后。然后分成正常对照组、棕榈酸组(0.025,0.05,0.1,0.2,0.25,0.4,0.6 mmol·L-1棕榈酸)、胰岛素组(1×10-7mol·L-1胰岛素)及空白试剂组(5×10-7mol·L-1HCl、0.6%乙醇),每组设置8组复孔。采用CCK8法分别测定6,12,24,36 h时细胞的生长状况。CCK8检测:终止培养后,加入含CCK8的新培养液100 μL,继续培养2 h,充分反应。反应结束后,检测波长450 nm处各孔的吸光度值。
1.7不同时间不同浓度棕榈酸、胰岛素对BRL-3A细胞葡萄糖代谢的影响 实验分组:正常对照组、棕榈酸组(0.025,0.05,0.1,0.2,0.25,0.4 mmol·L-1棕榈酸),每组设置12组复孔。按“1.5”项方法将细胞接种于96孔板,待汇合度超过80%后,按实验分组加入含不同诱导因素的MEM培养基。通过葡萄糖氧化酶-过氧化物酶法[8],分别测定2,6,12,24 h时培养液中含有葡萄糖的浓度,即可通过计算得到各组细胞的葡萄糖消耗量。
葡萄糖氧化酶-过氧化物酶检测:终止培养后,吸出所有培养液并按说明书操作加入工作液,混匀后37 ℃,保温15 min,用酶标仪测定波长在505 nm各孔的吸光度值。
1.8不同时间不同浓度棕榈酸诱导后BRL-3A细胞对基础糖转运和胰岛素刺激糖转运的影响 在检测“1.7”项各组培养液中所剩糖浓度后,吸出原培养液,每组一分为二,即每组6个复孔:一半加入含1×10-7mol·L-1胰岛素的MEM培养基,另一半加入空白的MEM,分别测2,24,48,72 h后培养液中所剩葡萄糖浓度。葡萄糖含量测定同“1.7”项实验。
1.9免疫印迹法检测棕榈酸诱导BRL-3A细胞产生IR后IRS-1等靶蛋白表达的变化 实验分组:正常对照组、IR组。按“1.5”项方法培养至汇合度超过90%后,正常对照组加入空白的MEM培养基,IR组加入含0.2 mmol·L-1棕榈酸的MEM培养基,作用12 h后,采用免疫印迹法,将各组细胞用预冷的组织裂解液裂解并用超声仪打碎,然后在4 ℃以12 000×g离心15 min,取上清液作样本,用BCA蛋白定量法测定各样本蛋白含量。用10%SDS-PAGE 凝胶分离蛋白,然后用半干电转的方法将蛋白转至聚偏二氟乙烯[poly(vinylidene fluoride),PVDF]膜上,再用5%脱脂奶粉封闭,室温下封闭1 h后加入一抗4 ℃封闭过夜,洗膜后加辣根过氧化物酶标记的二抗,室温轻摇封闭1 h。PBST充分洗膜后,加入适量电化学发光液涂匀,凝胶成像分析系统显影、摄像、分析。
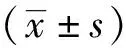
2 结果
2.1BRL-3A细胞的培养结果 BRL-3A细胞复苏后形成细胞悬液,吹匀后按要求种于96孔板或者培养瓶中,6~10 h形成单层贴壁细胞,镜下观察细胞贴壁生长,不规则排列,形态多为梭形、三角形或者多边形,呈上皮样外观。
2.2棕榈酸、胰岛素对BRL-3A细胞增殖的影响 空白试剂组(5×10-7mol·L-1HCl、0.6%乙醇)每个时间点的吸光度值与正常对照组比较均差异无统计学意义(P>0.05),表明空白试剂对细胞活性无干扰。结果见图1。0.025~0.2 mmol·L-1棕榈酸及1×10-7mol·L-1胰岛素作用于BRL-3A细胞36 h以内,其吸光度值与正常对照组比较差异无统计学意义(P>0.05),表明其对细胞增殖没有抑制作用。0.25 mmol·L-1棕榈酸作用于细胞时,从24 h开始吸光度值与正常对照组比较差异有统计学意义(P<0.05),0.4和0.6 mmol·L-1棕榈酸从6 h开始其吸光度值与正常对照组比较差异有统计学意义(P<0.01),显示其对BRL-3A细胞增殖产生抑制作用。结果见图2。

A.正常对照组;B.空白试剂组(5×10-7 mol·L-1 HCl);C.空白试剂组(0.6%乙醇)。
A.正常对照组;B.0.6 mmol·L-1棕榈酸组;C.0.4 mmol·L-1棕榈酸组;D.0.25 mmol·L-1棕榈酸组;E.0.2 mmol·L-1棕榈酸组;F.0.1 mmol·L-1棕榈酸组;G.0.05 mmol·L-1棕榈酸组;H.0.025 mmol·L-1棕榈酸组;I.1×10-7 mol·L-1胰岛素组。①与正常对照组比较,t=3.061~59.900,P<0.01;②与正常对照组比较,t=2.592,18.860,P<0.05。
2.3不同时间不同浓度棕榈酸对BRL-3A细胞葡萄糖代谢的影响 BRL-3A细胞用不同浓度棕榈酸培养2 h后,0.4 mmol·L-1棕榈酸组葡萄糖消耗量较正常对照组低(P<0.01),表明高浓度棕榈酸作用2 h后BRL-3A细胞已开始出现IR;6 h后,0.25,0.2 mmol·L-1PA组葡萄糖消耗量开始降低,与正常对照组比较差异有统计学意义(P<0.05);12 h后,0.4,0.25,0.2 mmol·L-1PA组葡萄糖消耗量与正常对照组比较明显降低(P<0.01),表明3种浓度作用12 h后均出现显著IR表征;24 h后,0.4,0.25,0.2及0.1 mmol·L-1PA组葡萄糖消耗量均较正常对照组低(P<0.01,P<0.05)。结果见图3。

A.正常对照组;B.0.4 mmol·L-1棕榈酸组;C.0.25 mmol·L-1棕榈酸组;D.0.2 mmol·L-1棕榈酸组;E.0.1 mmol·L-1棕榈酸组;F.0.05 mmol·L-1棕榈酸组;G.0.025 mmol·L-1棕榈酸组。①与正常对照组比较,t=4.262~31.400,P<0.01;②与正常对照组比较,t=2.185~2.685,P<0.05。
2.4不同时间不同浓度棕榈酸诱导后BRL-3A细胞对基础糖消耗和胰岛素刺激糖消耗的影响 0.25,0.2 mmol·L-1棕榈酸诱导BRL-3A细胞12,24 h和0.1 mmol·L-1棕榈酸诱导BRL-3A细胞24 h后,加胰岛素刺激的糖转运和不加胰岛素刺激的基础糖转运与正常对照组比较,2,12,24 h时培养液中葡萄糖的浓度均较高,说明其对胰岛素刺激的糖转运和基础糖转运均产生抑制,且抑制作用可持续24 h。并且0.25和0.2 mmol·L-1棕榈酸加胰岛素刺激的糖转运组培养液中葡萄糖的浓度减少的程度呈现时间累加效应。0.4 mmol·L-1棕榈酸诱导BRL-3A细胞6 h后,加胰岛素刺激的糖转运和不加胰岛素刺激的基础糖转运与正常对照组比较,2,12,24 h时培养液中葡萄糖的浓度均较高,说明其作用6 h即能对胰岛素刺激的糖转运和基础糖转运产生抑制作用。结合“2.2”项实验结果,表明0.4 mmol·L-1棕榈酸作用6 h和0.25 mmol·L-1棕榈酸作用24 h后对BRL-3A细胞产生毒性作用。另外,BRL-3A细胞IR模型与棕榈酸作用的时间和浓度有一定的剂量-时间效应关系。结果见表1,2。

表1 不同时间不同浓度棕榈酸诱导BRL-3A细胞后培养液中葡萄糖的浓度
2.5棕榈酸诱导的BRL-3A细胞IR模型稳定性评估
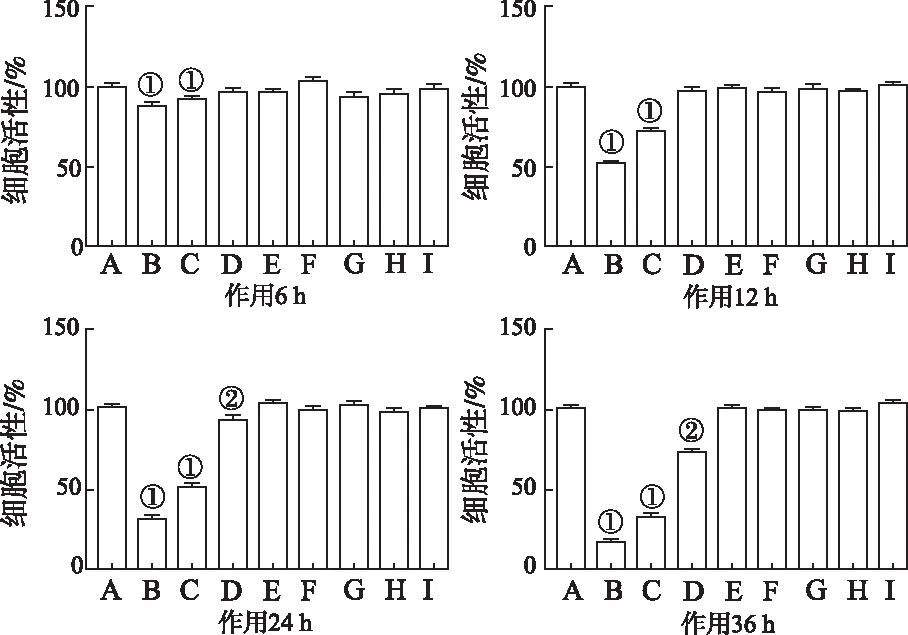
2.5.1IR模型BRL-3A细胞长期基础葡萄糖消耗变化 通过上述“2.3”“2.4”项葡萄糖消耗实验,以及“2.2”项细胞增殖实验,初步确定使用0.2 mmol·L-1棕榈酸作用12 h作为诱导BRL-3A细胞IR模型的条件。使用该条件诱导BRL-3A细胞IR后,继续培养至48 h,发现其基础葡萄糖消耗量较正常对照组低(t2 h=2.842,P<0.05;t12 h=11.280,t24 h=17.430,t48 h=35.750,P<0.01),且随着培养时间增加,细胞葡萄糖消耗量与正常对照组比较减少量逐渐增加,表明该IR模型在48 h内较稳定。结果见图4。
①与正常对照组比较,P<0.05;②与正常对照组比较,P<0.01。

表2 不同时间不同浓度棕榈酸和胰岛素刺激BRL-3A细胞后培养液中葡萄糖的浓度
2.5.2胰岛素抵抗BRL-3A细胞长期胰岛素刺激的葡萄糖消耗变化 同“2.5.1”项实验,使用0.2 mmol·L-1棕榈酸作用12 h作为诱导BRL-3A细胞IR模型的条件。使用该条件诱导BRL-3A细胞产生IR后,继续培养至48 h,同样发现其胰岛素刺激的葡萄糖消耗量与正常对照组比较明显降低(t2 h=6.336,t12 h=12.090,t24 h=19.550,t48 h=27.550,P<0.01),且随着培养时间增加,细胞葡萄糖消耗量与正常对照组比较减少量逐渐增加,表明该IR模型在48 h内较稳定。结果见图5。

①与正常对照组比较,P<0.01。
2.6免疫印迹法检测棕榈酸诱导BRL-3A细胞产生IR后IRS-1等靶蛋白表达的变化 同“2.5”项实验,使用0.2 mmol·L-1棕榈酸作用12 h作为诱导BRL-3A细胞IR模型的条件,观察胰岛素相关蛋白表达变化。与正常对照组比较,IR组细胞IRS-1、PI3K、p-AKT/AKT、GLUT4表达均明显下降(t=10.950,6.307,6.728,8.045,P<0.05)。结果见图6。
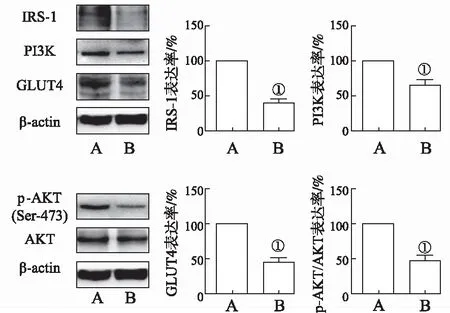
A.正常对照组;B.IR组。①与正常对照组比较,P<0.05。
3 讨论
IR是指机体靶器官、靶组织对胰岛素反应的敏感性下降,从而导致生理浓度的胰岛素不能将机体血糖维持在正常水平。IR是2型糖尿病的重要致病因子,也是其最主要的病理表现。目前,IR的致病机制并不完全清楚。建立适宜的IR细胞模型有助于在细胞及分子水平深入研究其发生机制,也为体外筛选防治IR的药物提供便利条件。肝脏是胰岛素作用的重要靶器官,能够维持体内糖脂代谢平衡,并与肝脏IR、IR综合征及脂肪肝等病症密切相关[9]。目前使用的肝细胞IR模型多为HepG2肝癌细胞,正常肝细胞模型较少被提及。
胰岛素能够通过PI3K/AKT信号通路维持机体血糖稳态。胰岛素首先与细胞膜外的胰岛素受体结合,使胰岛素受体发生构象变化,其细胞膜内的酪氨酸位点发生自磷酸化,进一步吸引IRS和胰岛素受体结合,导致自身酪氨酸位点磷酸化。磷酸化的胰岛素受体底物会进一步与PI3K的调节亚基结合,激活PI3K下游小分子如PIP3,PIP3与AKT结合,促进AKT被磷酸化,增加活性。从而激活GLUT4,促进葡萄糖吸收,增加葡萄糖消耗[10]。
本实验研究发现,棕榈酸可以成功诱导BRL-3A细胞胰岛素模型,0.4 mmol·L-1棕榈酸作用6 h、0.25 mmol·L-1棕榈酸和0.2 mmol·L-1PA作用12 h以及0.1 mmol·L-1PA作用24 h均能成功诱导BRL-3A细胞产生IR。0.4 mmol·L-1棕榈酸处理6,12,24 h,0.25 mmol·L-1棕榈酸和0.2 mmol·L-1处理12,24 h后均可抑制胰岛素刺激的糖转运和无胰岛素刺激的基础糖转运,说明此诱导模型已经产生IR,这种抑制作用呈剂量-时间依赖性。并且通过移除棕榈酸刺激后长期培养该细胞,发现抑制作用可以持续48 h。0.4和0.25 mmol·L-1棕榈酸均可成功诱导BRL-3A细胞产生IR,但同时对BRL-3A细胞增殖产生影响,分别从6 h和24 h开始出现毒性作用。而低浓度的棕榈酸(0.2 mmol·L-1)作用12 h后也能诱导BRL-3A细胞产生IR,同时能够抑制胰岛素刺激的糖转运和不加胰岛素刺激的基础糖转运,并且在36 h内对BRL-3A细胞增殖无影响。
综上所述,0.2 mmol·L-1棕榈酸处理12 h可作为诱导BRL-3A细胞IR模型的方法。在成功诱导的BRL-3A细胞IR模型中,IRS-1、PI3K、p-AKT/AKT、GLUT4表达均明显下降,提示棕榈酸可能通过抑制IRS-1表达,导致PI3K/AKT通路被抑制,进一步下调GLUT4表达,使糖代谢受阻,导致IR。本研究成功建立了BRL-3A细胞IR模型,并初步在蛋白水平阐述了棕榈酸可能的作用机制,为进一步探究大鼠正常肝细胞产生IR及相关药物体外筛选提供参考依据。

