阿托伐他汀对冠状动脉无复流作用机制的研究进展*
宋琼,毕丽丽,张金杰,任瑞,赵希军
(滨州医学院附属医院1.心血管内科;2.风湿免疫科;3.药学部;4.门诊部,滨州 256603)
冠状动脉无复流现象是指冠状动脉梗塞经过治疗解除后,缺血的心肌仍然得不到有效的血液灌注,同时存在其他器质性病变如夹层、痉挛、栓塞及狭窄等情况[1-2]。冠状动脉无复流现象是经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)后常见的并发症。无复流是PCI术后再发心肌梗死的独立预测因素[3],因此提高对无复流现象的预测及正确及时的用药等对于PCI具有非常重要的意义[4]。目前关于冠状动脉无复流现象的发生机制尚不完全清楚,可能与血小板聚集等多种因素有关[5],针对这些疾病相关因素,临床有多种治疗药物选择,例如他汀类药物、血管扩张药、血小板GPⅡb/Ⅲa受体拮抗药、钾离子通道开放药、溶栓药等。阿托伐他汀除了调脂作用外还有他汀类的多效性,具有抗氧化、抗炎、抗血栓、抗动脉粥样硬化、改善内皮功能、稳定斑块等作用[6],因此目前有较多的关于其在冠状动脉无复流中相关研究[7-11],笔者在本文主要综述阿托伐他汀在冠状动脉无复流作用机制方面的体内外及临床研究。
1 抗炎作用
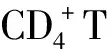
IL-6作为白细胞和内皮细胞产生的一种重要炎症递质,在炎症调控中处于枢纽位置。赵希军等[14]通过建立兔急性心肌梗死模型考察了单剂量应用阿托伐他汀(10 mg·kg-1)预防治疗对兔急性心肌梗死再灌注后无复流现象的影响。结果发现,缺血及再灌注损伤等会诱发血清中IL-6的生成及释放,同时可随时间延长呈递增趋势,提示炎症反应可能是导致缺血-再灌注时发生无复流的主要机制之一。同时也发现,单剂量阿托伐他汀预防治疗后无复流现象显著改善,并能有效抑制缺血及再灌注后血清IL-6水平的升高,有效降低血清IL-6水平,提示单剂量阿托伐他汀可能通过降低血清IL-6水平等抗炎作用来减轻无复流现象。
刘巧丽等[15]发现,大鼠急性心肌缺血-再灌注后存在无复流现象,该研究采用阿托伐他汀2 mg·kg-1·d-1预处理,考察大鼠急性心肌缺血-再灌注后无复流现象及前炎症因子IL-17表达的变化。结果显示,通过阿托伐他汀预处理后,可显著减轻大鼠心肌缺血-再灌注后无复流区域的面积,推测其作用机制有可能与阿托伐他汀通过抑制IL-17的表达进而降低血清IL-6的水平等相关因素有关。但阿托伐他汀调控IL-17释放的作用机制仍需进一步研究。
IL-10是一种作用较强的抗炎因子,能够抑制平滑肌增殖,减轻血管损伤后的内膜增生。吕水利等[16]开展的一项包含110例拟行PCI的急性ST段抬高型心肌梗死患者的随机对照临床试验发现,强化剂量阿托伐他汀(PCI前6 h口服阿托伐他汀80 mg·d-1,术后改为40 mg·d-1)组IL-10因子水平显著升高,提示阿托伐他汀可能有助于促进PCI术后机体抗炎和失衡状态恢复。
除了炎症反应,氧化应激反应在心肌缺血及再灌注损伤中也起着关键作用。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)在诱导内源性抗氧化酶对抗氧化应激方面起着不可或缺的作用。研究发现[17],Nrf2与抗氧化反应元件(antioxidant response element,ARE)结合形成的Nrf2/ARE信号通路可增加解毒途径和抗氧化能力来保护心脏成纤维细胞和心肌细胞对抗氧化应激,保护机体免受一些活性物质或毒害物质的损伤,如过氧化氢酶、超氧化物歧化酶、谷胱甘肽硫转移酶、醌氧化还原酶及血红素加氧酶1等。阿托伐他汀还能提高Nrf2和血红素氧合酶-1的水平。上述研究表明阿托伐他汀可能通过激活Nrf2/ARE信号通路,对冠状动脉疾病患者发挥重要的心脏保护作用。
2 改善内皮功能
血浆内皮素-1(endothelin-1,ET-1)水平升高可能是导致血管功能障碍和心血管疾病的主要危险因素,内皮细胞受损可能导致血管微循环障碍[18]。血浆ET-1主要通过内皮细胞的合成与分泌,当内皮细胞受到刺激后ET-1的合成并释放会明显增多。赵希军等[19]通过动物实验研究发现,心肌缺血与再灌注现象可能会诱发局部心肌ET-1的合成释放增加,其中无复流区的心肌组织中ET-1含量升高比复流区心肌组织增加量更显著,推测该现象发生原因可能是由于该区无血流灌注,使受损内皮细胞合成分泌的的ET-1无法正常进入血液循环系统中,导致ET-1在心肌组织中蓄积增加。无复流现象的微血管功能障碍的发病机制复杂,由较多因素导致,如微血管痉挛、粥样斑块及血栓引起的血管远端栓塞、血小板及粒细胞导致的微血管的填塞、组织水肿导致的内皮肿胀、压迫微血管系统现象、氧化应激以及炎症因素等都可能为其发生机制。研究表明,单剂量应用阿托伐他汀预防治疗,能够显著减少急性心肌梗死再灌注后血浆及心肌组织中ET-1的合成分泌水平,内皮细胞受损及微循环障碍等因素可能是引发无复流发生的重要机制之一,临床单剂量应用阿托伐他汀预防治疗可能是通过保护内皮细胞及保障微循环完整性等来减少无复流现象的发生[20]。
SAHEBKAR等[21]开展的一项荟萃分析,评估了他汀类药物对血液中ET-1浓度的影响。结果表明,他汀类药物治疗能够显著降低血浆ET-1浓度,这种治疗效果不受他汀类药物治疗时间因素的影响,研究还发现脂溶性药物(阿托伐他汀、辛伐他汀、氟伐他汀等)能够显著降低ET-1浓度,但亲水性药物(普伐他汀)作用甚微。该现象提示他汀类药物的这种作用可能受他汀类药物亲脂性因素的影响。
3 上调内皮型一氧化氮合酶(nitric oxide synthase,NOS)水平及促进NO合成
血清中的NO活性降低与血管内皮功能障碍密切相关,周莹峰[22]观察常规剂量(20 mg)和大剂量(80 mg)阿托伐他汀预处理对急性ST段抬高型心肌梗死患者PCI术后无复流现象的影响,结果发现大剂量阿托伐他汀组NOS水平显著高于常规剂量组,提示阿托伐他汀通过上调NOS提高血清中NO含量,进而改善血管内皮功能。BELL等[23]研究发现,在缺血-再灌注大鼠实验模型中,阿托伐他汀可显著激活心肌PI3K/AKT通路,从而保护缺血-再灌注心肌,而这种保护作用未在内皮型一氧化氮合酶(eNOS)敲除的大鼠中发现,且能够被PI3K抑制剂拮抗。WANG等[24]研究表明,阿托伐他汀联合治疗方案对超声波引起的缺血/缺氧诱导的人脐静脉内皮细胞损伤具有一定的保护作用,同时可增强脐静脉血管内皮细胞的增殖及迁移,上调血管内皮生长因子表达,提高丝氨酸激酶(set-inethreonine kinase,AKT)、eNOS磷酸化水平,但这些变化均可被磷酯酰肌醇3激酶(phosphoinositide-3-kinase,PI3K)抑制剂或者eNOS抑制剂阻断。以上研究均提示阿托伐他汀可能通过PI3K/AKT/eNOS信号通路起到改善微循环功能作用。
4 抗凋亡
内质网应激在心肌缺血-再灌注损伤中起重要作用。阿托伐他汀可以减轻动物模型的心肌缺血-再灌注损伤,这种保护作用可能与内质网应激有关。WU等[25]研究发现,阿托伐他汀预处理能够显著降低大鼠心肌缺血-再灌注损伤模型中心肌梗死面积和心肌细胞凋亡,降低血浆肌酸激酶同工酶及乳酸脱氢酶水平,同时调节葡萄糖调节蛋白78、CHOP、caspase-12的mRNA水平和蛋白表达,以及JNK蛋白磷酸化水平,提示阿托伐他汀在心肌缺血-再灌注损伤中的心脏保护作用可能是通过阻断内质网应激的心肌细胞凋亡而起作用。
5 结束语
PCI术后的无复流现象使心肌组织血液再灌注出现异常,难以保护受损心肌,可导致心律失常、心源性休克等,同时可能增加再发心肌梗死及住院死亡率。研究发现,无复流现象与炎症细胞聚集、微血管内皮细胞功能损伤、动脉硬化斑块碎片抑制微循环现象、缺血-再灌注受损等存在密切联系[26]。阿托伐他汀用于冠心病预防,除降低血脂等主要作用外,短期或长期应用还具有多重其他临床治疗作用,可为PCI术后患者带来长期获益。应用单剂量阿托伐他汀预防治疗,对缺血心肌组织血液水平再灌注的影响及其作用机制尚不明确,妨碍了阿托伐他汀药物在临床治疗的广泛应用。最初研究认为他汀类药物可能通过抑制羟基甲基戊二酰辅酶A还原酶,降低血清胆固醇水平从而发挥心脏保护作用,但目前更多临床及实验研究发现,他汀类药物的心脏保护作用不仅仅局限于心血管疾病的预防,其中急性保护作用有可能依赖于他汀类药物的多效性[27]。综上所述,阿托伐他汀可能通过降低血脂、抑制血小板聚集作用、抑制炎症反应、改善血管内皮功能、稳定斑块等多项效应协同而发挥抗心血管疾病作用。

