外源GA3、ABA处理对高寒地区甘肃贝母鳞茎休眠的促抑效应
师娥,李丽,师桂英,徐琼,刘世海,屈星,黄登婧
(1.北京农学院 园林学院,北京 昌平 102206;2.甘肃农业大学 园艺学院,甘肃 兰州 730070; 3.兰州市农业科技研究推广中心,甘肃 兰州 730000;4.兰州邦夫达农业科技有限公司,甘肃 榆中 730100)
川贝母是我国名贵中药材,甘肃贝母(Fritillariaprzewalskii)是其生药的主要来源之一。甘肃贝母主要分布于甘肃南部、青海南部及东部、陕西西部以及四川西部,海拔2 200~4 400 m高寒地带的灌木丛[1]。该贝母可以用鳞茎进行无性繁殖,也可以用种子进行有性繁殖。种子繁殖出芽率高,繁殖系数高,但是生长周期长,通常需要4~5年才能成为商品药材[2]。鳞茎繁殖可以有效缩短贝母生长年限,但鳞茎繁殖系数低,且要渡过休眠期才能正常生长。采用人工手段调控鳞茎休眠期,以提高其繁育效率的工作很有价值。另一方面,甘肃贝母植株高20~40 cm,花朵浅黄色,有黑紫色斑点,呈倒钟型,具有较高的观赏价值。近年来,贝母作为观赏植物的研究逐渐增多。因此,采用人工手段通过调控甘肃贝母鳞茎休眠可以实现花期调控,为其观赏功能开发提供技术依据。
逆境胁迫及常见外源类激素能够有效解除休眠[3-4]。在生产中,为了简化使用条件和处理步骤,常用温度、外源激素处理作为打破休眠的基本方法[5-6]。其休眠调控过程中碳水化合物[7-8]、蛋白质含量及氨基酸[9]、抗氧化酶类[10-12],酚类合成相关酶类[13-14]以及植物激素[15-16]的代谢规律及变化机理已有大量研究报道。在诸多可用于解除休眠的外源类激素中,赤霉素与脱落酸应用较为广泛,前者处理可提前解除植株休眠,促进芽的萌发,后者可以延长植物休眠期,抑制芽的萌发[5]。本课题组在兰州百合栽培生理研究中也证实,使用一定浓度的赤霉素处理兰州百合二级种球对解除休眠有很好的效果,可促进种球发芽,而使用脱落酸处理兰州百合三级种球时对延长种球休眠时间有显著作用[17]。目前,利用低温打破伊贝母休眠的作用效果及机理研究已有报道[9,18-19]。但是,利用低温处理结合赤霉素及脱落酸来调控贝母休眠时间的研究较少。
通过研究在低温贮藏条件下赤霉素和脱落酸对甘肃贝母休眠时间的调控作用,以确定低温结合赤霉素及脱落酸是否可以有效调控甘肃贝母鳞茎的休眠。如果可以,在该调控条件下,是否能确定鳞茎的休眠解除的时长。其间贝母鳞茎内营养物质及抗氧化酶和酚类合成相关酶类发生的变化,以期为贝母鳞茎休眠机理和贝母种球解除休眠处理方法提供依据。
1 材料和方法
1.1 试验材料
选用兰州市榆中县哈班岔村生长3~4年的新鲜甘肃贝母鳞茎。供试鳞茎于2016年9月16日采集,此时贝母鳞茎地上植株枯萎,除去鳞茎枯萎的茎轴,将鳞茎清洗干净,在低温条件下贮藏。
1.2 试验设计
选择周径为9~12 cm的甘肃贝母新鲜鳞茎为试验材料。将鳞茎冲洗干净,用多菌灵进行消毒。试验设计分为2部分,处理1:GA3100 mg/L处理甘肃贝母鳞茎。处理2:ABA 100 μmol/L处理甘肃贝母鳞茎。以清水处理作为对照(CK)。实验步骤是:将消毒好的甘肃贝母鳞茎分别在GA3和ABA激素中浸泡30 min,取出晾干,之后放入包装箱。事先在包装箱底部铺一层塑料,然后放入灭过菌的蛭石,再将贝母鳞茎置于蛭石上,鳞茎分层放置,包扎塑料口,在上面扎小口透气,放于4℃的人工气候箱贮藏,温度变幅为±0.5℃。
于2016年9月16日开始,分别将新鲜鳞茎冷藏,每隔10 d取样。每次每个处理随机取5个鳞茎,削去表面氧化部分,剥下鳞片,将内层鳞片、中层鳞片、外层鳞片以及顶芽混合后随机取样,重复3次,测定鳞茎中淀粉、可溶性糖、可溶性蛋白等含量及POD、CAT、PAL和PPO等抗氧化性酶与酚类物质合成相关酶活性。每次测定样品均在超低温冰箱保存。
1.3 测定方法
用游标卡尺测量芽长及鳞茎高度,计算出芽距(顶芽到鳞茎顶端的距离)、鳞茎比,用以判断甘肃贝母鳞茎解除休眠的时间。
鳞茎碳水化合物及可溶性蛋白质的测定方法参考黄彦伟所用方法进行[17]:可溶性糖含量的测定采用蒽酮比色法,淀粉含量的测定采用碘比色法,可溶性蛋白含量的测定采用考马斯亮蓝染色法。
过氧化物酶(POD),过氧化氢酶(CAT)活性测定参考Arnon方法[20];多酚氧化酶(PPO)活性采用儿茶酚法测定[21];丙氨酸解氨酶(PAL)活性的测定采用紫外吸收法[22]。
1.4 数据处理
采用Microsoft Excel 2010软件进行原始数据处理及图表绘制,SPSS 17.0进行统计分析,用Duncan法进行差异显著性检测。
2 结果与分析
2.1 外源CA3、ABA处理对冷藏期间甘肃贝母鳞茎解除休眠时间的确定
3个处理鳞茎内顶芽均不断的进行伸长生长。清水处理在20~40 d芽快速生长,增速为67.8%,在40 d后芽长增速缓慢。外源GA3处理在10~20 d时芽快速生长,芽的增长幅度为87%,30 d后芽长平缓增加。ABA处理在30~40 d芽长迅速增长,增速为46%,50 d后芽长增长缓慢,60~70 d芽长增速为8.9%(表1)。
清水处理,芽距(顶芽距离鳞茎顶端的距离)在40 d时为8.74 mm,芽长与鳞茎高的比值达到0.66,外源GA3在低温处理30 d时芽高与鳞茎高的比值达到0.7,将鳞茎一直置于4℃条件下储藏,70 d时芽高与鳞茎高的比值达到0.9。ABA处理50 d时芽距为8.45 mm,芽高与鳞茎高的比值达到0.66(图1,表1)。
试验研究表明,清水处理30~40 d是顶芽生长形态变化的关键时期,20~30 d是GA3处理的关键时期,40~50 d是ABA处理的关键时期。有研究表明,顶芽位于鳞茎2/3处或鳞茎高度于芽长相差±1 cm,可以看作百合种球打破休眠的形态依据[23]。与本试验的芽生长指标进行比较分析,发现甘肃贝母鳞茎的休眠解除时间与芽长与鳞茎高的比值、芽距的时间基本一致。因此,在甘肃贝母鳞茎解除休眠中,可以将芽长与鳞茎高的比值达到0.66作为判断甘肃贝母鳞茎休眠的形态依据。

图1 外源GA3和ABA处理下鳞茎低温贮藏过程中的芽长Fig.1 Bud length of bulbs treated with Exogenous GA3 and ABA during low temperature storage
甘肃贝母鳞茎在解除休眠期间,内部形态变化明显,顶芽不断生长,外部形态并没有发生明显的变化,但GA3处理的鳞茎与CK相比能提早解除休眠;而ABA处理则能延迟鳞茎解除休眠时间。
2.2 外源GA3、ABA对甘肃贝母鳞茎冷藏期间碳水化合物的影响
2.2.1 外源GA3、ABA对甘肃贝母鳞茎冷藏期间可溶性糖含量的影响 甘肃贝母鳞茎在低温条件下,外源GA3、ABA处理可溶性糖含量先缓慢上升,然后迅速升高,之后又下降,但整体保持在较高水平(图2)。清水处理在30~40 d时迅速升高,40 d时达到峰值,可溶性糖含量为12.33%。外源GA3处理,在30 d达到峰值,可溶性糖含量为13.44%,比20 d时增加了3.6%,在40 d时略有下降。外源ABA处理整体增长趋势平缓,在50 d时可溶性糖含量达到最大值,为12.13%,60 d时下降1.16%。

表1 低温贮藏过程中甘肃贝母鳞茎内顶芽的萌动

图2 外源GA3和ABA处理下甘肃贝母鳞茎低温贮藏可溶性糖的含量Fig.2 Soluble sugar content in bulbs treated with exogenous GA3 and ABA during low temperature storage
各处理可溶性糖含量达到峰值的时间与鳞茎芽开始萌发时间基本一致。糖含量在峰值出现后又出现缓慢下降的趋势。
2.2.2 外源GA3、ABA对甘肃贝母鳞茎冷藏期间淀粉含量的影响 低温GA3、ABA处理以及清水处理,淀粉含量都呈下降趋势,不同处理对淀粉含量的影响有所不同。GA3处理的鳞茎中淀粉含量在10~40 d时迅速下降,40 d后下降速度又趋于平缓,淀粉含量为3.7%,为同时期淀粉含量最低值。在70 d时达到最低值2.59%。ABA处理的鳞茎中淀粉含量变化趋势较大,在60 d时出现最低值3.17%。CK在50 d后变化平缓(图3)。
2.3 外源GA3、ABA对甘肃贝母鳞茎冷藏期间可溶性蛋白质含量的影响
随着低温处理时间的延长,各处理中可溶性蛋白质的含量呈“升高-降低-升高”的趋势。GA3处理促进了甘肃贝母鳞茎中可溶性蛋白含量的积累,其含量总体高于CK,在处理30 d时可溶性蛋白质含量达到最大值,为2.86 mg/g。CK在处理40 d时可溶性蛋白质含量达到最大。ABA处理前期可溶性蛋白增长缓慢,在50 d时蛋白质含量达到最大值,与CK相比,延迟了甘肃贝母鳞茎可溶性蛋白达到最大值的时间。3种处理中可溶性蛋白含量达到峰值的时间与鳞茎芽萌发的时间基本一致(图4)。

图3 外源GA3和ABA处理下甘肃贝母鳞茎低温贮藏淀粉的含量Fig.3 Starch content in bulbs treated with exogenous GA3 and ABA during low temperature storage
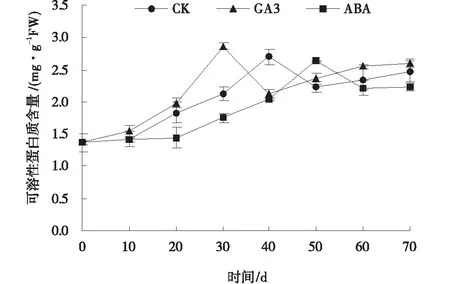
图4 外源GA3和ABA处理下甘肃贝母鳞茎低温贮藏可溶性蛋白的含量Fig.4 Soluble protein content in bulbs treated with exogenous GA3 and ABA during low temperature storage
2.4 外源GA3、ABA对甘肃贝母鳞茎冷藏期间抗氧化性酶与酚类物质合成相关酶活性的影响
2.4.1 外源GA3、ABA对甘肃贝母鳞茎冷藏期间过氧化物酶活性的影响 POD能清除植物体内活性氧和其他过氧物自由基对细胞膜的伤害[23-24],普遍认为POD还参与生长素IAA的降解[25]。随着低温处理时间的延长,各处理中POD酶活性均呈下降趋势,之后略有升高,但都低于低温处理初期的酶活性。CK在处理40 d时POD酶活性一直降低,到40 d时达到最低值4.58 U/(g FW·min),在40~60 d酶活性升高,之后酶活性趋于平缓。GA3处理在20~30 d迅速降低,在30 d达到最低值,为4.1 U/(g FW·min),与CK和ABA处理有显著差异(P〈0.05),在处理30~50 d有上升趋势,在50 d后酶活性变化趋于平缓。ABA处理在低温储藏50 d之前酶活性缓慢降低,在50 d时达最低值,之后开始升高。3种处理POD酶活性在低温处理结束时酶活性没有显著差异(图5)。

图5 外源GA3和ABA处理下甘肃贝母鳞茎低温POD活性Fig.5 POD activity in bulbs treated with exogenous GA3 and ABA during low temperature storage
2.4.2 外源GA3、ABA对甘肃贝母鳞茎冷藏期间过氧化氢酶活性的影响 CAT是清除H2O2的主要酶类,在植物体活性氧代谢过程中发挥重要作用。低温处理期间,各处理中CAT酶活性均呈先下降后上升的趋势。CK处理在10 d时迅速降低,然后缓慢降低,20~40 d时下降幅度较大,并在40 d时达到最低值,为3.55 U/(g FW·min),之后表现为逐渐升高的趋势。GA3处理时CAT酶活性在前30 d都呈迅速下降趋势,在30 d达最低值,为3.23 U/(g FW·min),30~50 d增幅较大,之后又有所降低。ABA在低温处理10~40 d时下降幅度与CK相似,CAT酶活性比CK处理活性高。ABA在低温处理50 d时为最低值3.75 U/(g FW·min),之后呈平缓升高趋势。3种处理中CAT酶活性的最低值差异不显著(图6)。
2.4.3 外源GA3、ABA对甘肃贝母鳞茎冷藏期间多酚氧化酶活性的影响 鳞茎内PPO酶活性在低温处理期间呈上升趋势。CK处理在20~40 d变化幅度较大,在40 d达到2.68 U/(g FW·min),之后变化幅度较小,增长趋势平缓。GA3处理在10~30 d增长幅度较大,从2.11 U/(g FW·min增至2.79 U/(g FW·min),之后从30 d一直到处理结束酶活性增长了0.58 U/(g FW·min)。ABA处理在处理前40 d缓慢增长,40~50 d增幅较大,之后也是平稳增长。3种处理在整个冷藏期间GA3处理PPO酶活性整体高于CK和ABA处理,GA3处理出现酶活性快速增长期较其余处理需要的时间短(图7)。

图6 外源GA3和ABA处理下甘肃贝母鳞茎低温贮藏CAT活性Fig.6 CAT activity in bulbs treated with exogenous GA3 and ABA during low temperature storage

图7 外源GA3和ABA处理下甘肃贝母鳞茎低温贮藏PPO活性Fig.7 PPO activity in bulbs treated with exogenous GA3 and ABA during low temperature storage
2.4.4 外源GA3、ABA对甘肃贝母鳞茎冷藏期间苯丙氨酸解氨酶活性的影响 酚类物质含量在植物体打破休眠期间会发生相关变化。苯丙氨酸解氨酶在形成酚类物质过程中有非常重要的作用,是限速酶和关键酶。在低温处理初期PAL酶活性有所升高,但总体来说呈下降趋势。CK处理从10 d开始呈下降趋势,在30~40 d迅速下降,从3.86 U/(g FW·min)降至2.16 U/(g FW·min),之后变化趋于平缓。GA3处理在10~30 d时快速下降,从4.64 U/(g FW·min)降至2.03 U/(g FW·min),从30 d之后酶活性缓慢降低。ABA处理在10~50 d时也呈下降趋势,但变化幅度较CK和GA3处理平缓,在40~50 d有个快速降低时期,之后缓慢下降至冷藏结束。在70 d时3种处理PAL酶活性差异不显著(图8)。

图8 外源GA3和ABA处理下甘肃贝母鳞茎低温贮藏PAL活性Fig.8 PAL activity in bulbs treated with exogenous GA3 and ABA during low temperature storage
3 讨论
3.1 甘肃贝母鳞茎内顶芽萌发的形态指标与解除休眠的关系
休眠是指植物本身或者植物的某一个器官在生长发育过程中出现的暂时停止生长或代谢的现象[26],因此,确定鳞茎打破休眠的形态指标是其休眠生理研究的基础[9,24,27]。Rees[28]指出,分生组织停止生长可以作为植物进入真正休眠期的判断标准。Mollet[29]研究发现,鳞茎的休眠除了顶芽、分生组织外,还包括整个鳞茎。本研究结果表明,外源GA3处理在4℃条件下贮藏的甘肃贝母鳞茎,贮藏30 d时芽长与鳞茎高的比值达到0.7,此时鳞茎已经解除休眠,与对照组相比提前解除甘肃贝母的休眠,由40 d提前至30 d。外源ABA处理在4℃条件下贮藏甘肃贝母鳞茎,在50 d时芽长与鳞茎高的比值达到0.66,ABA处理可以延迟甘肃贝母鳞茎的发芽时间,由40 d延长至50 d。因此,在甘肃贝母鳞茎解除休眠中,芽长与鳞茎高的比值达到0.66可以作为判断贝母鳞茎休眠的形态依据。该结论与胡素琴等[9]在浙贝母及李同根[27]在皖贝母上解除鳞茎休眠的时间基本一致。
3.2 甘肃贝母鳞茎碳水化合物变化与解除休眠的关系
低温显著影响植物的渗透调节物质,可溶性糖作为渗透调节物质的一种,在植物的休眠期含量高可以为植物的萌发提供充足的能量,也可增强植物对低温的耐性[9]。大量研究发现,在低温条件下,大多数块茎类植物鳞茎会出现 “低温糖化”现象:即在低温打破鳞茎休眠的过程中,鳞茎内淀粉降解酶活性、可溶性糖含量显著提高[7-8],与本课题组在兰州百合,观赏百合休眠生理研究碳水化合物代谢规律一致[17]。“低温糖化”现象在浙贝母、康定贝母低温解除休眠过程也得到了类似研究结果[9,18-19],本研究结果与上述观点相近,甘肃贝母鳞茎,在低温条件下进行贮藏,可溶性糖和可溶性蛋白含量外源GA3处理贝母鳞茎在低温贮藏30 d时可溶性糖含量达到峰值,CK在低温贮藏40 d时可溶性糖含量达到峰值,ABA处理的鳞茎在低温贮藏50 d时可溶性糖含量达到峰值。
可溶性蛋白含量在一定程度上能够很好的反映植物遭受逆境的伤害程度,属于渗透调节物质的一种,植物在休眠条件下,生理活动减弱,含有极少的可溶性蛋白,解除休眠后,可溶性蛋白明显增加。有研究表明,鳞茎内可溶性蛋白质含量及氨基酸含量与鳞茎打破休眠之间有紧密的联系[8],休眠鳞茎中可溶性蛋白含量较少,代谢活动也较缓慢,而当休眠解除时,植物代谢增强,鳞茎内蛋白质含量也会相应升高[9]。浙贝母是否打破休眠,可以通过测定鳞茎内蛋白质含量来衡量[19]。本试验研究结果表明,在低温贮藏条件下,随着贮藏时间的延长,甘肃贝母鳞茎内顶芽开始萌动、进行伸长生长,3种处理下可溶性蛋白质含量均呈上升趋势。可溶性蛋白含量的增加很可能是为贝母鳞茎内顶芽的萌发做准备,这与王凤兰等[30]研究的新铁炮百合的结果基本一致。GA3处理促进了贝母鳞茎可溶性蛋白含量的积累,其含量总体高于CK和ABA处理,且提前了贝母鳞茎可溶性蛋白达到峰值的时间。ABA处理在刚开始贮藏到40 d之前鳞茎内可溶性蛋白积累较缓慢,到40 d时迅速增加,在50 d时可溶性蛋白含量达峰值,延迟了贝母鳞茎内可溶性蛋白含量达到峰值的时间。因此,在解除休眠过程中,鳞茎内可溶性蛋白含量的变化,是贝母鳞茎解除休眠的另一个重要生理指标。
3.3 甘肃贝母鳞茎内抗氧化性酶及酚类合成酶与解除休眠的关系
本试验研究结果表明,在甘肃贝母鳞茎解除休眠期间,鳞茎内的抗氧化酶类也发生了很大的变化:其POD、CAT酶活性低温处理前期呈下降趋势,后期出现升高的趋势。这与Marija等[10]对离体培养中贝母小鳞茎低温解除休眠中CAT酶活性的变化趋势基本一致。本课题组之前对观赏百合的研究结果亦表明了百合鳞茎在类似的处理条件下,其鳞茎在打破休眠过程中,POD、CAT酶活性变化显示了相以的变化趋势[12]。植物细胞中活性氧清除酶系统是细胞内形成的防御植物体内活性氧、自由基毒害的主要保护机制,活性氧清除酶系统包括CAT、POD等保护酶。CAT能有效地清除H2O2,使植物维持正常的生长和发育。过氧化物酶(POD)除了清除植物体内活性氧和其他过氧物自由基之外,普遍认为POD还参与生长素IAA的降解。POD酶活性的降低可能促进了IAA含量的升高[31],促进植物休眠的解除。王鹏等[11]研究结果表明休眠解除时IAA含量增加, POD酶活性下降。高东升等[32]研究发现,提高H2O2含量可以有效解除休眠。因此,在甘肃贝母在打破休眠过程中,由于POD 、CAT酶活性的显著降低,使得IAA含量,H2O2含量升高,可能是其鳞茎休眠解除的机理所在。
酚类物质是植物的次生代谢物质之一,在植物中有着多方面的生理功能。PAL可以催化苯丙氨酸脱氨反应,这是酚类物质合成的第一步,也是酚类物质合成的关键酶。低温、机械损伤等都可以诱导PAL基因的表达。孙红梅等[14]对百合鳞茎解除休眠进行研究,结果表明,在低温处理中,PAL酶活性与酚类物质含量成极显著正相关,由此可见,酚类物质含量增加是主因。刘艳萍[33]对百合中层鳞片在低温解除休眠中的酚类物质代谢进行了研究,结果表明随着休眠的解除,PAL酶活性和总酚含量下降。本试验结果亦显示,PAL酶活性在低温处理其间整体呈下降趋势。在初期10 d有小幅度的上升趋势,可能是因为甘肃贝母由高温休眠状态突然置身于低温状态下,使得贝母鳞茎的生理生化代谢启动,尤以PAL酶活性增加较为明显,以便更好的适应低温条件,这与彭昕等[34]对浙贝母的研究结果基本一致。
酚类物质常与某些植物激素相互作用,也可能单独发生作用,影响某些酶的活性[35]。酚类物质在氧化过程中需要多酚氧化酶(PPO)的参与。彭昕等[34]对浙贝母打破休眠酚类物质进行研究,发现在低温贮藏过程中,酚类物质含量呈降低趋势,鳞片中PPO酶活性呈上升趋势,酚类物质含量与其呈显著负相关。在本试验中,3种处理PPO酶活性随低温储藏时间的延长呈上升趋势,CK和ABA处理的增长趋势较GA3处理平缓。鳞茎在低温解除休眠后期,各处理鳞片中PPO酶活性变化基本稳定。这与彭昕[34]、刘芳等[36]对浙贝母和细叶百合的研究结果是一致的。本研究仅仅对甘肃贝母作了初步研究,对于酚类物质对解除休眠的效果的深层次机理有待进一步研究。
4 结论
在低温冷藏其间,GA3处理可以提前解除甘肃贝母鳞茎休眠,鳞茎破眠期由对照(CK)的40 d提前至30 d;ABA处理可以延迟甘肃贝母解除休眠的时间,鳞茎破眠期由CK的40 d延长至50 d。CK、GA3处理和ABA处理分别在40、30和50 d时解除休眠。休眠过程中鳞茎内可溶性糖含量和可溶性蛋白含量呈上升趋势;淀粉含量呈下降趋势。

