白菜DBB基因家族的鉴定与表达分析
陈雨,邓九州,吴晓宇,赵玉梅,王洁,段巧红,黄家保
白菜基因家族的鉴定与表达分析
陈雨,邓九州*,吴晓宇,赵玉梅,王洁,段巧红,黄家保**
山东农业大学园艺科学与工程学院/作物生物学国家重点实验室, 山东 泰安 271018
基因在开花调控、根系生长、光形态建成、种子萌发、果实发育、逆境胁迫等生物学过程中发挥重要作用,但在白菜中还未有关于基因的报道。本研究通过生物信息学方法鉴定到18个白菜基因,其蛋白分子量为11285.63~35796.93D,理论等电点介于4.66~9.35之间,外显子数量为2~5个;大多数成员N端都含有保守结构域B-box1和B-box2,精氨酸和亮氨酸是在所有成员中都保守的氨基酸残基;该家族基因不均匀分布于白菜10条染色体上,多数基因出现基因复制,产生2个以上同源基因;多数基因与拟南芥基因具有线性对应关系。顺式作用元件分析表明白菜基因启动子上含有大量的光、厌氧、激素、低温等响应元件。组织特异性表达分析发现多数基因在不同组织中的表达水平与根类似;在花中的表达水平显著高于其它成员。此外,绝大多数白菜基因对盐胁迫有不同程度的响应。这些结果为后续解析基因在白菜中的生物学功能奠定了基础。
白菜; DBB; 生物信息学分析
锌指蛋白是真核生物中的一类具有锌指结构域的转录因子家族[1],其中含有B-box基序的蛋白称为BBX,在拟南芥中有32个成员,其C端通常含有CCT结构域[2]。含有CCT结构域的蛋白通常与光周期有关,在植物中与成花相关基因一起调控开花时间[3]。但BBX中有一类缺乏CCT结构域的蛋白,称为DBB(double B-BOX),其突出特点是N端具有两个或以上的B-Box结构域且C端缺乏CCT结构域[4]。
植物DBB家族在逆境胁迫(盐胁迫、温度胁迫、干旱胁迫等)、开花调控、光形态建成、根系生长、种子萌发,果实发育等过程中发挥重要作用。(SALT TOLERANCE)最初是酵母中发现的耐盐基因[5],后来在拟南芥中发现它能挽救盐敏感突变体的表型[6]。拟南芥基因的下调表达植株对高温性的耐受性提高,而过表达株系对高温敏感[7]。桃与拟南芥同源,研究显示桃在0℃条件下储存28 d后的保鲜效果比4 ℃条件下明显要好,基因表达分析结果显示在0 ℃条件下被显著诱导上调表达,推测其很可能与桃的低温适应相关[8]。菊花与拟南芥为同源基因,其过表达能够增强菊花在低温和干旱条件下的适应能力[9]。之前的研究还发现STO在开花调控中的重要作用,STO可以降低FLC的表达激活开花时间决定基因和的表达,从而促进开花[10]。DBB在光形态建成中发挥重要作用,DBB2、STH2、DBB3、DBB4促进光形态的建成,而DBB1a、DBB1b、STO、STH是光形态建成的负调控因子[11]。另外STO和GA互作在UV-B诱导的拟南芥根系生长抑制中具有负调控作用[12]。Bai等发现(AtBBX19)过表达植株表现为ABA超敏,通过与启动子中的基序结合诱导其表达,从而调控种子萌发[13]。果实发育调控方面,苹果中MdBBX20受紫外线诱导表达,过表达后显著促进苹果花青素的合成,在低温环境下与MdbHLH3互作共同调控花青素的积累,从而影响苹果的着色[14];番茄SlBBX20可以激活类胡萝卜素合成的关键酶来促进番茄中类胡萝卜素的合成[15]。
随着基因测序成本的降低,大量的物种完成基因组测序,育种工作进入分子时代。白菜已于2011年完成了基因组测序工作[16]。但是到目前为止尚未有关于白菜基因家族成员及其基本生物信息学分析的研究报道。本研究对白菜的基因家族进行系统的生物信息学鉴定并研究其在不同组织中的表达情况和盐胁迫下的表达情况,为后续深入研究白菜基因家族功能提供基础。
1 材料与方法
1.1 白菜DBB家族基因成员鉴定及理化性质分析
根据拟南芥已经鉴定的8个DBB序列,通过BLAST在白菜基因组(genome v1.5)中搜索候选的白菜DBB家族成员,最后通过保守结构域分析等综合方法进一步确定候选基因。使用TBtools软件[17]结合Expasy(https://www.expasy.org/)[18]分析白菜DBB基因家族的蛋白质分子量(MW)、等电点(pI)等理化性质。
1.2 基因结构和保守结构域分析
利用TBtools绘制白菜基因的结构图;利用MEME (http://meme-suite.org/)[19]预测白菜DBB蛋白保守基序;使用软件DNAMAN中的Multiple Sequence Alignment功能对白菜DBB序列进行比对,分析其保守氨基酸位点。
1.3 染色体定位和共线性分析及进化树构建
从白菜数据库下载gff3文件,用TBtools绘制基因在染色体上的分布图。通过McscanX[20]绘制白菜与拟南芥基因家族共线性分析图。利用MEGAX[21]对白菜DBB家族氨基酸序列与拟南芥DBB家族氨基酸序列进行多序列比对,采用最大似然法(Maximum Likelihood Estimate,MLE)构建拟南芥和白菜的基因家族系统进化树。
1.4 顺式作用元件分析
从Ensembl Plants(http://plants.ensembl.org/index.html)[22]中查找并下载白菜家族基因起始密码子上游2000 bp序列,使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站[23]对获取的序列进行分析。
1.5 白菜DBB基因表达分析
本试验采用“蛋黄白”白菜品种为材料。对于组织特异性表达分析,收集30 d苗龄的根、茎、叶和80 d苗龄的花和果荚用于RNA提取。对于盐胁迫下基因表达分析,挑选生长状况相近的白菜幼苗浸泡于用Hoagland营养液配制的150 mM·L-1NaCl溶液中,12 h后收集材料用于RNA提取,以正常水培幼苗为对照。
使用qPrimerDB-qPCR Primer Database(https://biodb.swu.edu.cn/qprimerdb/)[24]查找设计引物,内参基因为(表1),由青岛擎科梓熙生物技术公司合成。采用RNA提取试剂盒(百泰克)提取白菜样品的总RNA,参照HiScript ll QRT SuperMix for qPCR(诺维赞)试剂盒产品说明进行反转录得到cDNA,用ChamQ Universal SYBR qPCR Master Mix(诺维赞)试剂盒进行定量PCR实验。反应体系20 μL:2 μL cDNA,上、下游引物各0.4 μL,SYBR 10 μL,用灭菌ddH2O补至20 μL。PCR反应程序:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火22 s,进行40个循环。基因的相对表达量以2—ΔΔCt法计算。数据利用Excel软件进行整理并通过TBtools绘制热图。

表 1 荧光定量引物
2 结果与分析
2.1 白菜DBB基因家族成员鉴定及理化性质分析
通过生物信息学的方法,我们一共鉴定到18个白菜DBB家族成员(表2)。白菜DBB家族成员数量远多于拟南芥。白菜DBB蛋白分子量介于11285.63~ 35796.93D,理论等电点介于4.66 ~ 9.35之间。除Bra020746和Bra008204之外,其余16个DBB蛋白家族成员的等电点都小于7.0(表2),说明DBB家族蛋白成员大多富含酸性氨基酸,这与玉米[25]和番茄[26]的DBB家族蛋白相似。
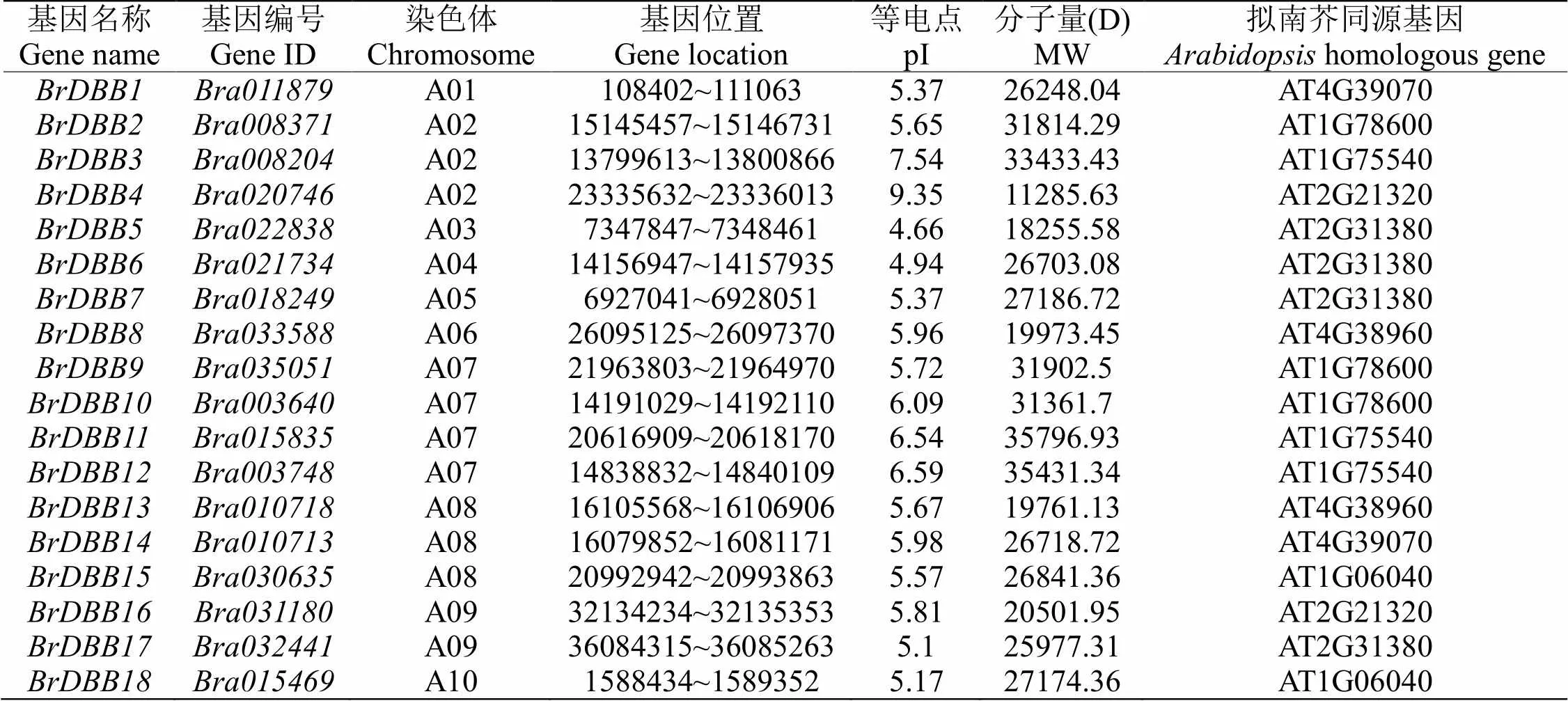
表 2 白菜DBB基因家族信息
2.2 白菜DBB家族基因结构和蛋白结构域分析
利用TBtools绘制了白菜18个基因结构图。如图1所示,白菜基因家族中外显子数目差异不大,从2个()到5个()不等,多数家族成员都含有3个外显子。
使用NCBI的CDD工具结合TBtools软件进行蛋白结构域分析,获得DBB家族的10个保守基序(图2)。图中motif1和 motif2分别表示B-box1和B-box2结构域,除Bra020746蛋白和Bra022838蛋白外的白菜DBB蛋白都含有这两个保守基序。此外,白菜DBB蛋白motif在序列中分布较为均匀,说明该家族成员基序之间离散程度差异较小。使用DNAMAN对白菜DBB氨基酸序列进行比对,发现白菜DBB中含有高度保守的精氨酸和亮氨酸位点(图3)。

图 1 白菜DBB基因结构分析

图 2 白菜DBB家族结构域分析
2.3 白菜DBB基因染色体定位及与拟南芥基因的共线性分析
基因在染色体上定位图(图4)显示在白菜的10条染色体上都有基因分布。A07染色体分布的家族成员最多,有4个基因。A02和A08各有三个基因,其余只有1~2个。在白菜基因家族中鉴定出13个存在基因复制的基因。

图 3 白菜DBB家族氨基酸序列比对
图4 白菜的DBB基因在染色体上的分布
Fig.4 Distribution of DBB genes on chromosome ofin Brassica rapa
使用TBtools对白菜与拟南芥的DBB家族成员进行共线性分析(图5),结果显示除了和,其它都在拟南芥家族中找到了对应的直系同源基因,表明白菜与拟南芥DBB家族具有良好的共线性关系。
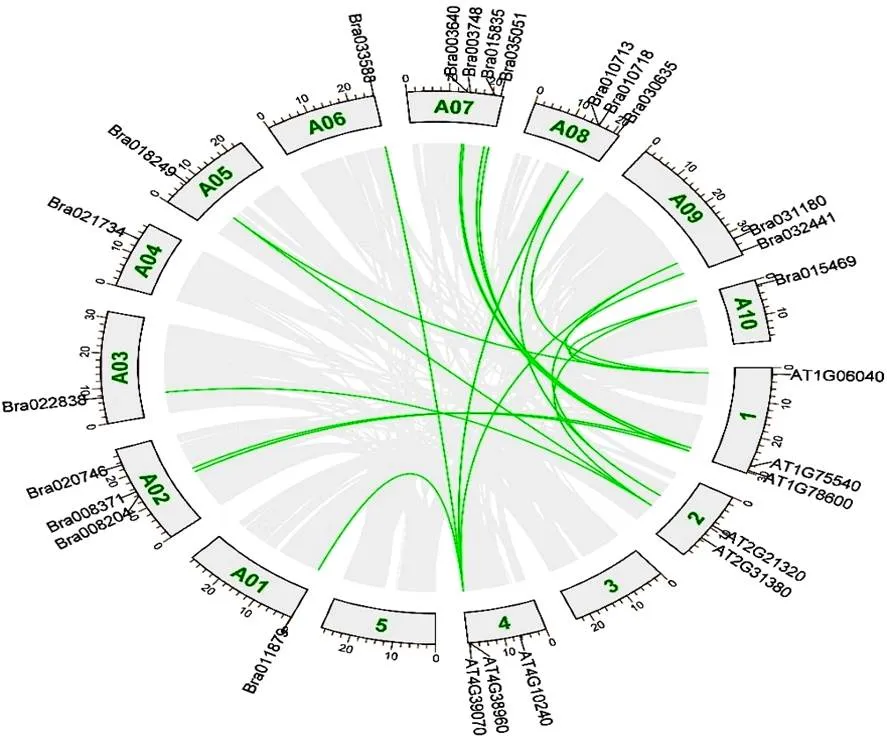
图 5 白菜与拟南芥间DBB家族共线性分析
2.4 白菜DBB的系统进化分析
用软件MEGAX对26个DBB蛋白序列(拟南芥8个,白菜18个)进行多序列比对,构建DBB家族基因的系统进化树(图6)。进化树中两个物种的DBB家族成员在进化树中交叉聚集,表明白菜DBB家族成员大多与拟南芥DBB家族成员进化关系较近。
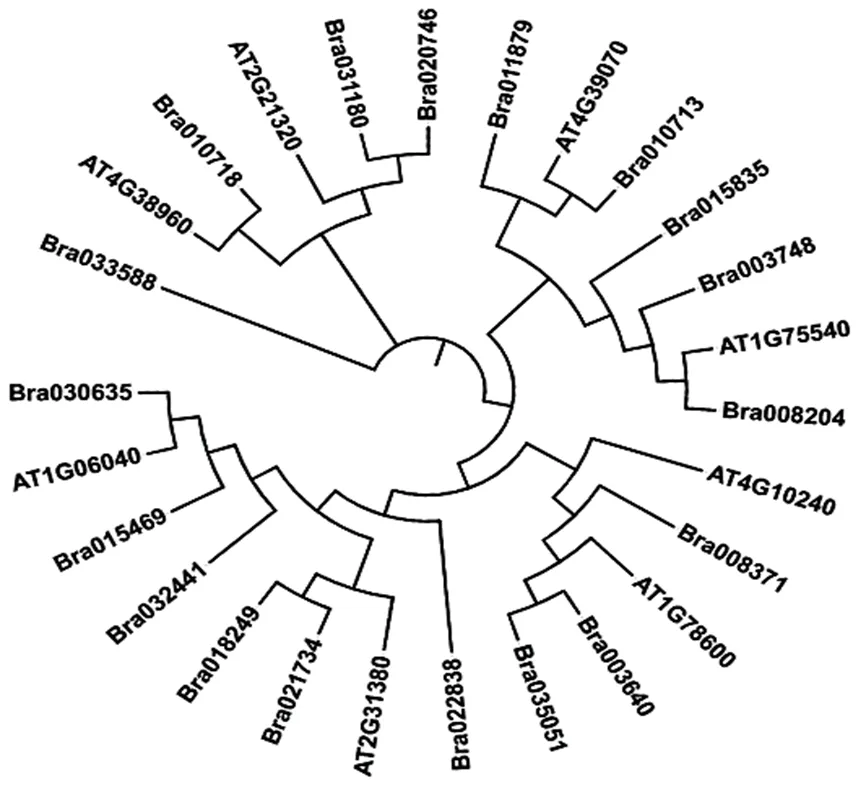
图 6 白菜、拟南芥DBB家族系统进化树
Bra:白菜AT:拟南芥
2.5 白菜DBB基因的启动子顺式作用元件分析
基因表达的时空特性是由各种转录因子对基因启动子活性的调控决定的。为了探究基因可能的调控模式,我们利用PlantCARE对基因上游2 kb启动子序列进行分析,结果显示,在白菜基因家族含有的启动子元件中光响应元件数量最多,经计算平均每个基因含8.44个光响应元件,远远超过其他响应元件的数量,其中中含有的光响应元件数量为17个。18个基因均含有厌氧响应元件和一定数量的激素响应元件,其中14个含有脱落酸响应元件,13个含有茉莉酸响应元件,11个含有赤霉素响应元件,10个含有生长素响应元件,10个含有水杨酸响应元件。此外,低温、干旱等逆境胁迫响应元件的数量也较为丰富;家族基因启动子序列上还发现有参与分生组织表达、胚乳表达、生物钟及细胞周期调控相关的响应元件(图7),暗示此家族基因功能的多样性。

图 7 白菜DBB基因启动子顺式作用元件分析
2.8 DBB基因在不同组织和盐胁迫下的表达分析
为了了解不同在不同组织中的表达情况,我们通过荧光定量PCR分析了在白菜根、茎、叶、花和果荚中的表达水平。结果显示大多数基因在茎、叶、花和果荚中的表达水平与根中类似;在茎中相对表达量较高的有;叶中相对表达量较为突出的为,其中在叶中的相对表达量最高;与在果荚中的相对表达量较高。特别值得注意的是的表达模式最为特殊,该基因在茎、叶、花和果荚中的表达水平均高于在根中的表达,且在花中的表达水平为根中的三十倍左右(图8)。

图 8 白菜不同组织中DBB基因的表达模式
为探究白菜家族基因在盐胁迫状态下的表达情况,我们通过荧光定量PCR分析了在正常与150 mM·L-1NaCl胁迫状态下的表达水平,结果表明白菜绝大多数基因会对盐胁迫有一定程度的响应,只有对盐胁迫的响应不明显;有5个基因的表达在盐胁迫状态下呈上调趋势,其中的表达量为正常情况下的两倍多;12个基因的表达在盐胁迫状态下的表达呈下调趋势,其中基因的表达下调最为显著(图9)。

图 9 在盐胁迫下白菜DBB基因家族表达分析
3 讨 论
白菜基因组已于2011年测序完成,但目前白菜分子生物学研究仍然较为薄弱。本研究通过生物信息学的方法鉴定到18个家族成员,并对其理化性质、基因结构特点和表达模式进行了分析,为深入研究基因在白菜中的功能打下了基础。
对拟南芥与白菜的DBB家族成员的共线性分析表明二者DBB家族的大部分成员间具有较强的共线性,推测它们有着类似的功能。在拟南芥中,耐盐基因的过表达能提高植株的耐盐性[6]。基因家族盐胁迫下的表达分析显示,白菜中的四个同源基因和均在盐胁迫条件下表达水平均受到显著影响,因而推测这些基因很可能在白菜盐胁迫中发挥重要作用。菊花可以调节植物开花时间[9],而我们的分析数据显示,在白菜中的直系同源基因含有大量的光响应元件,并在花中的表达水平显著高于其他组织,据此推测其可能在调控白菜开花中发挥重要作用,值得下一步深入研究。此外,的同源基因含有大量的低温响应元件,暗示该基因可能参与调节白菜低温胁迫过程。
4 结 论
白菜中共有18个基因,与拟南芥基因有良好的共线性关系,启动子分析、基因表达分析结果暗示白菜DBB很可能在白菜开花调控和抗盐过程中发挥重要作用。
[1] Laity JH, Lee BM, Wright PE. Zinc finger proteins: new insights into structural and functional diversity [J]. Curr Opin Struct Biol, 2001,11(1):39-46
[2] Khanna R, Kronmiller B, Maszle DR,. TheB-box zinc finger family [J]. Plant Cell, 2009,21(11):3416-3420
[3] 陈华夏,申国境,王磊,等.4个物种CCT结构域基因家族的序列进化分析[J].华中农业大学学报,2010,29(6):669-676
[4] Kumagai T, Ito S, Nakamichi N,. The common function of a novel subfamily of B-Box zinc finger proteins with reference to circadian-associated events in[J]. Biosci Biotechnol Biochem, 2008,72(6):1539-1549
[5] Lippuner V, Cyert MS, Gasser CS. Two classes of plant cDNA clones differentially complement yeast calcineurin mutants and increase salt tolerance of wild-type yeast [J]. J Biol Chem, 1996,271(22):12859-12866
[6] Nagaoka S, Takano T. Salt tolerance-related protein STO binds to a Myb transcription factor homologue and confers salt tolerance in[J]. J Exp Bot, 2003,54(391):2231-2237
[7] Wang Q, Tu X, Zhang J,. Heat stress-induced BBX18 negatively regulates the thermotolerance in[J]. Mol Biol Rep, 2013,40(3):2679-2688
[8] Fang K, Zhang A, Xi W. Genome-wide identification and expression analysis of the B-box gene family in peach fruit during postharvest cold storage and subsequent shelf life [J]. Postharvest Biol Tec, 2021,172:111387
[9] Imtiaz M, Yang Y, Liu R,. Identification and functional characterization of the BBX24 promoter and gene from chrysanthemum in[J]. Plant Mol Biol, 2015,89(1-2):1-19
[10] Li F, Sun J, Wang D,The B-box family gene STO (BBX24) inregulates flowering time in different pathways [J]. PLoS One, 2014,9(2):e87544
[11] Gangappa SN, Botto JF. The BBX family of plant transcription factors [J]. Trends Plant Sci, 2014,19(7):460-470
[12] Lyu G, Li D, Li S,. STO and GA negatively regulate UV-B-inducedroot growth inhibition [J]. Plant Signal Behav, 2019,14(12):1675471
[13] Bai M, Sun J, Liu J,. The B-box protein BBX19 suppresses seed germination via induction of ABI5 [J]. Plant J, 2019,99(6):1192-1202
[14] Fang H, Dong Y, Yue X,. The B-box zinc finger protein MdBBX20 integrates anthocyanin accumulation in response to ultraviolet radiation and low temperature [J]. Plant Cell Environ, 2019,42(7):2090-2104
[15] Xiong C, Luo D, Lin A,. A tomato B-box protein SlBBX20 modulates carotenoid biosynthesis by directly activating PHYTOENE SYNTHASE 1, and is targeted for 26S proteasome-mediated degradation [J]. New Phytol, 2019,221(1):279-294
[16] Wang X, Wang H, Wang J,. The genome of the mesopolyploid crop species[J]. Nat Genet, 2011,43(10):1035-1039.
[17] Chen C, Chen H, Zhang Y,TBtools: An Integrative Toolkit Developed for Interactive Analyses of Big Biological Data [J]. Mol Plant, 2020,13(8):1194-1202
[18] Appel RD, Bairoch A, Hochstrasser DF. A new generation of information retrieval tools for biologists: the example of the ExPASy WWW server [J]. Trends Biochem Sci, 1994,19(6):258-260
[19] Bailey TL, Boden M, Buske FA.,. MEME Suite: tools for motif discovery and searching [J].Nucleic Acids Research, 2009,37(S2):W202-W208
[20] Wang Y, Tang H, Debarry JD,. MCScanX: a toolkit for detection and evolutionary analysis of gene synteny and collinearity [J]. Nucleic Acids Res, 2012,40(7):e49
[21] Kumar S, Tamura K, Nei M. MEGA: Molecular Evolutionary Genetics Analysis software for microcomputers [J]. Comput Appl Biosci, 1994,10(2):189-191
[22] Bolser D, Staines DM, Pritchard E,. Ensembl Plants: Integrating Tools for Visualizing, Mining, and Analyzing Plant Genomics Data [J]. Methods Mol Biol, 2016,1374:115-140
[23] Lescot M, Déhais P, Thijs G,. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences [J]. Nucleic Acids Res, 2002,30(1):325-327
[24] Lu K, Li T, He J,. qPrimerDB: a thermodynamics-based gene-specific qPCR primer database for 147 organisms [J]. Nucleic Acids Res, 2018,46(D1):D1229-D1236
[25] Li W, Wang J, Sun Q,. Expression analysis of genes encoding double B-box zinc finger proteins in maize [J]. Funct Integr Genomics, 2017,17(6):653-666
[26] 储转南.番茄锌指蛋白家族基因分析与功能研究[D].武汉:华中农业大学,2016:6-37
Identification and Expression Analysis ofFamily Genes in
CHEN Yu, DENG Jiu-zhou*, WU Xiao-yu, ZHAO Yu-mei, WANG Jie,DUAN Qiao-hong, HUANG Jia-bao**
271018,
DBBs play an important role in plant flowering regulation, root growth, photomorphogenesis, seed germination, fruit development and abiotic stress response. However,gene family has not been identified in. In this study, 18genes were identified by bioinformatics method. The molecular weight was 11285.63 ~ 35796.93 D, the theoretical isoelectric point ranged from 4.66 to 9.35, and the number of exons ranged from 2 to 5; The N-terminus of most members contained the conserved domains B-box1 and B-box2, and the arginine and leucine were found as the most conserved amino acid in all DBBs. The DBBs were distributed unevenly on 10 chromosomes, and most of the genes were duplicated, producing more than 2 homologous genes. Most of the genes had linear correspondence withgenes. The cis-element analysis showed that thegene promoter contained a large number of light, anaerobic, hormonal and low temperature response elements. Tissue expression analysis showed that the expression level of most genes in different tissues was similar to that in the roots, interestingly, the level ofin flowers was remarkably higher than that in other members. In addition, most of theinrespond to salt stress. These results laid a foundation for further analysis of the biological functions ofgenes in.
;; bioinformatic analysis
S634.3
A
1000-2324(2021)02-0174-08
10.3969/j.issn.1000-2324.2021.02.003
2021-3-17
2021-04-01
山东农业大学高层次人才引进启动经费
陈雨(2000-),男,本科生,专业方向:园艺蔬菜学. E-mail:Chen_Y66@163.com
邓九州(2000-),男,本科生,专业方向:园艺蔬菜学. E-mail:DengJZ99@163.com
Author for correspondence. E-mail:jbhuang2018@outlook.com

