第33届江苏省化学竞赛选拔赛有机试题解析
汤义涵,徐嘉伟,王佳鑫,王钰如,薛冰,张致慧,*
1常州大学石油化工学院,江苏 常州 213164
2南京师范大学教师教育学院,南京 210023
3江苏省“大规模复杂系统数值模拟”重点实验室,南京 210023
“扬子石化杯”第33届中国化学奥林匹克竞赛(江苏赛区)夏令营暨选拔赛考试于2019年7月15日在南京师范大学圆满落幕。本年度的有机化学试题背景新颖,紧跟前沿,深入浅出地考查了有机化学中的诸多要点。试题巧妙地衔接了高中阶段学生对有机化学的粗浅认识,以及大学有机化学中基础但具有本质意义的知识,故对学习和从事化学竞赛教育的师生和本科有机化学教学工作者,都具有较高的教学意义和研究价值。
目前有关化学竞赛中有机化学试题的研究主要限于全国性考试[1–4],对各省选拔赛的关注和对试题内涵的挖掘较少,往往忽视了题目的闪光点。下面对本次考试中的三道有机化学试题作一些探讨。
1 试题分析
1.1 第1题
1.1.1 试题
某些四氢异喹啉类化合物(THIQs)在抗癌、抗疟、镇痛、抗血栓等方面具有良好活性,其合成方法之一如图1所示:(R1和R2均为烃基)

图1 THIQs的合成路线
回答下列问题:
1) 写出同时满足下列条件的A的一种同分异构体的结构简式:① 分子中有4种不同化学环境的氢;② 连在苯环碳上的氢原子只有1个;③ 分子内有氢键。
2) R1和 R2均为甲基,上述反应生成 THIQs过程中经过 2个中间产物 B (C11H17NO3)和 C(C11H15NO2),写出B和C的结构简式。
3) 相同反应条件下,A与不同R1COR2反应,按产率从高到低列化合物(用字母标记) (图2)进行排序。
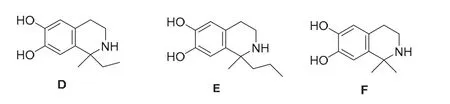
图2 化合物D、E和F的结构
4) 图3所示反应得到稠杂环化合物G,写出G的结构简式。
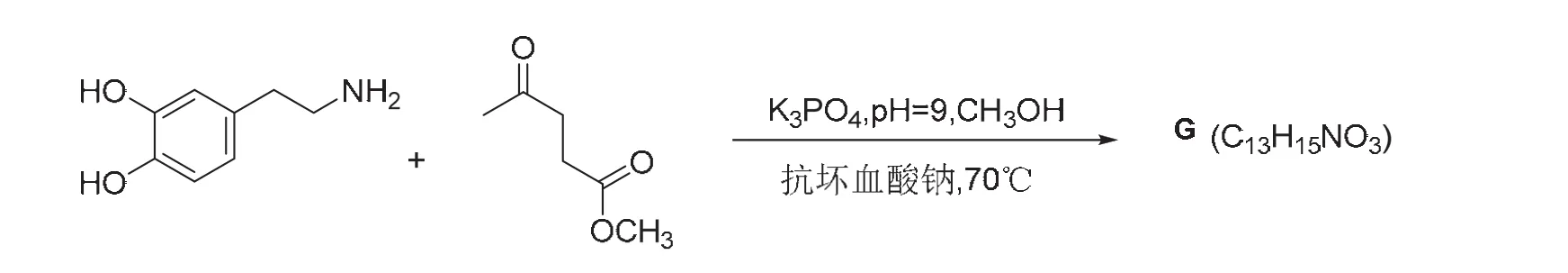
图3 稠杂环化合物G的合成路线
1.1.2 试题背景
本题涉及伦敦大学学院化学系的Zhao等[5]于2019年在The Journal of Organic Chemistry上报道的仿生磷酸盐催化的四氢异喹啉(THIQs)合成反应,着重考查了羰基化合物的性质和芳香亲电取代反应。
1.1.3 试题解析
第1小问,A的分子式为C8H11NO2,不饱和度为4。根据第②点要求,该同分异构体含有五取代苯环。再结合第①点和第③点要求,可画出A的同分异构体,见图4。
图4 A的同分异构体的结构
第 2小问,考查 4-(2-乙胺基)苯-1,2-二酚(多巴胺)与丙酮反应生成THIQs的机理。一级胺可以和羰基化合物进行亲核加成得到中间体B,随后离去OH−得到亚胺正离子中间体C,反应机理见图5。
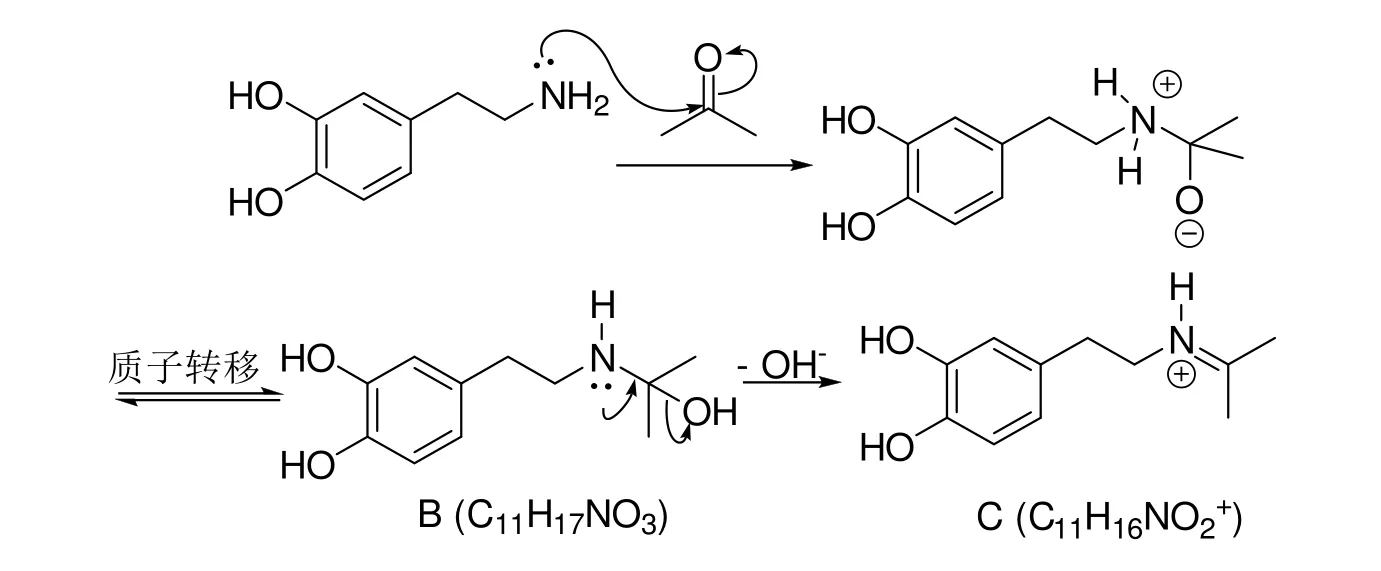
图5 生成亚胺正离子中间体C的机理
按照题意,C的分子式为C11H15NO2,即电中性的物质——亚胺。但是原题存在可商榷之处,因为亚胺的亲电性并不足以发生亲电取代反应,命题人可能认为在pH = 9的条件下不会生成这样的正离子,但在原文献中提到缓冲对帮助亚胺正离子的生成,故写成亚胺正离子的形式更加贴切。也许有部分教师和选手存疑,在这样的碱性条件下,书写反应机理时是否应当把酚羟基改为酚氧负离子呢?化合物A (记为H2A)的pKa1= 10.52,pKa2= 11.98 (水溶液)[6]。利用分布系数可计算出在 pH = 9 时,δ(H2A) = 0.9706,δ(HA−) = 0.02931,δ(A2−) = 3 × 10−5,可见酚羟基几乎都未电离。而且该反应是在甲醇中进行的,此时酚羟基电离程度更小,所以酚氧负离子含量更低,可忽略不计。
随后是苯环上的亲电取代反应,根据图1中THIQs的结构,可知亲电取代反应发生在苯环的5号位。由于带电中间体C含有多个取代基,虽然可以从题意推出正确答案,但该反应的区域选择性难以用取代基的定位效应解释,这在教学过程中可能带来一些困扰。笔者使用量子化学Gaussian 16软件[7],在基于密度的隐式溶剂模型(SMD)下,甲醇为隐式溶剂,以M06-2X/def2-TZVP级别对亚胺正离子中间体C进行结构优化。使用Multiwfn[8]软件和VMD[9]软件绘制其HOMO轨道和LUMO轨道图像(等值面均为0.10),见图6。

图6 亚胺正离子中间体C的HOMO轨道和LUMO轨道
根据HOMO轨道的图像,3号碳原子的轨道系数为0,而5号碳原子的轨道系数不为0。所以该反应选择性地发生在5号碳原子上。根据LUMO轨道的图像,在亚胺正离子部位有明显的π*轨道特征,且碳原子上的轨道系数更大一些,更容易受到苯环π电子的进攻。
该反应也是一个重要的人名反应——Pictet-Spengler四氢异喹啉合成法[10],可以与 Bischler-Napieralski喹啉合成法[10]结合起来记忆。
第3小问,生成D、E和F所用的酮依次为丁酮、2-戊酮和丙酮。当酮羰基两旁的基团体积较大时,亲核加成反应产率较低[11]。丁酮、2-戊酮和丙酮三者的空间位阻由小到大依次为:丙酮、丁酮和2-戊酮,反应活性也一致,故产率由高到底为F、D和E。
第4小问,参照前面几问的思路,首先想到的是氨基对羰基的亲核加成。乙酰丙酸甲酯中有两个羰基,酯羰基由于存在p–π共轭效应,活性不如酮羰基,所以氨基与酮羰基反应生成亚胺正离子,随后进行分子内亲电取代,得到中间体H (C14H19NO4),见图7。

图7 中间体H的结构
G的分子式为C13H15NO3,相比中间体H少了CH4O,也就是脱去了一个甲醇。联想到酯的胺解[11]可以脱除甲醇,最终得到产物G,经过验证分子式符合题意,反应机理见图8。
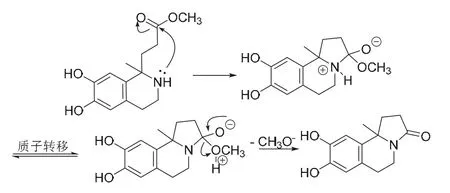
图8 生成稠杂环化合物G的机理
不过,该反应也可能以另一种方式进行。首先进行酯的胺解,得到热力学更稳定的酰胺。因为相比氨基和羰基的亲核加成而言,酯的胺解这一过程可逆性更差一些。虽然酰胺氮原子的亲核性较差,但是在较长反应时间下,可以与羰基亲核加成,最终达到平衡。随后进行芳环上的亲电取代反应,得到化合物G,该反应的主要历程见图9。

图9 生成稠杂环化合物G另一种机理的主要历程
1.2 第2题
1.2.1 试题
化合物F在免疫治疗心血管疾病方面有显著功效。其合成路线如图10所示:

图10 化合物F的合成路线
回答下列问题:
1) 写出B、C、D、E的结构简式。
2) 给出A的系统命名。
3) 对F手性拆分得图11所示立体异构体,给出手性碳1和2的构型。(以R或S表示)。

图11 立体异构体的结构
1.2.2 试题背景
Lemurell等人于2019年在Journal of Medicinal Chemistry上报道了几种5-脂氧合酶激活蛋白抑制剂的合成及其在治疗冠状动脉疾病的临床表现[12]。本题第 1小问便是其中一种抑制剂的合成路线,第3小问是该抑制剂的手性拆分产物。
1.2.3 试题解析
第1小问,容易看出是碱性条件下进行的羟醛缩合反应,该反应是制备β-羟基羰基化合物的重要方法。根据后续加入的1,3-丁二烯进行Diels-Alder反应可知,此处应当脱水得到不饱和羰基化合物。不过根据Lemurell等人的实验步骤,该反应是在130 °C下,用乙酸和甲磺酸进行催化,A与乙醛酸合成B,与题干所给出的条件不一致。笔者查阅资料发现,几乎所有涉及乙醛酸的 Aldol反应都是在酸性条件下的[13–15],因此本题将原来的酸性实验条件改为碱性是值得商榷的。化学竞赛试题是高中生提前接触科研、了解科研动态的一个重要途径,因此试题的准确性和合理性至关重要。命题人不应当随意修改实验事实,相反,即使多给出一些实验细节,例如反应温度、时间、溶剂等条件也是可以的。这有助于学生对有机合成有直观的认识,让他们明白,有机实验并不是像在高中课堂中见到的无机实验那样,将几种物质简单混合即可快速得到产物。
笔者还通过理论计算对比了该反应在酸性和碱性条件下进行的难易程度。在 SMD隐式乙酸溶剂模型下,以M06-2X/def2-TZVP级别对质子化的氧代乙酸进行结构优化;在SMD隐式水溶剂模型下,以同级别对氧代乙酸负离子进行结构优化。依据卢天等人提出的原子电荷计算方法对比[16],选用自然布居分析[17](NPA)和原子偶极矩校正的Hirshfeld布居[18](ADCH)方法,使用Multiwfn软件,对优化后的结构分别计算醛基碳原子的原子电荷,结果见表1。
表1的计算结果表明,氧代乙酸负离子中的醛基碳的原子电荷有较大降低,亲电性也随之降低,反应难以进行。

表1 醛基碳原子的原子电荷计算结果
酸性条件下的羟醛缩合反应分为两步,首先是酸催化下由酮式转变为烯醇式,然后烯醇对质子化的羰基进行亲核加成,得到质子化的β羟基酮,再经质子转移、消除水分子生成α,β-不饱和酮[11]。由于反式双键更稳定,产物B中的双键要画成反式。生成B的机理见图12。

图12 生成化合物B的机理
第二步是Diels-Alder反应,该反应是亲双烯体B与供双烯体1,3-丁二烯发生[π4s+π2s]环加成反应。具有高度立体专一性,得到一对外消旋体。从题干以及产物F来看并未对此做要求,但仍建议标注出立体化学。产物环己烯衍生物C的结构见图13。第三步,首先考查酰氯的制备。从羧酸制备酰氯可以使用SOCl2、PCl3或PCl5[11]。随后酰氯与一级胺发生羰基碳原子上的亲核取代反应,得到酰胺D,结构见图13。第四步,根据题意,可知在Pd(dtbpf)2Cl2(结构式见图13)的催化下将芳基苯硼酸与芳基溴代烷进行偶联,所以此处是D中溴所连碳原子与加入的1H-吡唑-3-硼酸进行偶联,得到化合物E,结构见图13。

图13 化合物C、D、F和Pd(dtbpf)2Cl2的结构
Suzuki-Miyaura反应属于过渡金属催化的有机反应,本考试对该机理不作要求,可参考文献[10]。
第2小问,根据系统命名法[11],可知A的系统命名为2-溴-4-氟苯乙酮。第3小问,根据顺序规则,可判断出1号和2号手性碳原子的构型均为S构型。
1.3 第3题
1.3.1 试题
研究发现,化合物F对白色念珠菌具有较强的抑制作用。F可经图14所示合成路线制备:

图14 化合物F的合成路线
回答下列问题:
1) 写出A、C、D、E的结构简式。
2) 写出A→B的反应类型。
1.3.2 试题解析
第1小问,对氟苯硫酚与顺丁烯二酸酐在三乙胺的催化下进行硫杂Michael加成。该反应属于1,4-共轭加成反应,常用三乙胺等碱催化。书写反应机理时,应当注意亲核试剂为对氟苯硫酚负离子,因为对氟苯硫酚的pKa= 6.2[19],三乙胺的pKb= 3.25[11],二者能够发生酸碱反应,平衡常数为3.55 × 104,进行的比较完全。但部分作者在撰写中国化学奥林匹克竞赛(初赛)试题解析时并未注意到这一点[20]。生成A的机理见图15。
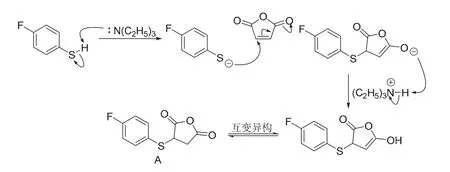
图15 生成化合物A的机理
B到C的转化为酰氯的制备,酰氯很容易发生醇解反应,故C与甲醇发生醇解反应得到酯。D到E的转化,根据D和E的化学式可知,肼取代了甲氧基。故此处为酯的肼解反应,得到酰肼E。化合物A、C、D和E的结构见图16。
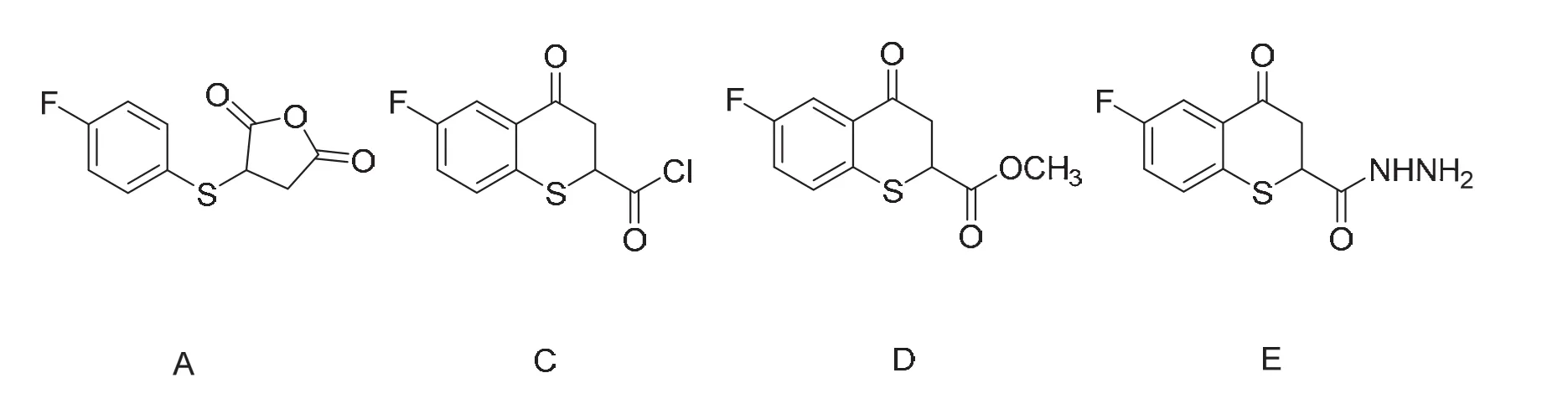
图16 化合物A、C、D和E的结构
Bentiss等[21]提出了一锅合成1,3,4-噁二唑的方法:将羧酸、N2H4、P2O5、POCl3与H3PO4共热2小时,本题E到F的转化便是基于此法。由于相关机理研究鲜见报导,笔者根据文献[22]提出一种可能的历程:酯首先发生肼解,羧酸与POCl3发生取代反应得到酰氯,这两步较为简单,具体步骤已略去。随后是POCl3引发的关环反应,最后质子消除得到1,3,4-噁二唑,反应机理见图17。
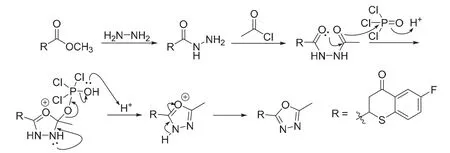
图17 生成1,3,4-噁二唑衍生物G的机理
第2小问,从A和B的结构来看,苯环上的氢原子被亲电试剂所取代,属于亲电取代反应。该反应称为Friedel-Crafts酰基化反应,反应机理在相关书籍已给出[11]。
2 结语
本年度的江苏省化学竞赛选拔赛有机试题的难度与往年基本持平,但选题素材更紧密贴合近期科研成果,较好地激发了高中生学习有机化学的兴趣。主要从羰基化合物的反应、羧酸及其衍生物的制备、Pictet-Spengler反应和 Diels-Alder反应等方面进行了考查,深入浅出,充分体现了化学竞赛选拔人才和兴趣培养二者并重的宗旨。同时,现代量子化学方法在化学竞赛中也有一定应用,笔者通过这一手段,结合图像进行教学辅助,以供相关师生进行参考。
——碳正离子的产生及稳定性比较

