全外显子组测序揭示家族性渗出性玻璃体视网膜病变新型LRP5突变的研究
陈 晨,赵汝莲,彭 丽,李姝锦,4,杨正林,,4
(1.中国科学院成都生物研究所,四川 成都 610041;2.中国科学院大学,北京 100049;3.电子科技大学,四川 成都 611731;4.四川省医学科学院·四川省人民医院,四川 成都 610072)
家族性渗出性玻璃体视网膜病变(FEVR)是一种致盲性疾病,是导致青少年视力损伤的主要原因之一,最早由Criswick和Schepens报道[1]。在本研究中,通过对两个FEVR家族的先证者进行全外显子测序分析以及Sanger测序验证,成功鉴定了两个新的错义突变:c.3503A>G;p.Y1168C和c.4391T>C;p.M1464T。经过荧光素酶报告基因实验,发现本研究鉴定出的两个LRP5基因的新错义突变均使Norrin/β-catenin信号通路活性显著下调,这可能导致FEVR的发生。本研究揭示了FEVR患者的遗传因素,扩宽了LRP5基因的突变谱,为FEVR的分子诊断提供理论依据和新的靶点,从而指导临床。
1 对象与方法
1.1 研究对象选取2019年4月收集的样本资料。罹患FEVR的两个不相关家庭均来自印度Aravind眼科医院。所有受试者均已签署书面知情同意,所有实验均在赫尔辛基宣言的宗旨指导下进行。该研究得到四川省人民医院伦理监督委员会的批准。通过B超、裂隙灯生物显微镜、眼底照相和眼底荧光素血管造影术(FFA)进行FEVR的诊断。所有患者均排除早产,吸氧史或吸毒史。
1.2 DNA提取和全外显子组测序使用DNA提取试剂盒(TianGen,北京,中国)从外周血样本中提取先证者及其家系的基因组DNA样本。家系先证者及相关家系成员的外周血DNA于2019年4月提取完成,存放于-80 ℃,用于后续全外显子测序。使用全外显子组测序技术对两个先证者的DNA样本测序。DNA文库的构建基于Agilent SureSelect Human All Exon V5试剂盒(Agilent Technologies,Santa Clara,CA,USA)。文库测序基于HiSeq2500测序仪(Illumina,圣地亚哥,CA,美国)。原始数据与UCSC hg19(http://genome.ucsc.edu)比对基于BWA(http://bio-bwa.sourceforge.net/)。SAMTOO LS(http://samtools.sourceforge.net/)和ANNOVAR分析用来识别SNP以及插入和删除(indels)。使用以下数据库对突变进行次要等位基因频率(MAF)过滤(MAF <0.001):gnomAD数据库(http://gnomad.broadinstitute.org/),1000 genomes数据库(www.internationalgenome.org),dbSNP138数据库(www.ncbi.nlm.nih.gov/projects/SNP),以及由1600个通过全外显子组测序(WES)的对照样本生成的内部数据库[2~5]。候选致病突变经在线工具(SIFT/PROVEAN和Variant Effect Predictor)预测候选变体是否有害。所有候选致病突变均符合常染色体显性遗传模式。
1.3 突变验证2020年5月,对所有可获得的家庭成员实施Sanger测序,以验证候选突变是否与FEVR表型共分离。使用Primer3在线工具(https://bioinfo.ut.ee/primer3-0.4.0/)设计聚合酶链反应(PCR)引物。引物的合成由生工生物工程(中国上海)承担。使用以下引物扩增基因组DNA片段:F:5′-CTGAGAGGCAGGGGCTTT-3′,R:5′-CGCTCACCCTCTCTGAGACT-3′。PCR产物使用FastAP热敏碱性磷酸酶(Thermo Scientific Fermentas)纯化。
1.4 质粒定点诱变和荧光素酶测定(Luciferase assay)将野生型LRP5基因编码序列克隆到C末端带有HA标签的pCDNA3.1载体中。使用QuickChangeR Lightning Site-directed Mutagenesis Kit (New England Biolabs,MA,USA)试剂盒进行DNA定点突变,构建携带c.3503A>G;p.Y1168C和c.4391T>C;p.M1464T定点突变。使用EntransterTM-H4000转染试剂(Engreen,中国北京),将100 ngNorrin,100 ngFZD4、200 ngpGL4.1与100 ng野生型或携带突变的LRP5质粒或Vector空载体共转染进HEK293 STF细胞。48 h后,去除培养基后,利用1×PBS清洗细胞,加入150 ml细胞裂解液于冰上裂解5 min,待细胞裂解完全后将裂解产物移至1.5 ml离心管,12000×g离心后吸取100 ml上清液于96孔板上。通过双重荧光素酶报告基因测定系统(TransGenBiotec)测量报告基因活性,相对荧光素酶单位(萤火虫荧光/海肾荧光活性)即代表Norrin/β-catenin信号通路的活性强度。
1.5 细胞培养和免疫荧光染色(ICC)将COS7细胞接种在24孔板(Corning)中的细胞爬片上,于5%二氧化碳培养箱中37 ℃培养。转染野生型LRP5质粒、或突变型LRP5质粒、或Vector空载体。48 h后,在室温下于4%PFA(多聚甲醛)中固定20 min。随后,将爬片在磷酸盐缓冲溶液(PBS)(Sigma)中润洗3次(5分钟/次)。在室温下用封闭缓冲液(5%FBS、0.2%Triton X-100配制于PBS中)封闭30分钟,随后加入一抗,于4 ℃摇床上孵育过夜。次日于室温下,用荧光标记的二抗孵育1小时。通过激光共聚焦显微镜800(Zeiss,德国)拍摄免疫荧光图像。
1.6 抗体免疫荧光染色使用的抗体为:anti-HA(Roche,1∶2000稀释),DAPI(Cell Signaling Technology,1:500稀释),Alexa FluorTM-488 goat Anti-Rat(Invitrogen,1∶500稀释)。
1.7 统计学方法使用GraphPadPrism 6.0软件对荧光素酶报告基因实验结果进行统计分析。计数资料比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征本研究招募了两个罹患FEVR的印度家系。第一个家系,先证者于50岁时确诊FEVR。第二个家系,先证者于18岁时确诊患有FEVR,其父亲和妹妹均被诊断为FEVR。
2.2 LRP5基因的新突变使用全外显子测序(WES),和生物信息学分析,在两个印度FEVR家系中初步筛选出了两个新的LRP5突变:c.3503A>G;p.Y1168C和c.4391T>C;p.M1464T。在dpSNP138、Exome Variant Server、ExAC和gnomAD中未观察到这两个突变。此外,与内部数据库(1600名健康对照的外显子组测序分析数据)对比并未观察到上述两个突变。由此推断c.3503A>G;p.Y1168C和c.4391T>C;p.M1464T是FEVR致病候选突变。
2.3 Sanger测序验证结果为了验证全外显子测序结果的准确性,我们利用Sanger测序和共分离分析,进一步确定突变的致病可能性。对于c.3503A>G;p.Y1168C突变,先证者被鉴定为纯合子携带者,其三个儿子均为杂合子携带者(图1a)。此外,先证者的丈夫不携带LRP5突变(图1a)。谱系分析表明c.3503A>G;p.Y1168C突变与该家族的疾病表型共分离,得出结论,该突变以常染色体显性方式遗传。对于c.4391T>C;p.M1464T突变,先证者、其父亲及妹妹均被诊断出患有FEVR并携带杂合突变(图1b),然而,本研究缺乏先证者母亲的遗传数据。家系分析表明c.4391T>C;p.M1464T突变与该家族中的疾病表型共分离,得出结论,该突变以常染色体显性方式遗传。
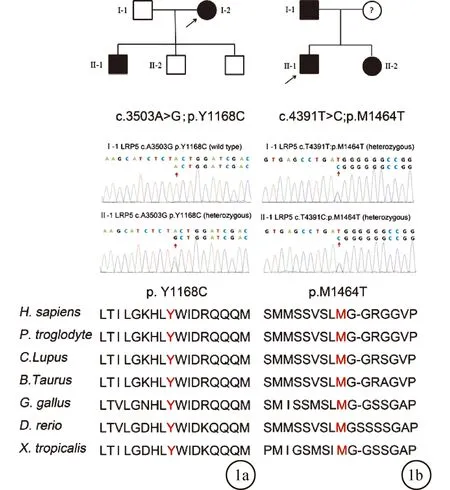
图1 家系遗传图谱、Sanger测序结果及物种保守性分析结果 a:家系1;b:家系2
2.4 LRP5基因的突变使Norrin/β-catenin信号通路下调LRP5是激活Norrin/β-catenin信号传导通路的重要组分。为了研究突变对Norrin/β-catenin信号传导的影响,在HEK293STF细胞中进行了荧光素酶报告基因检测。将NDP、FZD4、PGL4.1(组成型启动子下的海肾萤光素酶作为内部对照)与野生型LRP5、突变型LRP5或Vector空载体共转染,在细胞裂解液中依次加入萤火虫荧光素酶底物和海肾荧光素酶底物,经检测后,两次测得的结果比值即为Norrin/β-catenin信号通路的相对活性。与野生型质粒相比,两个突变均显著降低LRP5激活Norrin/β-catenin信号通路活性的能力,差异有统计学意义(P<0.05),见图2a。
2.5 突变并不影响LRP5蛋白的定位使用细胞免疫荧光化学(ICC)研究突变是否引起LRP5蛋白的定位改变。结果表明这两个突变蛋白与野生型LRP5蛋白定位一致,表达于细胞质中,且主要积累于高尔基体中,见图2b。
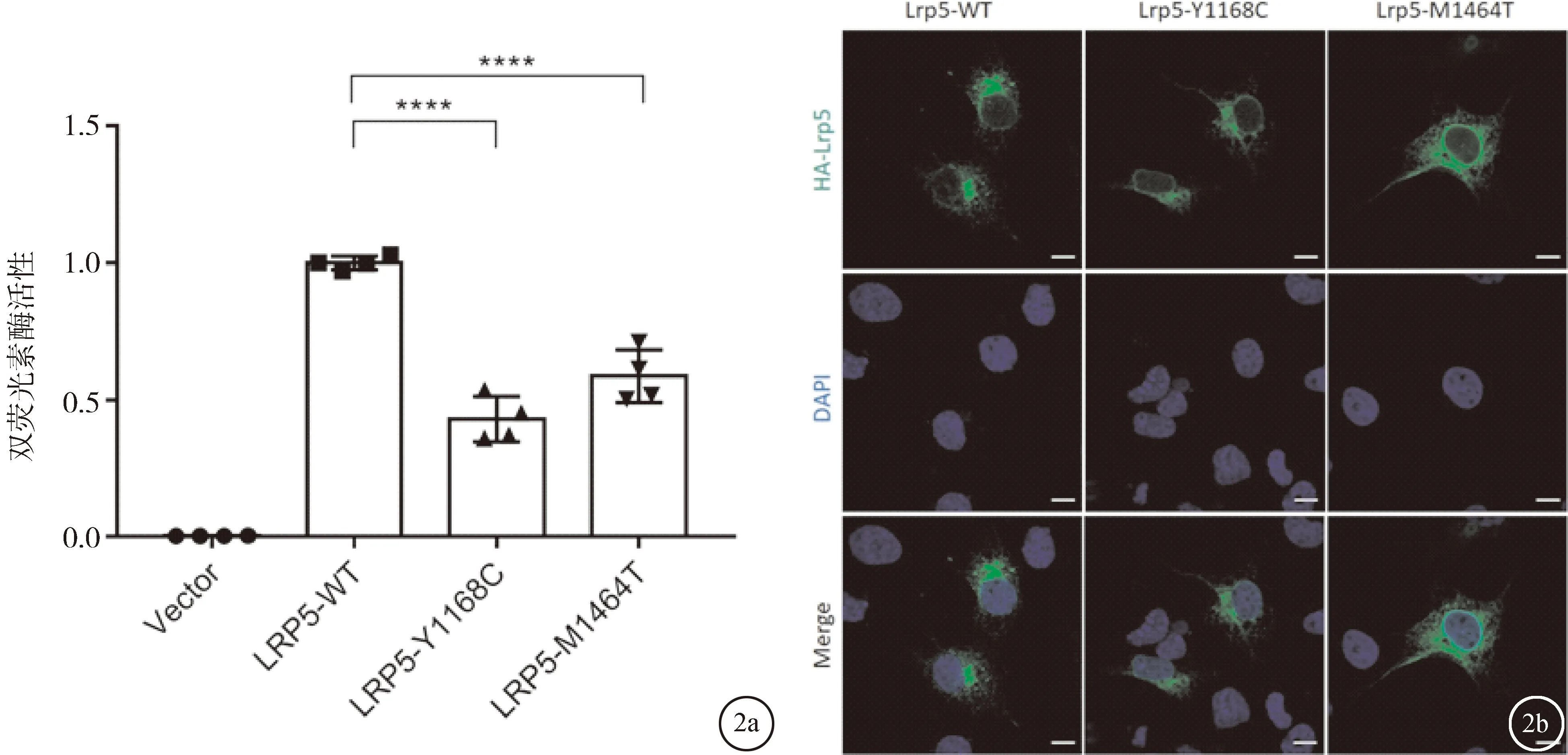
图2 双荧光素酶报告基因实验结果及ICC结果 a:实验结果,**** P<0.0001;b:ICC结果,比例尺:25 μm
3 讨论
家族性渗出性玻璃体视网膜病变(FEVR)是一种罕见的遗传性视网膜血管疾病,是青少年视力丧失的主要原因。目前,由于FEVR的临床和遗传异质性,其诊断仍存在困难。FEVR具有高度的临床异质性,其临床表现多样。典型的FEVR可表现为周围血管缺失、视网膜新血管生成、视网膜牵拉和脱离、玻璃体出血和黄斑性近视,最终导致失明[6]。FEVR具有遗传异质性即其遗传方式多样,包括常染色体显性遗传、常染色体隐性遗传或X性染色体连锁遗传[6,7]。到目前为止,NDP、FZD4、LRP5、TSPAN12、ZNF408、KIF11、RCBTB1、CTNNB1、ILK、JAG1、CTNNA1、ATOH7和11p12-13染色体上的EVR3[8~16]的突变都可能导致FEVR的发生。尽管在最近几十年中,研究者们已陆续鉴定出FEVR致病相关的新基因及其突变,但迄今为止报道的突变仅能解释约50%的FEVR病例。其中,由NDP、FZD4、LRP5、TSPAN12和CTNNB1基因编码的蛋白质参与Norrin/β-catenin信号传导途径,在视网膜血管发育中起着至关重要的作用[17]。Norrin/β-catenin信号传导途径是经典Wnt信号通路,在生物的生长过程中起重要作用。Norrin/β-catenin信号通路的正常活性对视网膜血管形成过程尤为重要。Norrin/β-catenin信号通路的几个核心组成部分的突变均会导致到FEVR的发生。
在本研究中,通过全外显子测序技术在两个印度家庭中的先证者NDA样本中鉴定了两个与FEVR相关的LRP5基因的新突变:c.3503A>G;p.Y1168C和c.4391T>C。利用Sanger测序在家系的成员中验证得到的候选致病新突变。临床诊断结果以及Sanger测序结果表明这两个新突变的基因表型共分离,并且突变所累及的氨基酸残基在各物种中具有高度保守性。结论:这两个突变均以常染色体显性方式遗传,见图1。
接下来对c.3503A>G;p.Y1168C和c.4391T>C突变的致病性进行了研究。双荧光素酶活性检测可以反映Norrin/β-catenin信号通路的活性。实验发现,与野生型LRP5蛋白相比这两个新突变均导致Norrin/β-catenin信号通路受到抑制,见图2a。这说明c.3503A>G;p.Y1168C和c.4391T>C突变是致病突变。接着探讨了突变对蛋白定位是否有影响。细胞免疫荧光实验是常用的观察突变对蛋白定位影响的实验手段。如图2b所示,与野生型LRP5相比,突变并没有影响蛋白的定位。野生型及突变蛋白均表达于细胞质中。这表明LRP5蛋白的定位并未受到这两个突变的影响。
综上,本实验发现了c.3503A>G;p.Y1168C和c.4391T>C;p.M1464T两个FEVR致病突变。本研究扩大了LRP5基因突变谱,为FEVR的遗传诊断和咨询提供了理论依据。然而,突变导致FEVR的致病机制仍有待进一步研究。

