超声造影及动态增强磁共振成像诊断乳腺非肿块样强化病变的价值
李丽环,王 帆
泰康仙林鼓楼医院,江苏 南京 210093
乳腺非肿块样强化(non-mass-like enhancement of breast,NMLE)病变具有明显的病理特征,其成像无肿块样强化征,占位及边界也不显著,并且正常的腺体和脂肪组织混合存在于肿瘤中,使得临床诊断困难[1]。当前,用于乳腺癌诊断的常用和经济的方法是乳腺触诊,该方法在很大程度上取决于检查医生的检查水平和方法,有很大的局限性,漏诊率和误诊率较高。放射学评估使用钼靶、超声、CT等方法获得图像诊断结果,但敏感性和特异性低[2,3]。实时灰度对比增强超声(contrast-enhanced ultrasound,CEUS)是超声领域的研究热点之一,临床诊断应用广泛[4]。动态增强磁共振成像(dynamic enhanced magnetic resonance imaging,DCE-MRI)是诊断乳腺病变的重要方法,可以用于多个方向的多序列和重复扫描序列成像,可对软组织病灶进行清晰成像[5]。本次研究探讨了CEUS及DCE-MRI在乳腺NMLE良恶性病变诊断中的价值。
1 资料与方法
1.1 一般资料
选取2017年1月~2019年10月在我院就诊的NMLE病变患者120例,年龄22~77岁,平均年龄(45.54±9.87)岁。纳入标准:经影像学证实为NMLE;单一病灶;性别为女;患者及家属均阅读并签署了知情同意文件。排除标准:已接受过放化疗等治疗;基础病理资料不全。
1.2 CEUS检查
仪器为 SIEMENS 的 ACUSON S 2000 彩超仪。指导患者仰卧,双手置于头部,完全暴露双侧乳房。使用高频线性阵列探头,先检查健康侧乳房,然后检查患侧,从外周到乳头进行全面扫描。首先以二维模式找到乳房中的肿瘤病变,观察并记录图像,将显示更完整、清晰和丰富的血流信号部分用作观察部分。激活CEUS模式,保持探头稳定,清晰显示乳腺病变,中场和后场增益适当降低。将SonoVue和5 mL生理盐水混合,经过肘静脉注入患者体内,接着注入5 mL生理盐水冲管。动态观察记录血管造影的整个过程,获取病灶增强图像,记录时间-信号强度曲线(TIC)。所有病灶均按照北美放射学会的乳腺影像报告和数据系统BI-RADS 分级标准进行分级[6],BI-RADS 1~4B级病灶划分为良性,4C~5级病灶划分为恶性。
根据TIC曲线的形态特征,可分为3种类型:I型(流入型):在动态增强扫描过程中病变的信号强度持续增加,后期的信号增强大于10%;Ⅱ型(平台型):在动态增强扫描的早期,病变的信号强度增加,在动态增强的中、晚期,信号强度的增减小于10%;Ⅲ型(流出型):病变的信号强度在动态增强扫描的早期增加,在中后期减少,幅度大于10%。
1.3 DCE-MRI检查
仪器为飞利浦Archieve 3.0T核磁共振仪,体位为俯卧位,嘱患者将双乳房自然垂至线圈内。进行T1WI-FLASH和T2WI-TRIM扫描,参数为TR 4.43 ms,TE 1.73 ms,层厚1 mm。团注钆喷酸葡胺(Gd-DTPA)后用20 mL生理盐水以相同的速率冲管,注入造影剂后连续扫描5个时间相,延迟25 s,每个相的扫描时间为 1 min 14 s,总共7 min 51 s。分析结果,同时根据BI-RADS分类标准进行良/恶性鉴别,1~4B类提示良性,4C~5类提示恶性。
1.4 统计学处理
采用SPSS 22.0软件进行数据分析,用t检验或χ2检验分析组间差异。检验水准:α=0.05。
2 结果
2.1 病理结果
120例患者中,包括恶性病变92例、良性病变28例。恶性病变中,有浸润性导管癌67例、导管原位癌20例、浸润性小叶癌3例、黏液癌2例。良性病变中,有乳腺增生17例、乳腺炎性病变6例、乳腺腺瘤5例。
2.2 良/恶性NMLE病变的CUES表现比较
恶性病变的高增强、快进增强和快出消退比例明显高于良性病变(P<0.05)。见表1。
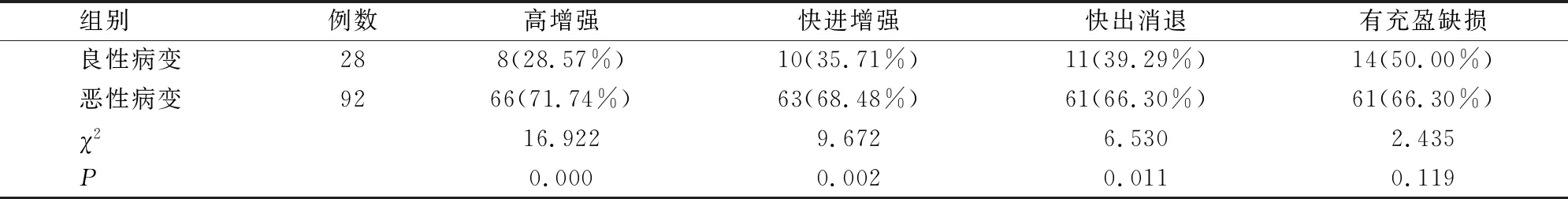
表1 良/恶性NMLE病变CEUS表现比较
2.3 良/恶性NMLE病变的DCE-MRI表现比较
恶性NMLE病变的DCE-MRI表现呈节段分布、内部强化呈簇状比例明显高于良性病变(P<0.05),而ADC值明显低于良性病变(P<0.05)。见表2。
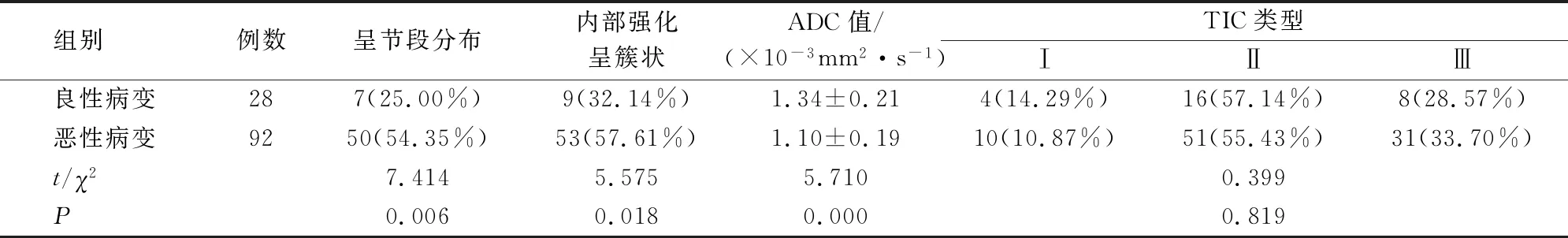
表2 良/恶性NMLE病变DCE-MRI表现比较
2.4 CEUS和DCE-MRI鉴别NMLE良/恶性病变的价值
CEUS和DCE-MRI诊断NMLE良/恶性病变的诊断价值比较,差异无统计学意义(P>0.05),见表3。

表3 CEUS和DCE-MRI鉴别良/恶性NMLE病变的价值
2.5 典型病例
某患者,女,54岁,病理结果为浸润性导管癌。超声下边界不清晰,见图1a;CEUS显示高增强,中央见灌注缺损,见图1b;DCE-MRI显示病变呈节段分布,见图1c;ADC图像显示病变区ADC值为1.13×10-3mm2·s-1,见图1d;病理结果见图1e。

图1 NMLE病变患者典型图像
3 讨论
NMLE是BI-RADS-MRI中定义的一种特殊形式,恶性病变主要见于原位导管癌、浸润性小叶癌和浸润性导管癌[7],良性病变则是在乳腺腺病、增生、腺瘤、导管内乳头状瘤和炎症性病变中更为常见[8]。临床上准确辨别NMLE良/恶性病变有利于指导治疗方案,改善患者预后。放射学评估使用钼靶、超声、CT等方法获得图像诊断结果,然后结合组织病理学以获得最终结果。钼靶是检查乳腺病变的首选,可以节省成本,避免不必要的活检和其他影像学检查[9]。钼靶可以识别结节、毛刺、钙化情况,但密度分辨率不高。超声可发现致密性乳腺癌病灶,以及在临床触诊时无阳性反应和在钼靶中未明确发现的病例[10]。CT可以清晰地显示出各个级别乳房的特定解剖结构,还可以发现高度隐蔽的小病变,并且可以客观地评估前纵隔和腋窝区域的淋巴结,但是乳腺癌诊断的敏感性和特异性较低,具有一定局限性[11]。
目前,常见的灌注成像方法主要包括CEUS和DCE-MRI,两者都可以显示出肿瘤的新血管形成和肿瘤周围的血管生成,反映出肿瘤的灌注特点[12]。恶性肿瘤内部新生血管丰富、癌细胞生长代谢旺盛,并且具有网格状血管结构[13]。CEUS所用的造影剂是大分子物质,在传统的多普勒超声检查的基础上,可显示出实质性微循环,进一步提高诊断乳腺良/恶性病变的准确性[14]。DCE-MRI选用的造影剂分子体积较小,可自由渗透到组织[15]。两种成像方法原理不同,均可以反映肿瘤的灌注特征。
本次研究结果显示,120例患者中恶性NMLE病变患者以浸润性导管癌和导管原位癌为主,良性NMLE病变患者主要表现为乳腺增生和乳腺炎性病变。恶性NMLE病变高增强、快进增强和快出消退比例明显高于良性NMLE病变,分析原因可能是与良性病变相比,恶性肿瘤的内部微环境改变,血管生长因子分泌增加,毛细血管异常增加,灌注强度增加。由于恶性乳腺病变中常有血管坏死和微小新生血管形成,因此血管造影显示增强不均匀,快进增强和快出消退病灶明显。ADC可提示组织内水分子扩散情况,对乳腺恶性病变鉴别具有较高效能,但对乳腺NMLE病变的检出效果如何,目前的研究较少[16]。本组研究中,恶性病变ADC值较良性病灶更低,这与恶性病变水分子扩散受限有关,限制水分子在人体中扩散的是细胞膜的结构,与蛋白质样大分子的吸附有关。由于乳腺恶性病变细胞繁殖快,细胞密度增加,从而增大了细胞膜对水分子的影响程度,因此其ADC值明显低于良性病变。
既往研究显示[17-20],乳腺恶性病变具有明显的节段性和聚集增强征,本研究佐证了这一点。原因是NMLE主要是导管内或浸润性导管癌,导管内癌主要位于末梢小叶单元的小导管或腺泡状导管中,血液供应丰富,增强扫描表现为节段分布和簇状增强。基于动态对比增强乳腺扫描(DCE-MRI)评估病变在不同时间节点的对比剂浓度,获得的病变时间信号强度(TIC)曲线类型可以更直观地反映微血管的生长信息。本研究中,良/恶性病变的TIC类型差异不具有统计学意义。由于本研究的病例样本小,无法进一步研究不同病理类型的乳腺癌与TIC曲线之间的关系,有待今后研究分析。
综上所述,本研究将CEUS及DCE-MRI两种方法用于乳腺NMLE患者良/恶性病变诊断,对两种影像学诊断方法进行了比较研究,结果证实CEUS及DCE-MRI在NMLE良/恶性病变鉴别工作中均具有较高效能,可以进一步实现影像学的互补优势,提高乳腺病变诊断和鉴别诊断的准确性。

