玉米转录因子基因ZmMYB308的克隆及表达分析
王新涛,杨 青,代资举,李保叶,郝俊杰*
(1 河南省农业科学院 植物保护研究所,郑州450002;2 河南省农业科学院 芝麻研究中心, 郑州450002; 3 河南省作物分子育种研究院, 郑州450002)
玉米是中国最重要的粮食作物之一,近年来玉米生产规模化程度提高,对于玉米品种适应全程机械化的要求也越来越迫切,而玉米茎秆倒伏是制约中国玉米机械化收获发展的主要因素之一[1];同时随着全球极端气候发生频率的不断增多,对于玉米品种的稳产抗倒性要求也越来越高。研究表明,全世界每年因倒伏引起的玉米产量损失估计达到5%~20%,倒伏不仅严重影响玉米产量而且制约着玉米机械化收获程度的提高[2-4]。木质素是构成次生细胞壁的主要成分之一,适当提高木质素含量可以增强玉米茎秆抗折力,从而降低倒伏引起的损失[5-6]。
MYB转录因子作为植物中重要的转录因子家族之一,广泛地参与调节了植物生长发育的许多重要过程,如调控基因转录、维持细胞结构、信号通路传导和生物及非生物胁迫的生理响应等[7]。MYB类蛋白的N端通常含有约51~52个氨基酸组成的高度保守的MYB结构域,C端为转录激活结构域;根据所含MYB结构域的数量和位置,MYB 转录因子可分为1R-MYB、R2R3-MYB、3R-MYB 和4R-MYB四个亚类:1R-MYB又被称为MYB-related亚类,只包含一个R结构域,在维持细胞完整性和周期节律方面发挥着重要作用;R2R3-MYB是数量最多的亚类,广泛参与植物的生长发育和代谢途径调节等过程;3R-MYB亚类在植物中的数量相对较少,它们主要是参与细胞周期运行以及细胞分化;4R-MYB亚类在MYB转录因子基因家族中是最小的一类,对其功能的研究目前还很少[8]。
通过苯丙烷途径合成的木质素是构成植物骨架的主要成分之一,多个MYB转录因子在木质素合成途径中起着重要的调节作用[9]。拟南芥中次生细胞壁相关蛋白AtSND1通过调控下游的AtMYB83和AtMYB46,进而诱导AtMYB58、AtMYB63和AtMYB85的表达,最终引起相关木质素合成基因上调[10-11];桉树MYB2蛋白通过直接与苯丙烷途径中CCR和CAD基因的启动子结合,从而影响木质素和次生壁的形成[12];水稻OsMYB46在拟南芥中过表达可以激活次生壁的合成途径[13]。这些不同的MYB成员通过正向或负向作用机制有效调控木质素的合成,因此,加强对MYB家族基因的相关研究具有重要的现实意义。
玉米MYB转录因子在茎秆中参与木质素生物合成的研究相对较少,对ZmMYB308基因的研究还未见报道。本研究利用玉米自交系‘郑58’不同发育阶段的茎秆转录组数据,初步筛选出差异表达的MYB转录因子并进行分析,以‘郑58’茎秆为材料,克隆了玉米ZmMYB308基因,对该基因进行了生物信息学特征分析,利用荧光定量PCR分析ZmMYB308在玉米不同部位与不同发育时期的表达模式,以期为玉米高茎秆强度基因筛选及分子育种应用提供依据。
1 材料和方法
1.1 材 料
以玉米优良自交系‘郑58’为材料[14],种植行长2 m,行距0.6 m,株距0.25 m。2018年6月在河南省农业科学院原阳基地播种,出苗后正常田间管理,分别取6叶期、拔节期、大喇叭口期、吐丝期和灌浆期(吐丝后10 d)的玉米茎秆,在玉米吐丝期取茎、根、叶、花丝、雄穗和雌穗等不同组织为样品,经液氮速冻后于-80 ℃超低温冰箱保存备用,每个样品3个生物学重复。
1.2 方 法
1.2.1 茎秆穿刺强度测定在玉米吐丝期和灌浆期进行茎秆穿刺强度测定,利用YYD-1型数显植物茎秆强度测定仪(浙江托普仪器有限公司)选择地上部第3节间中部,对玉米茎秆进行穿刺,瞬间读取并记录数据(N/mm2),每个时期连续选取5株进行测定。
1.2.2 转录组测序及差异表达基因筛选根据‘郑58’茎秆强度变化,选择其具有显著差异时期(抽雄期和灌浆期)的茎秆(地上部第3节间)进行采样,采集的样品(3次生物学重复)送至北京诺禾致源科技股份有限公司进行转录组测序和分析。
分别提取各样品总RNA并检测合格后,依次进行Oligo(dT)磁珠富集、mRNA反转录、cDNA文库构建和Illumina平台测序,参考玉米B73(RefGen_v4)基因组序列,进行序列组装、比对和功能注释等相关分析。基因表达量采用FPKM (fragments per kilobase of exon model per million mapped reads)计算[15],利用DEseq分析差异基因,以差异倍数|log2(Fold change)|>1且错误检出率(FDR)<0.05为标准筛选吐丝期和灌浆期茎秆中差异表达的MYB转录因子基因。
1.2.3 玉米RNA提取及cDNA第1链合成各样品经液氮研磨后利用TRNzol法提取总RNA,1%琼脂糖凝胶电泳检测RNA完整性。以不同玉米样品总RNA为模板,使用PrimeScript RT-PCR Kit(TaKaRa)试剂盒,反转录获得玉米cDNA第一链。
1.2.4 玉米ZmMYB308基因的克隆根据转录组筛选的差异表达候选基因及在NCBI上比对筛选,在GenBank中获得一条具有完整开放阅读框(open reading frame, ORF)的玉米MYB308序列,利用Primer Premier 5.0软件设计用于扩增ZmMYB308特异引物ZmMYB308-F(TCTTCCGTTTCCGTCTCCC)和ZmMYB308-R(CGACG-ACGCCTGCCTTAT)。以‘郑58’茎秆cDNA为模板进行全长扩增。
1.2.5 生物信息学分析利用NCBI的ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/)工具预测基因ORF区、CCD (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)工具进行蛋白序列保守结构域分析;利用cNLS Mapper(http://nls-mapper.iab.keio.ac.jp/)分析基因核定位信号肽;使用ExPAsy的Compute pI/MW(http://www.expasy.org/tools/pi_tool.html)工具计算蛋白序列的分子量及等电点;利用DNAMAN9软件进行蛋白翻译和序列比对。
1.2.6 荧光定量PCR表达分析根据转录组筛选获得的差异候选基因序列设计荧光定量引物,玉米肌动蛋白基因(β-Actin)为内参基因(表1)。以玉米不同部位和不同时期的茎秆cDNA为模板,反应体系为15 μL,其中cDNA模板1 μL,上下游引物各0.6 μL、SYBR Premix ExTaq(TaKaRa) 7.5 μL、ddH2O 5.3 μL。在荧光定量PCR仪(Bio-Rad Miniopticon Real-Time PCR System)上进行扩增,定量PCR程序:95 ℃预变性2 min,95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸25 s,并收集荧光信号,40个循环。基因的相对表达量釆用2-ΔΔCT算法进行分析。
2 结果与分析
2.1 差异表达MYB转录因子的筛选及分析
‘郑58’在吐丝期的茎秆穿刺强度为25.87 N/mm2,在灌浆期的茎秆穿刺强度为30.23 N/mm2。对吐丝期与灌浆期的茎秆MYB转录因子基因数目进行统计分析(表2),获得14个差异表达MYB转录因子基因,分别位于玉米的1、2、3、5、6、7、8和10染色体,其中10个表达量下降,4个表达量上升。荧光定量PCR分析结果(图1,部分结果)显示,MYB39/MYB59(下调)和MYB4/MYB126(上调)在吐丝期和灌浆期茎秆中的表达趋势与转录组数据分析结果趋势相符,验证了转录组基因表达数据的可靠性。
根据SANT保守结构域的数目进行分类,这些差异表达的MYB转录因子包含2个1R-MYB和12个R2R3-MYB亚类,没有发现3R-MYB和4R-MYB。对蛋白序列分析发现,茎秆差异表达的MYB蛋白家族分子量在27.01~50.1kD之间,等电点为4.58~9.17。这些结果说明随着玉米茎秆的生长发育,各MYB转录因子的表达出现差异化。

表1 荧光定量PCR分析的候选基因及其引物序列

表2 差异表达MYB转录因子基因信息

不同小写字母代表0.05水平差异显著图1 玉米吐丝期和灌浆期MYB部分基因的相对表达Different normal letters represent significant differences at 0.05 levelFig.1 Relative expression of some MYB genes in the silking stage and grain filling stage
2.2 玉米ZmMYB308基因cDNA的克隆
根据以上转录组差异基因分析数据,再结合其他植物MYB308类基因在茎秆木质素合成途径中的负调控作用模式[16-17],选取在吐丝期和灌浆期显著下调表达的玉米MYB308基因进行后续试验分析。以玉米自交系‘郑58’的茎秆cDNA为模板,经PCR扩增获得玉米ZmMYB308的cDNA序列(图2)。其cDNA全长907 bp,包含一个747 bp的ORF,编码248个氨基酸。通过MaizeGDB数据库Blast序列分析发现,ZmMYB308基因位于玉米第8染色体的bin8.08区域,包含2个外显子和1个内含子。

M. DL5000;1.cDNA图2 ZmMYB308基因cDNA扩增Fig.2 PCR product of ZmMYB308 cDNA
2.3 玉米ZmMYB308基因的生物信息学分析
经ExpasyProtParam预测ZmMYB308蛋白分子量为27.01 kD,等电点为9.17,分子式为C1179H1874N354O349S13,不稳定系数为61.67,蛋白疏水性指数为-0.533,脂肪系数为 69.8,说明该蛋白为不稳定的亲水性蛋白。利用cNLS Mapper预测在蛋白N端有一段核定位信号(图3)。通过NCBI分析CDD功能结构域发现ZmMYB308蛋白N端具有2个保守的 DNA 结合结构域(图4),属于典型的R2R3-MYB亚类转录因子。

SANT 结构域,Myb DNA-binding结构域,REB1超家族图4 ZmMYB308蛋白功能性位点分析SANT domain, Myb DNA-binding domain, REB1 superfamilyFig.4 Conserved domain analysis of ZmMYB308 protein

下划线为核定位信号图3 ZmMYB308基因开放阅读框及预测氨基酸序列The nuclear localization signal is underlinedFig.3 ORF of ZmMYB308 gene and predicted amino acid sequence
2.4 ZmMYB308同源及进化分析
利用NCBI数据库的BlastP在线检索筛选其他植物的 MYB308蛋白序列,选取了桉树(XP_010090332.1)、白杨(XP_009376958.1)和二穗短柄草(XP_003564745.1)等共14个同源序列,通过DNAMAN9.0将玉米ZmMYB308与其他植物的MYB308蛋白序列对比,建立了一个无根分子系统进化树(图5)。比对显示MYB308 类蛋白序列在N端高度保守,而C端的序列保守性较低,系统进化分析将15个不同植物的MYB308蛋白划分为2组,其中ZmMYB308与谷子、高梁和二穗短柄草等MYB308蛋白聚为一类,且与谷子的相似性最高,达到94%。
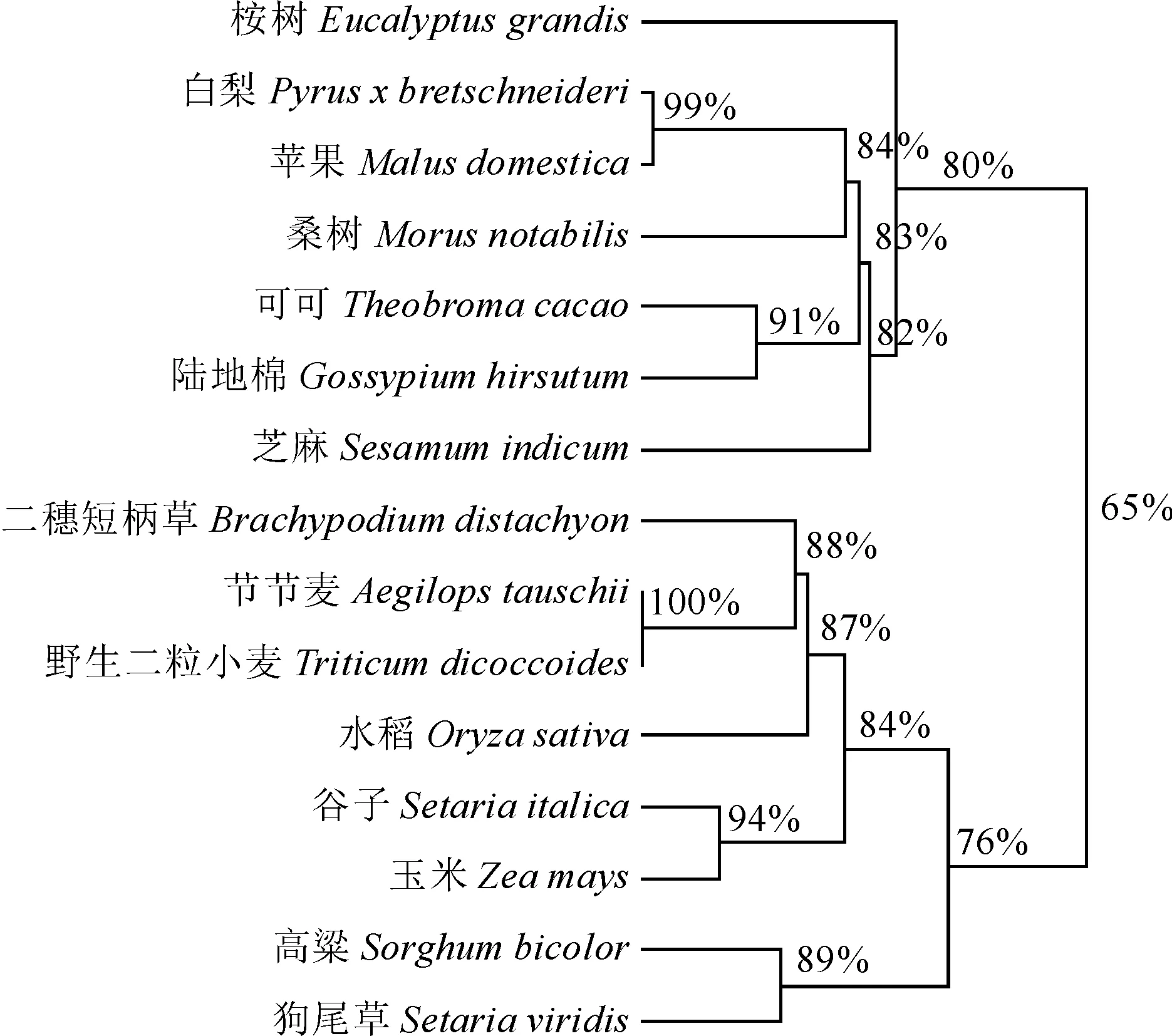
图5 不同物种间MYB308蛋白的进化树Fig.5 Phylogenetic tree of MYB308 protein homologues from different species
2.5 玉米ZmMYB308基因的表达分析
为揭示玉米不同发育时期在茎秆中ZmMYB308基因的表达特性,分别对‘郑58’不同发育时期茎秆中该基因的表达进行分析,结果(图6)表明,ZmMYB308随着玉米发育的推进呈先升高后降低的趋势,在吐丝期表达量最高,随后在灌浆期下降,其变化趋势与茎秆转录组测序结果趋势一致。
为了揭示ZmMYB308在玉米不同组织中的表达情况,在玉米吐丝期对不同组织进行实时荧光定量分析,结果(图7)表明ZmMYB308在玉米不同组织中均有表达,在玉米茎秆中的表达量最高,根、雌穗、雄穗、叶片中的表达量次之,花丝中的表达量最低,其茎秆中的表达量约为花丝中的7.5倍。
3 讨 论
随着转录组测序技术的不断进步,在基因水平上对整体转录活动进行实时检测,从而完整分析不同的代谢通路和验证基因功能变得越来越高效快捷[18-19]。近年来,人们在拟南芥、水稻和玉米等多种植物的不同发育过程进行了大量的转录组分析,从不同角度解析了目的基因及其调控基因的调控网络[20-22]。本研究通过转录组测序和分析,在不同发育时期的玉米茎秆中鉴定出14个差异表达MYB转录因子,在此基础上,采用RT-PCR技术克隆了玉米R2R3-MYB类转录因子ZmMYB308基因,并对其生物信息学与时空表达特性进行了分析。
2R-MYB亚类作为MYB转录因子的主体,可以通过激活木质素合成途径的相关基因来实现对木质素合成的正向调控:在拟南芥中,MYB58能够直接激活木质素生物合成基因(PAL1、C4H和4CL1等)和次生壁相关漆酶基因(LAC4)的表达进而参与了木质素的生物合成途径[10];在杨树中,过量表达PtrMYB2、PtrMYB3、PtrMYB20和PtrMYB21基因可以引起次生壁的异位沉积,导致次生壁增厚[23]。也有多个2R-MYB亚类转录因子是负向调控木质素合成的:在拟南芥中过表达玉米ZmMYB31、ZmMYB42基因可以抑制木质素合成途径中的多个基因,从而降低组织中的木质素含量[24-25];银合欢LiMYB1过表达抑制了苯丙烷途径基因的表达水平,从而引起木质素含量的降低[26];金鱼草中AmMYB308和AmMYB330共同作用可降低木质素的积累[16]。本研究通过转录组分析玉米吐丝期和灌浆期茎秆中MYB转录因子表达量变化,鉴定出差异表达的MYB转录因子中2R-MYB亚类占到85.71%,因此推测这些差异表达的MYB转录因子,特别是2R-MYB亚类转录因子正向或负向地参与了玉米茎秆木质素的生物合成,进一步克隆这些玉米的MYB类转录因子,将有助于全面了解这类基因的功能。

不同小写字母代表0.05水平差异显著图6 ZmMYB308在玉米不同发育时期的表达Different normal letters represent significant differences at 0.05 levelFig.6 The expression pattern of ZmMYB308 in different development stages

不同小写字母代表0.05水平差异显著图7 ZmMYB308在不同组织的表达Different normal letters represent significant differences at 0.05 levelFig.7 Relative abundance of ZmMYB308 transcripts in different tissues
作为MYB家族成员的MYB308及其同源基因在多种作物中被证实能够调控影响木质素合成途径的相关基因[16-17]。本研究从玉米中克隆得到ZmMYB308基因,生物信息学分析显示ZmMYB308蛋白与其他已报道的MYB308类基因的蛋白保守结构域具有较高的相似性,在其N端具有家族典型的MYB保守结构域和核定位信号,玉米ZmMYB308转录因子可能在细胞核中与其他基因互作并调控其下游基因。ZmMYB308基因在不同部位是组成型表达的,在茎中表达量最高,并且ZmMYB308随着茎秆发育在吐丝期达到峰值后下降,同PgMYB308基因在石榴中的表达趋势类似[24]。结合‘郑58’茎秆强度的表型变化,ZmMYB308基因可能和金鱼草AmMYB308、石榴PgMYB308基因一样在木质素合成过程中起着负调控作用。研究还发现ZmMYB31表达受低温诱导,过表达ZmMYB31能增强植株对低温胁迫的耐受性[27],苹果MdMYB308基因在调控苹果花青苷合成中起着重要作用[28],小桐子JcMYB308基因在根与茎中对低温做出响应[29],紫斑白三叶TrMYB308参与类黄酮次生代谢生物合成调控[30],本研究中ZmMYB308在根、雌穗中的表达量高于叶片和花丝,暗示了玉米ZmMYB308基因可能还具有其他重要功能和作用机制,需要进一步深入研究。
本研究通过RNA-Seq测序和数据分析发现,在获得的玉米茎秆转录组数据中除MYB转录因子外还存在其他差异表达基因,挖掘和解析这些重要基因的功能有助于进一步提高对玉米木质素合成机制的认识,也为利用分子生物学手段培育高茎秆强度玉米品种奠定了基础。
作者贡献:王新涛和郝俊杰是本研究的实验设计和实验研究的执行人;王新涛和李保叶完成数据分析和论文初稿的写作;杨青和代资举参与实验设计与实验所得数据分析;郝俊杰是本研究的的构思者及负责人,指导数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。

