雪胆多酚的稳定性及其对α-淀粉酶的抑制作用
段思宇 陈庚 高青青 郭兆宽 段柯兆 张广辉 杨生超 赵艳

摘要:采用Folin-Ciocalte法测定雪胆中的多酚含量,研究金属离子和温度对多酚稳定性的影响,并分析多酚对 α-淀粉酶活性的抑制作用和抑制类型。结果表明,Mn2+、Fe2+、Fe3+和Cu2+对多酚具有破坏作用,其中Mn2+对多酚的破坏作用最显著;温度过高或者过低不利于多酚的保存,温度在25~45 ℃多酚保存效果最佳;酶促动力学研究表明,雪胆多酚对α-淀粉酶具有抑制作用,其抑制作用类型为可逆竞争性抑制,表明雪胆具有开发为辅助降糖保健食品或药品的价值。
关键词:雪胆;多酚;稳定性;α-淀粉酶;抑制作用;金属离子
中图分类号: R284 文献标志码: A 文章编号:1002-1302(2021)09-0167-05
雪胆(Hemsleya chinensis)主要分布在我国西南地区的云南省和四川省[1-2],具有清热解毒等功效,可用于治疗支气管炎、细菌性痢疾和肺结核等[3],具有很高的药用价值,为常用传统药材[4-7]。多酚是一种次生代谢产物[8],主要通过莽草酸和丙二酸途径合成。植物多酚广泛分布于植物的皮、根、叶和果肉中,大部分多酚类化合物为水溶性物质,存在于植物液泡中,天然存在形式较多。多酚类化合物是天然的抗氧化剂,除了有良好的抗氧化功能外,还具有保护植物免受紫外线伤害[9]、抑制细菌[10-11]等作用。多酚的酚羟基在光照等条件下容易被氧化,氧化后颜色加深。一些多酚物质能与 α-淀粉酶相互作用,从而抑制α-淀粉酶的活性[12],这种抑制作用能有效阻碍食物中碳水化合物的水解和消化[13]。
近年来,国内外学者已对雪胆化学成分、药理活性、作用机制等方面进行了研究[4,6-7,14-15]。植物中多酚具有良好的生物活性,已成为医药及食品领域的研究重点之一。然而,多酚在加工或贮藏等过程中,易受到温度、光照和金属离子等的影响而被降解,其抗氧化活性降低。α-淀粉酶是可以影响饮食中淀粉等主要碳水化合物消化和吸收的关键酶,抑制α-淀粉酶的活性能有效降低淀粉等物质的降解和葡萄糖的吸收,从而有效控制血糖的快速升高;因此,从中草药的天然产物中获得α-淀粉酶抑制剂已成为研究热点。但有关雪胆多酚在贮藏过程中的稳定性和对α-淀粉酶抑制活性的研究还鲜有报道。因此,笔者对雪胆多酚的稳定性和雪胆多酚对α-淀粉酶抑制类型进行研究,旨在为雪胆多酚的保存和加工以及今后的综合开发利用提供理论参考和依据。
1 材料与方法
1.1 试验材料与仪器
2018年7月雪胆块茎采自云南柯兆生物科技有限公司的雪胆资源圃,其已由云南农业大学杨生超教授鉴定。试验在云南农业大学西南中药材种质创新与利用国家地方联合工程研究中心完成。
所用试剂为α-淀粉酶(Sigma公司)、福林酚试剂、没食子酸标准品、3,5-二硝基水杨酸(DNS)试剂、阿卡波糖,均为国产分析纯。所用仪器为722N型可见分光光度计(上海菁华科技仪器有限公司)、电子天平[赛多利斯(上海)贸易有限公司公司]、RE-52AA型旋转蒸发器(上海亚荣生化仪器厂)、数显恒温水浴锅(上海双捷实验设备有限公司)。
1.2 雪胆多酚的提取及含量测定
将雪胆干燥块茎经过粉碎过筛,通过回流提取获得雪胆多酚提取液。根据Folin-Ciocalte法,在765 nm波长下测定提取液吸光度,建立标准曲线,计算雪胆总多酚浓度。
1.3 雪胆多酚稳定性试验
1.3.1 金属离子的影响 取20 mL多酚提取液加入比色管中,分别加入1、5、10 mg/mL Na+、K+、Mn2+、Cu2+、Zn2+、Mg2+、Fe2+、Al3+、Fe3+溶液 1 mL,每个处理3次重复,放置1 d后于765 nm波长下测定溶液吸光度。
1.3.2 温度的影响 取30 mL多酚提取液加入比色管中,把比色管分别置于25~85 ℃下恒温水浴 5 h,同一温度下每隔1 h测定1次溶液吸光度,计算雪胆总多酚浓度和多酚保存率。
1.3.3 雪胆多酚保存率的计算 根据提取液处理前后的多酚浓度,计算雪胆多酚的保存率,计算公式如下:
1.4 雪胆多酚对α-淀粉酶的抑制作用
1.4.1 α-淀粉酶活性测定 取α-淀粉酶溶液,于37 ℃恒温水浴放置15 min后,添加底物溶液 0.2 mL,混匀后添加 DNS试剂1 mL,于沸水浴中放置5 min,冷却后添加蒸馏水15 mL,于540 nm波长下测定溶液吸光度。同时以磷酸盐缓冲溶液作空白对照。
1.4.2 酶反应动力学进程曲线的建立 分别量取0.1~0.5 mL浓度为1 mg/mL的α-淀粉酶溶液于比色管中。随后将比色管于37 ℃恒温水浴中放置 15 min,添加底物溶液0.2 mL,混勻后添加DNS试剂1 mL,于沸水浴中放置5 min后及时冷却,添加蒸馏水 15 mL,于540 nm波长下测定溶液吸光度。
1.4.3 雪胆多酚对α-淀粉酶的抑制效果 取 1 mg/mL α-淀粉酶溶液0.3 mL,分别添加不同浓度的多酚溶液1 mL。混合液混匀后于37 ℃恒温水浴中放置15 min,添加底物溶液0.2 mL、DNS试剂 1 mL,混匀后沸水浴5 min,及时冷却并添加蒸馏水15 mL,于540 nm波长处测定吸光度;同时磷酸盐缓冲溶液作空白对照,阿卡波糖作阳性对照,每个处理3次重复。计算雪胆多酚对α-淀粉酶的抑制率,公式如下:
1.4.4 雪胆多酚对α-淀粉酶的抑制机制 在底物浓度为0.5%的条件下,按照“1.4.1”节中的方法,以0.5 mg/mL为间隔,在540 nm下测定浓度范围为0.5~2.5 mg/mL内的α-淀粉酶溶液的吸光度,并计算反应初始速率。以α-淀粉酶浓度和反应初始速率为横纵坐标作图,确定雪胆多酚提取液对α-淀粉酶的抑制作用类型(可逆或不可逆)。
1.5 数据处理及分析
以Excel 2013作图分析,数据通过SPSS 20.0进行单因素方差分析(P<0.05)。
2 结果与分析
2.1 建立没食子酸标准曲线
以浓度为0~9 μg/mL没食子酸对应的吸光度绘制标准曲线。标准曲线线性方程:y=0.067 2x-0.062 7(r2=0.999 7)。
2.2 雪胆多酚稳定性分析
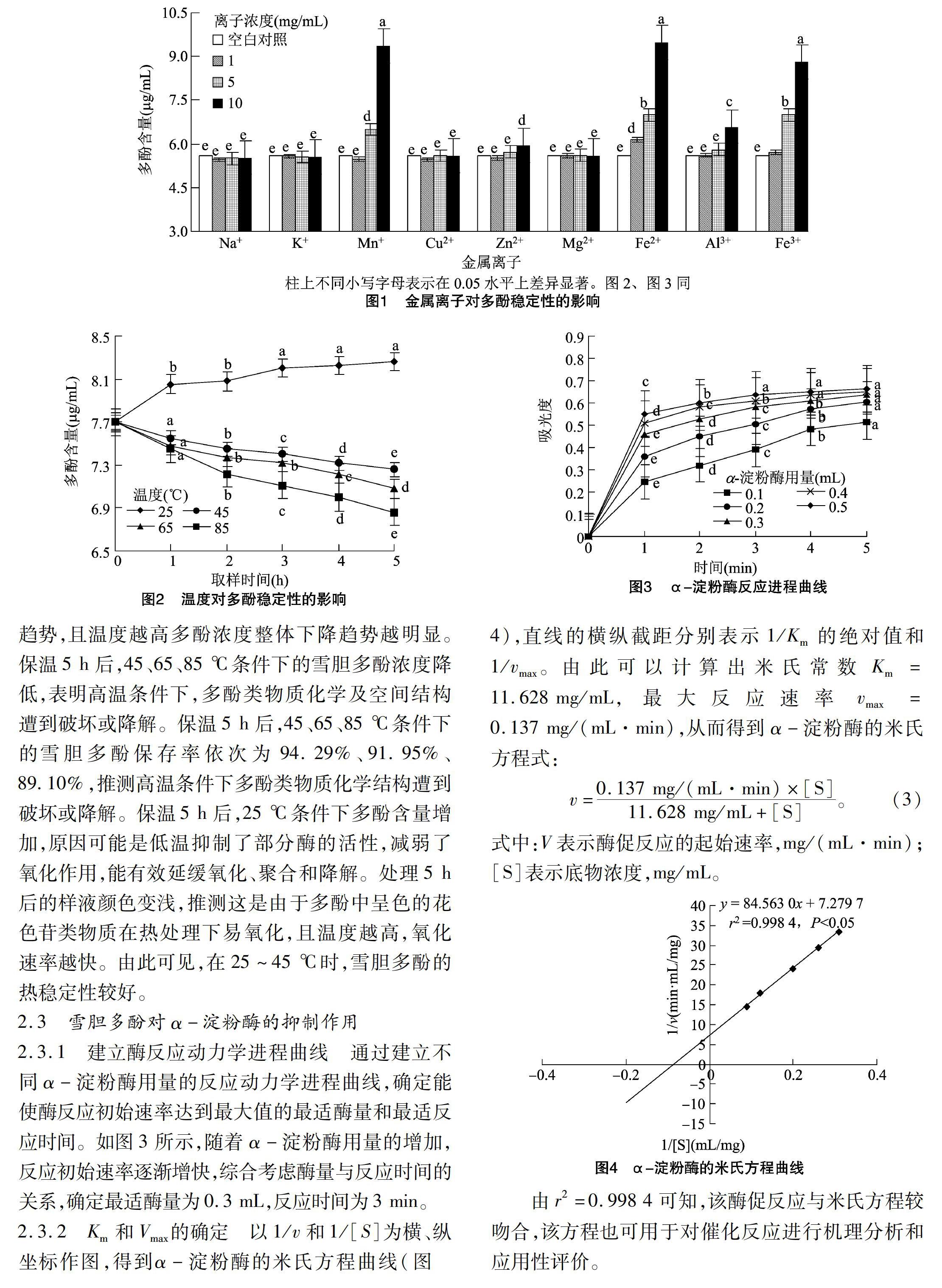
2.2.1 金属离子对多酚稳定性的影响 不同金属离子对雪胆多酚含量影响程度不同。由图1可知,离子浓度的增大使含有不同金属离子样液的多酚含量出现变化,同时样液颜色也有所改变。当雪胆多酚溶液中含有Na+、K+、Mg2+时,其多酚含量和颜色与空白对照组相比无明显差别,可知这3类离子对多酚稳定性几乎无影响。由观察可知,Mn2+对雪胆多酚的影响最为明显,Mn2+加入后,溶液立刻变得浑浊且有絮状沉淀生成。Fe2+、Fe3+分别加入后,溶液逐渐变得浑浊,但无肉眼可见的沉淀产生。图1表明,随Fe2+、Fe3+离子浓度的增大,雪胆多酚含量逐渐增加,其中离子浓度为10 mg/mL时多酚含量的增加最显著,表明高浓度Mn2+、Fe2+、Fe3+可能破坏了雪胆多酚结构;Cu2+加入后,样液颜色明显变化,但Cu2+的加入使多酚浓度减少,表明多酚结构可能被破坏,稳定性受到了影响。因此,雪胆多酚保存时,应尽量避免接触Mn2+、Fe2+、Fe3+、Cu2+。
2.2.2 温度对多酚稳定性的影响 如图2所示,温度对雪胆多酚含量变化有显著影响。温度为45~85 ℃ 时,随加热时间的延长, 多酚浓度整体呈下降
趋势,且温度越高多酚浓度整体下降趋势越明显。保温5 h后,45、65、85 ℃条件下的雪胆多酚浓度降低,表明高温条件下,多酚类物质化学及空间结构遭到破坏或降解。保温5 h后,45、65、85 ℃条件下的雪胆多酚保存率依次为94.29%、91.95%、89.10%,推测高温条件下多酚类物质化学结构遭到破坏或降解。保温5 h后,25 ℃条件下多酚含量增加,原因可能是低温抑制了部分酶的活性,减弱了氧化作用,能有效延缓氧化、聚合和降解。处理5 h后的样液颜色变浅,推测这是由于多酚中呈色的花色苷类物质在热处理下易氧化,且温度越高,氧化速率越快。由此可见,在25~45 ℃时,雪胆多酚的热稳定性较好。
2.3 雪胆多酚对α-淀粉酶的抑制作用
2.3.1 建立酶反应动力学进程曲线 通过建立不同α-淀粉酶用量的反应动力学进程曲线,确定能使酶反应初始速率达到最大值的最适酶量和最适反应时间。如图3所示,随着α-淀粉酶用量的增加,反应初始速率逐渐增快,综合考虑酶量与反应时间的关系,确定最适酶量为0.3 mL,反应时间为3 min。
2.3.2 Km和Vmax的确定 以1/v和1/[S]为横、纵坐标作图, 得到α-淀粉酶的米氏方程曲线(图
4),直线的横纵截距分别表示1/Km的绝对值和 1/vmax。由此可以计算出米氏常数Km=11.628 mg/mL,最大反应速率vmax=0.137 mg/(mL·min),从而得到α-淀粉酶的米氏方程式:
由r2=0.998 4可知,该酶促反应与米氏方程较吻合,该方程也可用于对催化反应进行机理分析和应用性评价。
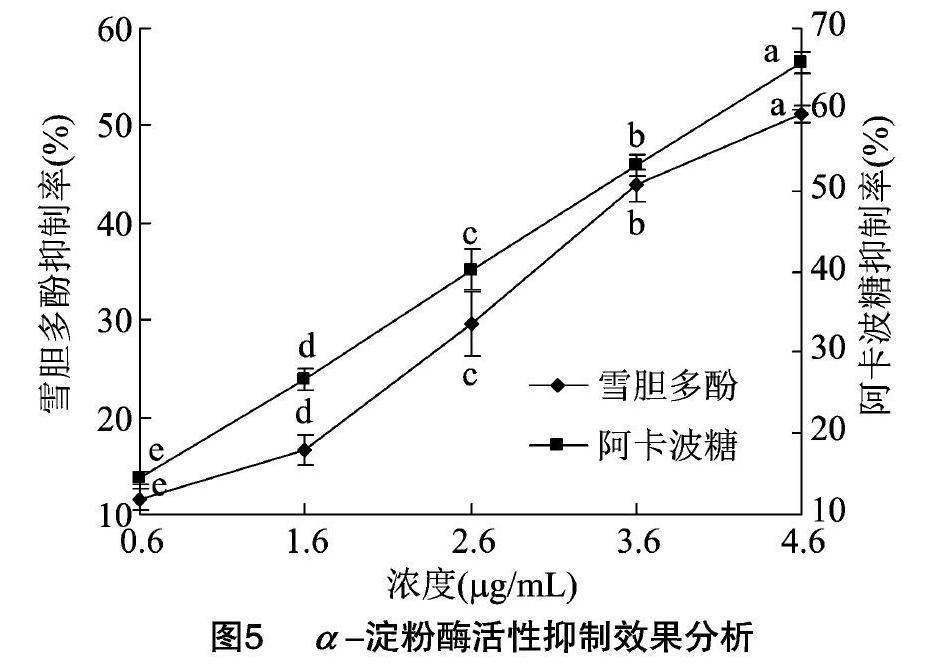
2.3.3 雪胆多酚对α-淀粉酶的抑制效果分析 测定0.60~6.00 μg/mL浓度范围内的雪胆多酚和阿卡波糖对α-淀粉酶活性的抑制作用。由图5可知,随雪胆多酚浓度增大,抑制率呈现上升趋势。
2.4 雪胆多酚对α-淀粉酶的抑制机制分析
2.4.1 抑制类型分析 以酶浓度和反应初始速率为横纵坐标作图,当存在可逆抑制剂时,速率直线过原点且斜率较低;当存在不可逆抑制剂时,速率直线不通过原点;当不存在抑制剂时,速率直线通过原点但斜率大于存在可逆抑制剂。如图6所示,无抑制组直线的斜率大于抑制组直线的斜率且2条直线均通过原点,表明雪胆多酚对α-淀粉酶的抑制类型是可逆性抑制。
2.4.2 可逆性抑制类型分析 以抑制剂浓度和 1/v 為横纵坐标作图,当抑制类型为竞争性抑制时,不同底物浓度所对应直线相交但交点不在横坐标上;而当抑制类型为非竞争性抑制时,两直线相交且交点在横坐标上;当抑制类型为反竞争性抑制时,则不相交。如图7所示,底物浓度分别为0.5%、1.0%的2条直线相交但交点不在横坐标上,说明雪胆多酚对α-淀粉酶活性的可逆抑制属于竞争性抑制。
3 讨论与结论
本研究从资源利用的角度出发,探讨了金属离子、温度对雪胆多酚稳定性的影响。岳鑫的研究表明,温度变化对红松多酚的稳定性有显著影响,并发现红松多酚对光敏感,在金属离子中Fe3+对其的破坏作用最为明显[17]。仇洋发现低温条件对黑果腺肋花楸多酚稳定性有利,同时发现受到Ca2+、Cu2+、K+等6种金属离子影响,黑果腺肋花楸多酚稳定性被破坏,其中Cu2+的破坏作用最大[18]。楠极等在番石榴叶多酚稳定性的研究中表明,Zn2+、Fe2+和Fe3+均会影响多酚提取液的稳定性[19]。马双双等发现莲子壳多酚的稳定性受温度和金属离子的影响,其中Fe3+、Fe2+、Cu2+等6种离子对多酚的稳定性有显著的破坏作用,温度越高,降解程度越强[20]。在苹果果皮和果肉多酚稳定性的研究中,同样发现温度越高,果皮、果肉中的总酚类物质含量越低[21]。由于多酚类物质具有抗氧化性[11]、抗衰老[22]、抑菌性[23]等功效,因此探讨保存温度、金属离子等因素对多酚稳定性的影响,确保能够最大程度地保存雪胆多酚避免损失具有重要意义。
本研究以可溶性淀粉为底物测定雪胆多酚对 α-淀粉酶活性的抑制作用,表明其抑制作用属于可逆性的竞争性抑制类型。在黑果腺肋花楸多酚对 α-淀粉酶的抑制作用研究中,也发现随着多酚浓度的上升抑制率增加,抑制类型属于可逆非竞争性抑制[18]。柳梅等发现以沙棘叶为原料分离纯化得到的提取物对猪胰α-淀粉酶具有一定的抑制作用,其抑制作用属于可逆反竞争性抑制[24]。伍城颖等发现芡种皮多酚提取物对α-淀粉酶的抑制作用与浓度间存在量效关系,抑制类型为可逆性的竞争性抑制[25]。本研究探讨了影响雪胆多酚稳定性的因素,以及对α-淀粉酶活力抑制的动力学研究,为今后雪胆多酚的开发利用提供了理论基础,对于提高雪胆的附加值和雪胆资源的有效利用具有重要意义。
雪胆多酚抗Na+、K+、Zn2+、Mg2+和Al3+的干擾能力强,抗Mn2+、Fe2+、Fe3+和Cu2+的干扰能力较弱,特别是应尽量避免与Mn2+接触;雪胆多酚对温度较为敏感,温度高于45 ℃,随温度升高和加热时间延长,多酚保留率明显下降,25~45 ℃多酚稳定性较好。雪胆多酚具有明显的抑制作用,得到α-淀粉酶的米氏方程为v=0.137 mg/(mL·min)×[S]11.628 mg/mL+[S];雪胆多酚对α-淀粉酶活性属可逆性抑制剂,其可逆抑制类型为竞争性抑制类型。研究结果可为雪胆多酚的保存和加工以及今后的综合开发利用提供理论参考和依据。
参考文献:
[1]李 莹,徐晓婷,郑重飞,等. 雪胆属植物的化学成分及生物活性研究进展[J]. 中草药,2015,46(18):2800-2808.
[2]曾祥飞,张洪武,李国栋,等. 云南雪胆属植物药用资源的初步研究[J]. 中药材,2016,39(5):996-1001.
[3]聂瑞麟,陈宗莲. 雪胆属植物化学研究历史和现状[J]. 云南植物研究,1986,8(1):115-124.
[4]Wang W X,Yang H R,Li Y,et al. Identification of 16,25-O-diacetyl-cucurbitane F and 25-O-acetyl-23,24-dihydrocucurbitacin F as novel anti-cancer chemicals[J]. Royal Society Open Science,2018,5(8):180723.
[5]Xu X T,Bai H,Zhou L,et al. Three new cucurbitane triterpenoids from Hemsleya penxianensis and their cytotoxic activities[J]. Bioorganic & Medicinal Chemistry Letters,2014,24(9):2159-2162.
[6]Boykin C,Zhang G,Chen Y H,et al. Cucurbitacin IIa:a novel class of anti-cancer drug inducing non-reversible actin aggregation and inhibiting survivin independent of JAK2/STAT3 phosphorylation[J]. British Journal of Cancer,2011,104(5):781-789.
[7]任 帅,徐丽慧,曾龙辉,等. 雪胆素乙通过破坏微丝结构和促进p21Cip1表达抑制前列腺癌PC-3细胞的增殖[J]. 中国药理学与毒理学杂志,2012,26(6):835-841.
[8]陈 亮,李医明,陈凯先,等. 植物多酚类成分提取分离研究进展[J]. 中草药,2013,44(11):1501-1507.
[9]Sharma P,de Oca M K M,Alkeswani A R,et al. Tea polyphenols for the prevention of UVB-induced skin cancer[J]. Photodermatology,Photoimmunology & Photomedicine,2018,34(1):50-59.
[10]Chibane L B,Degraeve P,Ferhout H,et al. Plant antimicrobial polyphenols as potential natural food preservatives[J]. Journal of the Science of Food and Agriculture,2019,99(4):1457-1474.
[11]Pandey K B,Rizvi S I. Plant polyphenols as dietary antioxidants in human health and disease[J]. Oxidative Medicine and Cellular Longevity,2009,2(5):270-278.
[12]Bhandari M R,Jong-Aurakkun N,Hong G,et al. α-Glucosidase and α-amylase inhibitory activities of nepalese medicinal herb pakhanbhed (Bergenia Ciliata,Haw.)[J]. Food Chemistry,2008,106(1):247-252.
[13]Shobana S,Sreerama Y N,Malleshi N G. Composition and enzyme inhibitory properties of finger millet (Eleusine coracana L.) seed coat phenolics:mode of inhibition of α-glucosidase and pancreatic amylase[J]. Food Chemistry,2009,115(4):1268-1273.
[14]周子舜,段柯兆,全瑞兰,等. 响应面法优化雪胆多酚提取工艺[J]. 湖北农业科学,2020,59(17):112-118.
[15]邱 磊,张 蓉,赵 艳,等. 雪胆多糖提取工艺优化及其抗氧化活性分析[J]. 南方农业学报,2020,51(8):2020-2027.
[16]高凝轩,李 斌,杜姗姗,等. 黑果腺肋花楸多酚稳定性的研究[J]. 食品科学,2016,37(23):20-24.
[17]岳 鑫. 红松种鳞多酚稳定性及其与乳清蛋白相互作用的研究[D]. 哈尔滨:东北林业大学,2019.
[18]仇 洋. 黑果腺肋花楸多酚的提取纯化及活性研究[D]. 长春:吉林大学,2017.
[19]楠 极,栗丽萍. 番石榴叶多酚提取液稳定性的研究[J]. 食品研究与开发,2016,37(18):32-35.
[20]马双双,刘 莹,陈中惠,等. 老熟莲子壳多酚的树脂法纯化及稳定性研究[J]. 天然产物研究与开发,2014,26(2):238-243.
[21]赵 玉,任亚梅,张 爽,等. 苹果果皮和果肉多酚稳定性研究[J]. 中国食品学报,2014,14(2):93-101.
[22]del Rio D,Rodriguez-Mateos A,Spencer J P,et al. Dietary (poly)phenolics in human health:structures,bioavailability,and evidence of protective effects against chronic diseases[J]. Antioxidants & Redox Signaling,2013,18(14):1818-1892.
[23]Gorzynik-Debicka M,Przychodzen P,Cappello F,et al. Potential health benefits of olive oil and plant polyphenols[J]. International Journal of Molecular Sciences,2018,19(3):686.
[24]柳 梅,任 璇,姚玉軍,等. 沙棘叶多酚提取物抗氧化及体外降血糖活性研究[J]. 天然产物研究与开发,2017,29(6):1013-1019.
[25]伍城颖,吴启南,王 红,等. 芡种皮多酚提取物体外抑制α-葡萄糖苷酶和α-淀粉酶活性研究[J]. 食品工业科技,2015,36(16):91-94,99.

