一致性评价对仿制药发展的影响探究
朱诗宇,文占权*,朱谡,姜晓晴,刘传绪,张彦昭,曹常影(.北京中医药大学管理学院,北京088;.滨州市中医医院,山东 滨州 6600;.中国医学科学院阜外医院,北京 0007;.哈尔滨市卫生监督所,哈尔滨 000;.武汉亚心总医院,武汉 006)
随着相关政策的不断提出,通过一致性评价的仿制药在市场上所占比重越来越大,我国仿制药的研发与供应将受到何种影响,仿制药一致性评价开展对于仿制药的生存将有何改变成为亟待探究的问题。本研究以近年来发布的推进仿制药一致性评价的有关政策为基础,收集了目前仿制药质量和疗效一致性评价的药品批准文号等数据,运用数据分析、风险评估分析方法,分析了政策的制定对仿制药发展的影响,对未来一致性评价工作的趋势进行预测并提出有关建议。
1 仿制药一致性评价政策提出
为了进一步提高药品的安全水平,顺应仿制药质量水平向原研药靠拢的趋势,维护人们的健康,促进医药产业持续健康发展,国家延续上个五年计划对药品安全的发展宗旨于2012年公布《国家药品安全“十二五”规划》,第一次以文件的形式提出了对仿制药一致性评价的要求,为后续政策文件的提出提供了方向与准则。有关仿制药质量和疗效一致性评价的政策文件如表1所示。

表1 近年来有关仿制药质量和疗效一致性评价的部分政策文件[1]Tab 1 Selected policy papers on generic drugs concerning consistency of quality and efficacy[1]
原国家食品药品监督管理局于2013年起正式开始着手对仿制药一致性评价的工作,工作开展初期成效不显著,原因可能是评价机制尚不健全仍需完善。自2015年起,药品医疗器械管理的重心由控制产品质量转换为提升审评审批过程的有效性与便捷性,因此原国家食品药品监督管理局也要求一致性评价加快进程,保证对药品质量控制的同时改善评审的程序与标准。2017—2018年,原国家食品药品监督管理局频繁发布有关仿制药一致性评价的政策推进、技术指导等指示文件,目的在于使仿制药一致性评价工作规范化、效率化,使得工作取得了较大的进展,同时原国家食品药品监督管理局还建立了仿制药一致性评价办公室,为后续工作奠定了基础。
2 一致性评价政策推进期内仿制药的发展情况
2.1 政策推进期的仿制药注册申请情况
虽然政策没有明确给出完成仿制药一致性评价的时间节点,但例如 “纳入国家基本药物目录、临床常用的仿制药在2015年前完成”[2]、“2015—2020年,全面完成基本药物质量一致性审查,开展并完成其他临床常用品种质量一致性评价工作”[3]等对时限作出要求的字句多次出现,因此企业不得不将工作重心转移至一致性评价中来,从而导致市场上仿制药的发展状况有了改变。笔者收集了近年来仿制药临床、生产、上市的注册申请数据,绘制趋势图后发现,政策的修改会影响仿制药的注册申请情况(见图1)。

图1 2013—2018年仿制药注册申请情况[4]Fig 1 Registration status of generic drugs from 2013 — 2018[4]
由图1可知,2013—2018年间仿制药的临床、生产、上市注册申请均有较大波动,其中仿制药临床注册申请数量在2013—2015年有小幅度的上升,造成这种现象的原因可能是国食药监注〔2013〕34号文件中对基本药物目录内的部分药品提出了在2015年基本完成2012—2014年间部署的质量一致性审查工作的要求;而2016年仿制药临床注册出现大幅度增加,可能原因是原国家食品药品监督管理总局2016年第106号提出289种2018年底须完成仿制药一致性评价品种目录(以下简称“289基药目录”),且自某品种仿制药第一次通过一致性评价后,3年后不再受理该品种的一致性评价申请,造成了全国药企扎堆申请一致性评价重新开展临床试验的现象。
与此同时,由于大量仿制药未通过一致性评价而不能上市,仿制药上市注册数量呈现逐年递减的趋势。2018年是2016年后发布政策中反复提及的一致性评价基本完成的最终时限,部分走在评价前列的仿制药得以优先上市,因此2018年度上市注册数量有一定提升。
2.2 仿制药一致性评价进程
2017年12月29日,国家药品监督管理总局药品审评中心(以下简称“CDE”)发布2017年第173号文件《关于发布通过仿制药质量和疗效一致性评价药品的公告(第一批)》,向社会公开发布首批通过质量和疗效一致性评价的13个品种17个品规的仿制药[5],其中有4个品种属于289基药目录,且《中国上市药品目录集》也于当日正式发布。CDE后续还发布了第二批至第四批的过评仿制药情况,后为提高工作效率将所有通过评价的品种导入《中国上市药品目录集》供公众查阅,不再按批进行公示,这也暗示仿制药一致性评价将会是每一种上市仿制药的必经之路。
通过对《中国上市药品目录集》的批准文号进行统计,截至2020年8月31日记录在其中的通过一致性评价仿制药(包括视同通过品种)已达到187个品种270个品规共640个批准文号,其中属于289基药目录的品种为86个品种128个品规共392个批准文号,占所有通过一致性评价仿制药的56.4%,具体情况如表2所示。以上数据可以初步说明在对仿制药质量和疗效一致性评价工作的摸索中,CDE对药品的审评审批效率有所提升。

表2 2017—2020年我国通过一致性评价的药品上市批准文号发放情况(截至2020-08-31)[6]Tab 2 Number of approvals for generic drugs after consistencyevaluation during 2017 to 2020 (until August 31st,2020)[6]
各省(直辖市)通过一致性评价的仿制药数量如图2所示,可以看出近两年的时间内江苏、山东、浙江等省在仿制药一致性评价工作方面给予了更多的投入,这与各省为当地仿制药所营造良好发展环境是分不开的。
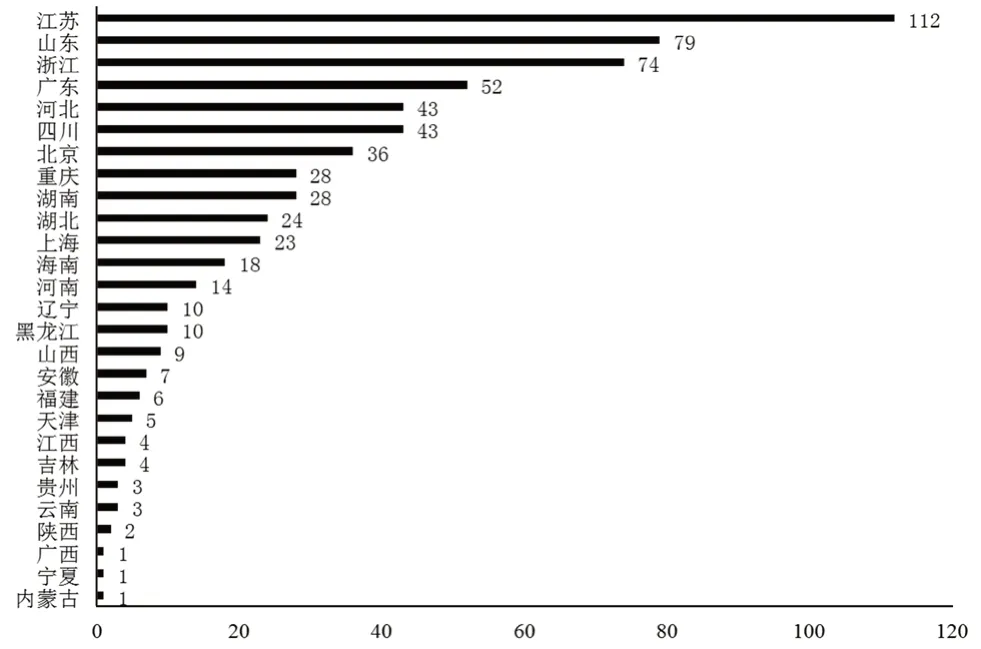
图2 各地通过一致性评价仿制药上市审批生产数量(截至2020-08-31)[6]Fig 2 Marketing approval of generic drugs after consistency evaluation(until August 31st,2020)[6]
2.3 仿制药是否过评的发展差异分析
为响应《关于改革完善仿制药供应保障及使用政策的意见》的号召,各省也公开发布同名政策文件来推进本省的仿制药一致性评价工作,同时根据本省实际情况提出了若干对一致性评价的激励或限制条件。
例如图2中通过一致性评价仿制药上市审批数量靠前的省份均提出了对优先通过一致性评价的品种给予一次性奖补(如江苏、浙江、四川、河北、湖北)、积极将通过一致性评价的仿制药纳入省内药品集中采购范围(如浙江、四川、北京、河北)、鼓励医疗机构优先采购并使用、加快制订医保药品支付标准并对通过一致性评价的仿制药按原研药相同标准支付等激励政策。而未通过一致性评价的仿制药可能会面临暂停挂网采购或不纳入采购范围(如湖北、湖南),甚至是“逾期未完成的,不予再注册”[7],同时在“对于同品种药品通过仿制药质量和疗效一致性评价的药品生产企业达到3家以上的,在药品集中采购等方面不再选用未通过仿制药质量和疗效一致性评价的药品”(如浙江、广东)等限制政策下,未通过一致性评价的仿制药对未来市场份额占据的难度将不断增大。
3 一致性评价对仿制药发展的影响
3.1 通过质量和疗效一致性评价是仿制药发展的必然趋势
参照医药强国美国与日本的发展历史,开展仿制药质量和疗效一致性评价也是国内实现医药高质量发展的必经之路[8]。在一定时限内通过一致性评价是国家对药品质量的进一步要求,也是市场对仿制药提出的现实要求。例如2018年11月15日,上海阳光采购网发布《4+7城市药品集中采购文件》(以下简称《采购文件》),借鉴上海带量采购的经验开始在全国11个城市进行提前试点工作,《采购文件》对申报药品的资格有着明确规定,应属于采购目录范围且满足“通过国家药品监督管理局仿制药质量和疗效一致性评价的仿制药品”[9]的条件,通过这种措施控制群众主要用药渠道的药品质量。因此,在不断完善评价标准、加快审批进程的背景下,仿制药将一改往日的低水平制剂与研发,从而形成与原研药规模相当的精准质量和疗效。
3.2 企业对仿制药一致性评价的消极回应是暂时的
尽管国家药品监督管理局以及各省的(食品)药品监督管理局为仿制药一致性评价的工作开展作出了政策与市场上的倾斜,但仍有一些原因会导致企业开展一致性评价的积极性不高。比如拥有独家品种的企业因其垄断市场的特点而不愿开展一致性评价,王俏瑾等[10]研究发现,289基药目录中独家品种的数量为22种,占目录总数的7.6%,但已启动一致性评价品种仅13种;再比如国家开展药品带量试点采购后对仿制药带来了市场格局的改变,中标的除原研药以外均为通过一致性评价的仿制药,未中标的企业只能选择主动降价,争取试点以外的市场[11],且企业只能选择搁置部分仿制药一致性评价工作,将更多的资金投入到其他产品的生产销售中去。
但不可否认的是,我国自2012年开展仿制药一致性评价以来,相关的评价体系、审批流程、技术支持都取得了明显的进步,CDE根据药品自身特点采取不同的评价方式,并非都采取需要上临床、不确定因素较多的临床有效性试验,目前我国仿制药一致性评价其他常用的方法还包括:视同通过一致性评价、人体生物等效性(BE)试验、豁免BE试验、简化BE试验等[12]。因此在政策的推进与技术的普及之下,我国仿制药一致性评价全面完成指日可待。
3.3 未来我国仿制药质量将充分向原研药靠拢
由于我国早期的仿制药存在低水平的重复[13],仿制药质量一直没有根本的提升,前期对药品的质量管控也仅限于达到GMP的标准,对与原研药同质量及疗效的方面没有过多的控制,而在“十二五”规划期内以及今后的发展中,如何使仿制药质量向原研药看齐成为了工作的主导。
对国家药品监督管理局及各省保障仿制药供应的政策的分析,发现在要求开展一致性评价后,新注册上市的以及完成了一致性评价的仿制药均被给予了与原研药同样的优待,如医保报销支付标准等。胡林峰等[13]认为国家大力鼓励仿制药通过一致性评价是为了促进药物出口,参与国际竞争与合作,以此来实现国内外医药技术与成果的交流,提高国内药企的创新能力;丁锦希等[14]还认为一致性评价结束后,仿制药质量门槛会整体提高,这将倒逼企业提升技术,同样促进仿制药质量发生质的飞跃,进一步向原研药质量靠拢。
4 对仿制药及其一致性评价的建议与展望
我国作为仿制药企业比例达到99%,仿制药比例达到95%[15]的仿制大国,同时也是全球最大的医药消费市场之一,仿制药在我国的发展具有广阔的应用前景,全面完成一致性评价应当作为国家战略强势推进[10]。
4.1 继续完善配套政策,增强对仿制药一致性评价的督促与管理
国家及各省级单位在一致性评价工作开展期间仅采用建议政策的形式,并未提出过相关的法律法规来对评价过程与截止时间作出限制,建议国家尽快出台强制性措施以提升一致性评价的工作效率,为国家管理一致性评价工作提供一定的法律依据,便于解决可能存在的冲突。另一方面,仿制药企业也可以根据法律法规来调整工作程序,在政府的鼓励下积极响应国家对于仿制药一致性评价的号召。
在强制性措施的基础上,相应的管理部门应当对企业一致性评价的各项工作严格把关,从前期的申请资格审查,到中期的一致性评价方法的确定与详细开展,再到最终的评价结果材料审核,层层把关,使仿制药跨过质量与疗效的高墙,不断向同品种的原研药靠拢,从宏观层面上也是对我国由仿制大国向仿制强国转变的推进。
4.2 规范评价内容与流程,形成可作为评价根据的标准体系
从技术层面上来讲,如何开展高效率评价、制定哪些评价指标、指定哪些参比制剂、以什么作为通过评价的标准,这些都是应当为企业或公办及社会办检验机构开展仿制药一致性评价工作而做出的准备。国家应简化一致性评价的工作流程,采取可以降低企业评价成本和风险[12]的评价方法,同时应建立一致性评价中参比制剂的专用数据库,避免企业用错参比制剂,规避风险来提升企业参与评价的积极性。
4.3 加大对过评仿制药的宣传,鼓励公众使用
作为以88%的高比例选择通过一致性评价仿制药的集中采购活动“4+7”带量采购的药品经过一段时间的大面积使用证实了其质量和疗效的稳定性,但目前包括医务人员在内的很多人尚不了解仿制药一致性评价,“4+7”推进过程中也没有大力宣传一致性评价[11],因此公众对过评仿制药的认可度还较低。国家应当对过评仿制药开展一定的宣传推广,充分说明一致性评价对公民用药带来的积极影响,切实发挥过评仿制药与传统仿制药相比的质量优势,真正使我国过渡到生产高质量的仿制药阶段。

