阴道微环境中IL-10通过JAK1/TYK2/STAT3通路对宫颈病变进展机制的研究*
任琛琛,杨 欣,杨 立,李飞燕,朱远航,蒋冬媛,郑娅婷,姬笑影,田 玥
(郑州大学第三附属医院妇产科,郑州 450052)
宫颈癌是全球主要影响女性生殖健康的恶性肿瘤之一,在发展中国家,宫颈癌占世界女性癌症死亡病例的60%以上[1-2]。高危型人乳头瘤病毒(high-risk humanpapilloma virus,HR-HPV)感染是宫颈癌及其癌前病变的主要病因[3-4]。大多数患者感染HPV病毒后,能通过宿主免疫反应清除病毒,而高危型HPV持续存在与宫颈病变的进展密切相关。宫颈暴露于阴道微环境中,阴道局部免疫状态与其转归密切相关[5]。大多数机体抗肿瘤免疫时,细胞免疫为优势应答,而体液免疫可促进肿瘤的发生发展[6]。如果机体的细胞免疫应答受到抑制,向体液免疫细胞漂移,则不利于病毒的清除[7]。推测HPV感染的持续存在与阴道局部体液免疫有密切联系,而IL-10作为体液免疫的主要因子,可能对宫颈病变的发生发展有重要作用。研究表明,IL-10介导的JAK1/TYK2/STAT3通路在细胞增殖、分化和凋亡中起重要作用[8]。但IL-10是否通过此通路影响宫颈病变,目前尚不清楚。本实验旨在研究IL-10在宫颈组织和阴道灌洗液中的表达水平及是否通过JAK1/TYK2/STAT3信号通路对正常宫颈上皮细胞生物学行为产生影响,探讨其影响宫颈病变发生发展的机制。
1 材料与方法
1.1 一般材料 收集2018年12月至2019年6月于郑州大学第三附属医院行手术治疗的宫颈病变患者的宫颈组织120例,其中宫颈低级别鳞状上皮内瘤变(low-squamous intraepithelial lesion,LSIL)30例,高级别鳞状上皮内瘤变(high-squamous intraepithelial lesion,HSIL)30例,宫颈鳞癌(cervical squamous cell carcinoma,CSCC)60例。选取同期因子宫肌瘤并行全子宫切除术患者的宫颈组织30例。收集上述患者术前阴道分泌物、阴道灌洗液及宫颈脱落细胞。对照组、LSIL组、HSIL组、宫颈鳞癌组患者的平均年龄分别为(38±3)岁、(36±5)岁、(39±5)岁、(40±6)岁,四组比较差异无统计学意义。60例宫颈鳞癌患者中I~II期45例,III~IV期15例。LSIL、HSIL及CSCC组纳入标准:临床资料完整;病理明确诊断为LSIL、HSIL或宫颈鳞癌;术前未接受过放、化疗。正常宫颈组纳入标准:因子宫肌瘤行全子宫切除术者;宫颈薄层液基细胞学检查未见异常。所有标本均经本院病理科医师证实,患者均知情同意,经本院医学伦理委员会批准。
1.2 细胞株与试剂 人正常宫颈上皮细胞HcerEpic由其他课题组赠送;Elisa试剂盒购于武汉云克隆公司;IL-10过表达质粒(pcDNA3.1-IL-10)及空载质粒构建由上海吉凯公司完成;DMEM培养基、胰蛋白酶、胎牛血清购于美国Boster公司;TRIzol试剂和Lipofectamine 3000购于美国Invitrogen公司;荧光定量RT-PCR检测试剂盒购于biosharp公司;逆转录试剂盒、PCR SYBR Green试剂盒购于自生工生物工程(上海)股份有限公司;BCA蛋白定量试剂盒、Transewell小室、CCK-8检测试剂盒购于碧云天生物技术研究所;PF06700841购于美国Glpbio公司;一抗购于英国Abcam公司;二抗试剂盒购于北京康为世纪公司。
1.3 患者HPV E6/E7感染及阴道微生态情况 患者入院后收集宫颈分泌物及阴道分泌物,行HPV E6/E7感染检查、阴道微生态环境检查。(1)HPV E6/E7检查。患者取截石位,用专用宫颈刷对宫颈鳞柱状上皮移行处和后穹窿处刷取分泌物与细胞,对宫颈脱落细胞进行HPV E6/E7检测;(2)阴道微生态环境检查。患者取截石位,采集阴道分泌物,统一使用消毒棉签自阴道穹窿后部或阴道内壁处进行取样。排除标准:患者月经期及检查24h内存在性生活、阴道用药史等情况者。检测标本中微生态环境(白细胞、阴道pH值、乳酸杆菌)、细菌性阴道病(bacterial vaginosis,BV)、滴虫性阴道炎(trichomonal vaginitis,TV)、外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC)。上述任何1项异常,均可诊断为微生态失衡[9],计算阴道微生态失衡率。
1.4 实验方法
1.4.1 ELISA实验分析阴道灌洗液中IL-10表达水平 充分暴露患者阴道及宫颈,用无菌生理盐水冲洗宫颈阴道部与阴道壁上1/3处3次,用专用试剂管于阴道后穹窿吸取灌洗液3mL,室温离心5min,取上清分装并置于-80℃冰箱备用,标本不能混有血液。按IL-10检测试剂盒(SEA056Hu 96T)说明书进行操作,在酶标仪上读出各个孔相对应的OD450值。结果判读:每个标准品和标本的OD值应减去空白孔的OD值;以不同浓度的标准品所对应的OD450值作为纵坐标,以标准品浓度作为横坐标,用软件绘制标准曲线,求出相应的位置样本中IL-10含量。
1.4.2 免疫组化法分析宫颈组织中IL-10表达水平 按说明书进行操作。参照Mattern等[10]方法进行判定:随机选择10个高倍视野,以细胞浆或细胞核出现棕褐色为阳性细胞。染色深度:未见染色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比:未见染色为0分,染色细胞小于25%为1分,25%~50%为2分,>50%为3分。两方面得分相加,0~2分判为阴性表达,>2分判为阳性表达。
1.4.3 细胞培养和转染 人宫颈上皮细胞Hcerepic用DMEM高糖培养基置于37℃、5% CO2培养箱培养。每隔1d更换新鲜的培养液,待细胞融合达到约80%时,传代培养,取对数增殖期细胞进行后续实验。将Hcerepic细胞按5×105细胞/孔接种于6孔板,置37℃培养箱继续培养,待细胞贴壁后,按Lipofectamine 3000转染试剂说明书进行转染。转染率大于80%即为转染成功[11]。PF06700841为JAK1和TYK2的抑制剂。转染携带IL-10质粒的细胞记为IL-10组,转染携带空质粒的细胞记为载体对照组,加有抑制剂组为IL-10+PF06700841组。抑制剂PF06700841作用浓度确定:将不同浓度PF06700841(0nmol/L,5nmol/L,10nmol/L,15nmol/L,20nmol/L,25nmol/L,30nmol/L,50nmol/L)加过表达IL-10的宫颈上皮细胞,采用CCK-8分别在0h、12h、24h、48h检测细胞活力。结果显示,PF06700841抑制效率具有时间依赖性,随着时间延长抑制效率增加,但在24h稳定在最大抑制水平,此时半数抑制浓度为20nmol/L。
1.4.4 实时荧光定量PCR 消化离心收集实验组和对照组细胞,加1mL RNAiso Plus提取液提取总RNA,按试剂盒说明书操作,得到RNA用DEPC水溶解后,检测浓度和纯度。按逆转录试剂盒说明书逆转录,立即进行实时荧光定量PCR反应,采用20μL体系,反应条件为95℃预变性5min,95℃变性10s,60℃退火30s,40次循环,以GAPDH作为内参基因,按2-ΔΔCT计算两组细胞表达的变化量。IL-10引物序列:F:GGAGGAGGTGATGCCCCAAG;R:ATCGATGACAGCGCCGTAG;GAPDH引物序列:F:CCTTCCGTGTCCCCACT;R:GCCTGCTTCACCACCTTC。
1.4.5 细胞划痕实验 将消化对数期生长的HcerEpic细胞按5×105细胞/孔接种于6孔板。待细胞均匀长满6孔板底部时,用200μL枪头垂直6孔板底部划线,枪头垂直,不倾斜,PBS清洗2次,加无血清培养基继续培养。分别于0h、24h、48h在显微镜下拍照。
1.4.6 Transwell实验 分别取各组HcerEpic细胞,消化后收集,用培养基重悬成单细胞悬液。小室中加含2×105细胞/孔的无血清单细胞悬液200μL,下室加650μL 15%培养基,置37℃含5%CO2培养箱中继续培养48h,4%多聚甲醛固定15min,0.1%的结晶紫染色30min,PBS洗涤2次,自然风干后在显微镜下拍照。
1.4.7 CCK-8法 转染前24h,各组细胞胰酶消化,按2000细胞/孔接种至96孔板,每组设5个复孔,置37℃含5%CO2培养箱继续培养,设24、48、72、96h 4个时间点,每孔加10μL CCK-8溶液,继续培养,3h后取出,用酶标仪比色,检测波长450nm处吸光度,收集数据并统计分析。
1.4.8 Western blot实验 IL-10基因转染HcerEpic细胞后,收集各组细胞,按说明书提取总蛋白,BCA试剂盒测蛋白浓度。蛋白热变性后进行10%SDS-PAGE电泳,每孔蛋白上样量5μg,转膜,5%脱脂奶粉室温封闭2h,孵育一抗,4℃过夜,次晨复温,TBST洗膜4次,每次10min。摇床上常温孵育二抗1h,TBST洗膜4次,每次10min,ECL化学发光显影,用Image J计算灰度。

2 结 果
2.1 各组HPV E6/E7感染、阴道微生态及阴道灌洗液IL-10浓度情况 各组分泌物阴道微生态分布见表1。随着宫颈病变程度的加重,HPV E6/E7阳性率、阴道微生态失衡率及阴道灌洗液中IL-10浓度升高。阴道微生态失衡与阴道灌洗液中IL-10浓度呈正相关(r=0.575,P<0.001)。见表2。

表1 各组分泌物阴道微生态分布[n(%)]
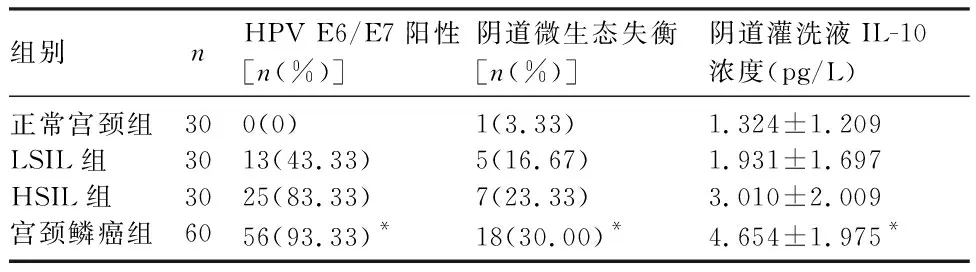
表2 各组HPV E6/E7感染、阴道微生态及阴道灌洗液IL-10浓度情况比较
2.2 IL-10在组织中的表达 宫颈组织中IL-10染色为棕褐色颗粒,多数位于细胞质,少数位于细胞核(图1)。IL-10在正常宫颈组织、LSIL、HSIL、宫颈鳞癌组织中阳性表达率分别为16.67%、40%、70%和90%,四组比较差异有统计学意义(χ2=52.736,P<0.001)。组间两两相比:宫颈鳞癌组阳性率高于HSIL组(χ2=5.760,P<0.05),HSIL组高于LSIL组(χ2=5.455,P<0.05),LSIL组高于正常宫颈组(χ2=4.022,P<0.05)。
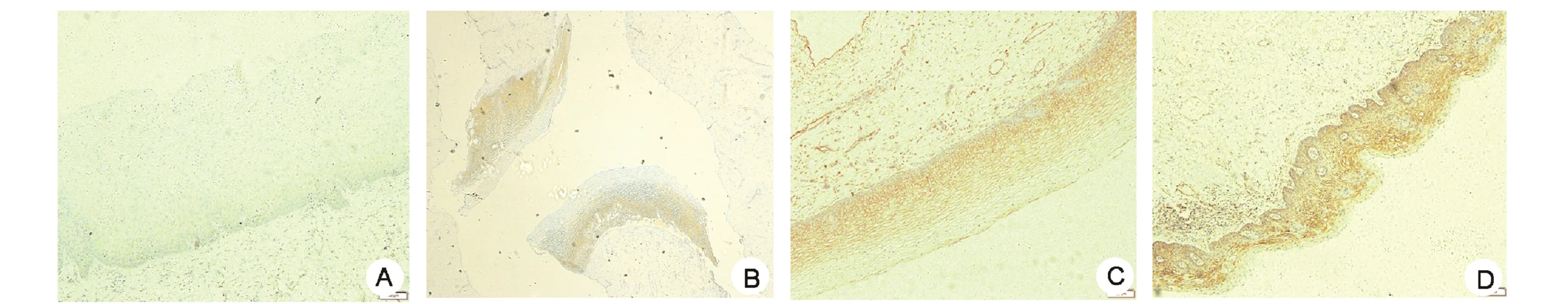
图1 免疫组化检测IL-10表达(×40)
2.3 HcerEpic细胞转染后IL-10的表达水平 荧光显微镜下观察,转染后HcerEpic细胞中大量表达绿色荧光蛋白,转染率均>90%。qRT-PCR检测结果显示,与载体对照组(0.846±0.134)相比,转染后IL-10 mRNA表达(537.161±56.117)显著提高(t=16.547,P=0.004)。
2.4 细胞增殖情况 CCK-8实验结果显示,转染后第24、48、72h,与载体对照组及IL-10+PF06700841组相比,IL-10组细胞的增殖活性明显增强(P<0.05);载体对照组与IL-10+PF06700841组比较,差异无统计学意义(P>0.05)(表3)。

表3 各组HcerEpic细胞增殖活性的比较
2.5 细胞迁移及侵袭情况 细胞划痕及Transwell实验结果显示,与载体对照组相比,IL-10组细胞划痕愈合速度加快,细胞侵袭数量显著增多。IL-10+PF06700841组愈合速度慢于IL-10组,细胞侵袭数量少于IL-10组。见图2、3。

图2 划痕实验观察各组细胞体外侵袭、迁移能力(×40)
2.6 细胞中通路蛋白表达情况 与载体对照组相比,IL-10组中JAK1、TYK2、STAT3、MMP-9蛋白表达水平均显著升高(均P<0.05);与IL-10组相比,IL-10+PF06700841组中STAT3、MMP-9蛋白表达水平显著降低(均P<0.05);IL-10+PF06700841组与载体对照组的STAT3、MMP-9蛋白表达差异无统计学意义(P>0.05),见图4。

图3 Transwell体外侵袭实验观察细胞体外侵袭能力(×400)

图4 过表达IL-10及PF06700841对通路蛋白的影响
3 讨 论
宫颈癌是最常见的女性生殖道恶性肿瘤,发病率在女性恶性肿瘤中居第二位,在某些发展中国家甚至位居首位[12],是危害我国女性健康与生命的重要疾病,从分子水平揭示其侵袭转移机制具有重要意义。细胞因子IL-10是一种重要的抗炎因子,可由多种细胞产生,如淋巴细胞、巨噬细胞等免疫细胞,在阴道局部微环境中可由宫颈上皮细胞和肿瘤细胞产生,也可由HR-HPV感染后刺激产生[13]。本研究表明,IL-10表达的阳性率随着宫颈病变进展逐渐增高,提示IL-10在宫颈病变的发展过程中起促癌作用,这与薛旻等[14]研究结果相一致。
本课题组前期研究发现,HPV E6/E7阳性患者阴道灌洗液中IL-10水平升高,提示阴道局部免疫状态与宫颈癌的发生发展过程有密切关联[5]。本研究结果表明,HPV E6/E7阳性,即高危型HPV病毒持续感染的患者,阴道局部微生态失衡率较HPV E6/E7阴性患者升高,且阴道灌洗液中IL-10浓度与阴道微生态失衡呈正相关。提示阴道微环境中的IL-10因子为HPV感染提供了易感的微生态环境,从而引发宫颈病变的发生。但本研究样本量少,且相关系数与预期结果有一定差距。
IL-10与多种肿瘤,如胃癌、结肠癌、乳腺癌、胰腺癌等相关,其在宫颈病变的发生发展中同样起到了重要作用[15]。JAK1/TYK2/STAT3通路是重要的信号转导通路,此信号通路的持续激活可导致细胞异常增殖和恶性转化[16],在这个通路中,JAK上游信号的持续激活是STAT3持续表达的主要机制,而STAT3已被确认为癌基因,其过度激活增强了EMT、肿瘤血管生成、ECM降解等多个环节的发生,从而促进了肿瘤的侵袭和转移。此外,STAT3的激活能诱发与慢性炎症有关的细胞因子、趋化因子和其他介质的表达和释放,这些炎症介质在诱导和维持促癌炎症环境中起着关键作用[17]。Chen等[18]研究表明,STAT3在宫颈癌细胞系HeLa和SiHa细胞中异常活化,表明STAT3信号通路在宫颈癌的发生、发展中具有一定的作用。本研究结果显示,IL-10可促进正常宫颈上皮细胞增殖、迁移及侵袭,JAK1、TYK2、STAT3及下游与细胞侵袭相关的MMP-9在IL-10过表达组细胞中高表达,而加JAK1/TYK2抑制剂PF06700841后,IL-10的作用被阻断。表明IL-10通过JAK1/TYK2/STAT3通路影响宫颈病变的进展。
综上所述,阴道微环境中的IL-10因子为HPV感染提供了易感的微生态环境,IL-10可通过激活JAK1/TYK2/STAT3通路上调MMP-9表达,从而促进宫颈细胞增殖、迁移、侵袭,加速向宫颈病变趋势发展的进程。今后,基于IL-10/JAK1/TYK2/STAT3细胞信号动态网络的肿瘤机制研究和药物设计是值得思考的方向之一,控制阴道微生态平衡及抑制宫颈组织IL-10的分泌在阻断宫颈病变发展及宫颈癌的靶向治疗中可能具有重要价值。

