OCTA评估抗VEGF治疗老年性黄斑变性患者视网膜血流密度变化
陈开传,盛敏杰,李 敏,李 婧,李 冰
(1.同济大学附属杨浦医院眼科,上海 200090;2.复旦大学附属中山医院眼科,上海 200032)
老年性黄斑变性(age-related macular degene-ration,AMD)是导致老年人视力受损和致盲的最主要原因之一,遗传因素、吸烟史、视网膜慢性光损伤以及营养摄入不良等都是导致AMD发生的危险因素[1]。根据临床表现,AMD可分为萎缩性(干性)和渗出性(湿性)两种类型,其中湿性AMD(wet age-related macular degeneration,wAMD)常造成不可逆性视力丧失[2-3],其特征是黄斑区出现脉络膜新生血管(choroidal neovascularization,CNV),进而导致黄斑区发生出血、渗出、机化和瘢痕形成等一系列病理改变[4]。
近年来,玻璃体腔注射抗血管内皮生长因子(vascular endothelial growth factor,VEGF)已成为wAMD治疗的一种新方法[5-6]。雷珠单抗作为一种临床上常用的VEGF抑制剂,可以渗透至视网膜全层,结合并抑制VEGF活性异构体及其代谢产物,安全有效[7]。然而,多项研究发现抗VEGF药物尽管可有效延缓疾病进展、改善视力,但疗效维持时间短,需多次眼内注射[8]。
光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)是一种无创、快速获得视网膜和脉络膜血管图像的新方法,能够提供不同层面生理或病理血管的大小、结构、位置的高分辨率三维图像,为视网膜和脉络膜血管性疾病提供更清晰和深入的可视化分析[9-10]。相比于传统的荧光素眼底血管造影(fluorescein fundus angiography,FFA)和吲哚菁绿血管造影(indocyanine green angi-ography,ICGA)检查方式,OCTA可避免造影剂给患者带来的不良反应及潜在风险[11]。因此,本研究采用OCTA方法评估雷珠单抗玻璃体腔注射3次+必要时(3+PRN)方案治疗wAMD的疗效,以期为wAMD的抗VEGF治疗方案的优化提供理论依据。
1 资料与方法
1.1 一般资料
选取2018年6月—2021年1月同济大学附属杨浦医院眼科收治的50例wAMD患者眼底影像资料进行回顾性分析,符合以下列纳排标准者纳入本研究。纳入标准:(1) 患者自觉有明显视力下降和视物变形;(2) 通过FFA检查确诊的新发wAMD;(3) OCT测量黄斑中心凹0.5 mm和1 mm 视网膜厚度增加及中心凹消失或变浅。排除标准:(1) 既往存在其他类型的黄斑部病变;(2) 有青光眼病或其他黄斑异常病史;(3) 已接受视网膜激光光凝治疗;(4) 既往接受过抗新生血管药物治疗;(5) 有其他严重影响视力的眼部疾病等。
1.2 治疗方法
所有纳入本研究的患者,术前3 d均给予0.5%左氧氟沙星滴眼液点眼,4次/d。术前冲洗泪道和结膜囊,碘伏常规消毒铺巾,表面麻醉;聚维酮碘黏膜冲洗液在结膜囊内停留至少1 min,然后用生理盐水冲洗结膜囊。采用距角膜缘3.5 mm处颞上方或鼻上方睫状体平坦部垂直进针,玻璃体腔内注入雷珠单抗(瑞士Novartis Pharma Stein AG,注册证号S20170003,规格:0.05 mL)0.5 mg。所有AMD患者均完成3次雷珠单抗注射。
1.3 随访及评估方法
患者在治疗前,治疗后第1、3个月进行门诊随访。治疗前均行视力、直接检眼镜检查、眼底照相、OCT、OCTA和眼底血管造影检查;治疗后1、3个月行视力、眼底镜、眼压、眼底照相、OCT及OCTA检查。国际标准视力表检查随访患者的最佳矫正视力(best corrected visual acuity,BCVA),均以最小分辨角对数(logMAR)记录;采用光学相干断层成像技术(optical coherence tomo-graphy,OCT)检测黄斑中心凹厚度、500 μm和1 000 μm 处视网膜4个方位(颞侧、鼻侧、上方和下方)的厚度变化;使用OCTA检测视网膜浅层毛细血管密度( superficial retinal capillary plexus,SCP)、深层毛细血管密度(deep retinal capillary plexus,DCP)和黄斑中心凹无血管区(foveal avascular zone,FAZ)的变化,并记录术后并发症情况。
OCTA检查采用AngioVue OCT系统(美国Optovue公司)进行,检查时所有受试者均取舒适坐位,前额与下颌分别置于前额托和下颌托,嘱受试者扫描眼注视前方目镜中蓝色光点3 s以上,尽量避免眨眼或头位偏移,选择OCT Radial Lines平扫模式和OCTA HD Angio Retina 6.0 mm的血流成像模式,对焦后扫描,扫描范围为黄斑区6 mm×6 mm,每个区域扫描2次,保留清晰度最高的图片,采用设备自带软件系统进行图像分析,该仪器可自动生成4个层面的黄斑血流密度图像,依次为表层视网膜(为内界膜至内丛状层外界)、深层视网膜(为内丛状层外界至外丛状层后外界)、外层视网膜(为外丛状层外界至RPE)及脉络膜毛细血管层(为Bruch膜以下10~20 μm),见图1。观察者可手动调整分层线,直至获得理想的图像信息,阅片由2名医师独立完成。

图1 视网膜血管密度和黄斑中心凹无灌注区治疗前与治疗后变化Fig.1 The changes of retinal vascular density and macular fovea non perfusion area before and after treatmentA:治疗前的视网膜浅层血管密度;B:治疗后1个月的视网膜浅层血管密度;C:治疗后3个月的视网膜浅层血管密度;D:治疗前的视网膜深层血管密度;E:治疗后1个月的视网膜深层血管密度;F:治疗后3个月的视网膜深层血管密度;G:治疗前的黄斑中心凹无灌注区面积;H:治疗后1个月的黄斑中心凹无灌注区面积;I:治疗后3个月的黄斑中心凹无灌注区面积
1.4 统计学处理

2 结 果
2.1 患者一般情况
本研究共纳入50例wAMD患者,其中男性30例,女性20例,年龄61~91岁;患者病程4~13个月。治疗中及随访过程中,均无患者发生不良反应,见表1。

表1 纳入研究患者的基线资料Tab.1 Baseline data of patients were included in the study
2.2 “3+PRN”治疗后BCVA水平变化
采用单因素重复测量方差分析方法,判断抗VEGF治疗对患者视力的影响。经Mauchly’s球形假设检验,因变量的方差协方差矩阵不相等,χ2=10.179,P=0.006,通过Greenhouse-Geisser方法校正ε=0.840。主体内效应为F=8.622,P=0.001;主体间效应为F=8 147.687,P=0.000。患者治疗前、治疗后1个月和治疗后3个月的LogMAR视力分别为(4.13±0.40)、(4.30±0.31)和(4.19±0.40)。治疗前-治疗后1个月的95%CI为(-0.239,-0.105),治疗前-治疗后3个月的95%CI为(-0.159,0.039)。与治疗前相比,治疗后1个月的BCVA差异具有统计学意义(P<0.000 1),治疗后3个月差异无统计学意义[F(1.679,82.678)=8.622,P=0.001,偏η2=0.150]。
2.3 “3+PRN”治疗后视网膜厚度变化
采用单因素重复测量方差分析方法,判断抗VEGF治疗对患者视网膜厚度的影响。以黄斑中心凹为例,经Mauchly’s球形假设检验,因变量的方差协方差矩阵不相等,χ2=11.813,P=0.003,通过Greenhouse-Geisser方法校正ε=0.821。患者治疗前、治疗后1、3个月的视网膜厚度分别为(358.86±118.76)μm、(263.95±79.12)μm和(258.10±90.81)μm。与治疗前相比,治疗后第1、3个月视网膜厚度均显著减小,差异有统计学意义(P<0.001)[F(1.642,80.449)=654.514,P=0.000,偏η2=0.424],见表2、3。

表2 各方位的视网膜厚度比较Tab.2 Comparison of retinal thickness in different positions

表3 视网膜厚度的单因素重复测量方差分析结果Tab.3 One-way repeated measure ANOVA results of retinal thickness
2.4 “3+PRN”治疗后视网膜深浅层血管密度变化
采用单因素重复测量方差分析方法,判断抗VEGF治疗对患者视网膜血流密度的影响。以浅层视网膜为例,经Mauchly’s球形假设检验,因变量的方差协方差矩阵相等,χ2=1.268,P=0.530。患者治疗前、治疗后1、3个月的血流密度分别为(44.14±4.26)%、(45.35±4.92)%和(44.70±4.76)%。与治疗前相比,治疗后1个月的血流密度具有统计学意义(P<0.05),治疗后3个月无统计学意义[F(2,98)=2.258,P=0.110,偏η2=0.044];同时,患者深层视网膜治疗前、治疗后1、3个月的血流密度分别为(43.58±5.09)%、(45.04±4.45)%和(44.14±4.50)%,与治疗前相比,治疗后1个月的血流密度具有统计学意义(P<0.05),治疗后3个月差异无统计学意义,见表4。

表4 两层视网膜血管密度的单因素重复测量方差分析结果Tab.4 One-way repeated-measure ANOVA results of two-layer retinal vascular density
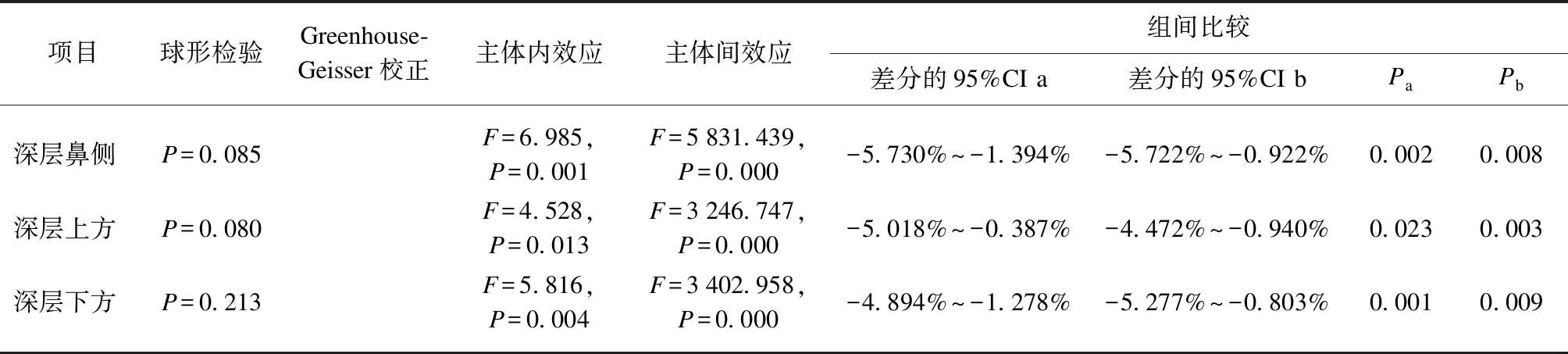
2.5 “3+PRN”治疗后视网膜不同位置深浅层血管密度变化
采用单因素重复测量方差分析方法,判断抗VEGF治疗对患者视网膜各位点血管密度的影响。以深层黄斑中心凹血管密度为例,经Mauchly’s球形假设检验,因变量的方差协方差矩阵相等,χ2=0.240,P=0.887。患者治疗前、治疗后1、3个月的血管密度分别为(44.12±7.31)%、(46.70±4.82)%和(45.58±4.80)%。与治疗前相比,治疗后1个月的深层中心凹血管密度具有统计学意义(P<0.05),治疗后3个月无统计学意义[F(1.990,97.514)=4.383,P=0.035,偏η2=0.066],见表5、6。

表5 各位点的视网膜血管密度比较Tab.5 Comparison of retinal vascular density at each point

表6 视网膜各方位血管密度的单因素重复测量方差分析结果Tab.6 One-way repeated measure ANOVA results of retinal vascular density at all locations
续表
2.6 黄斑中心凹无血管区面积变化
采用单因素重复测量方差分析方法,判断抗VEGF治疗对患者FAZ面积的影响。经Mau-chly’s球形假设检验,因变量的方差协方差矩阵相等,χ2=0.458,P=0.795。主体内效应为F=4.383,P=0.015;主体间效应为F=292.812,P=0.000。患者治疗前、治疗后1个月和治疗后3个月的FAZ面积分别为(0.99±0.50) mm2、(0.80±0.38) mm2和(0.94±0.51) mm2。治疗前-治疗后1个月的95%CI为(0.059,0.322) mm2,治疗前-治疗后3个月的95%CI为(-0.087,0.193) mm2。与治疗前相比,治疗后1个月的FAZ面积具有统计学意义(P<0.01),治疗后3个月无统计学意义[F(2,98)=4.383,P=0.015,偏η2=0.082]。
2.7 视网膜血管密度、BCVA、FAZ和视网膜厚度之间的相关性
相关分析发现,浅层血管密度与BCVA呈显著正相关(P<0.05,图2A);深层血管密度与BCVA呈显著正相关(P<0.05,图2B);浅层血管密度与深层血管密度呈显著正相关(P<0.05,图2C);深层血管密度与距中心凹鼻侧0.5 mm处的视网膜厚度呈显著负相关(P<0.05,图2D);深层血管密度与距中心凹鼻侧1 mm 处的视网膜厚度呈显著负相关(P<0.05,图2E);FAZ与距中心凹颞侧1 mm处的视网膜厚度呈显著负相关(P<0.05,图2F);FAZ与距中心凹鼻侧0.5 mm处的视网膜厚度呈显著负相关(P<0.05,图2G);FAZ与距中心凹上方1 mm处的视网膜厚度呈显著负相关(P<0.05,图2H);FAZ与距中心凹下方1 mm处的视网膜厚度呈显著负相关(P<0.05,图2I)。

图2 治疗后1个月与治疗前的指标相关性分析Fig.2 Correlation analysis of indicators 1 month after treatment and before treatmentA:浅层血管密度差(ΔSCP)与最佳矫正视力差(ΔBCVA);B:深层血管密度差(ΔDCP)与ΔBCVA;C:ΔSCP与ΔDCP;D:ΔDCP与中心凹鼻侧0.5 mm处视网膜厚度差(ΔN1);E:ΔDCP与中心凹鼻侧1 mm处视网膜厚度差(ΔN2);F:中心凹无灌注区面积差(ΔFAZ)与中心凹颞侧1 mm处视网膜厚度差(ΔT2);G:ΔFAZ与ΔN1;H:ΔFAZ与中心凹上方1 mm处视网膜厚度差(ΔS2);I:ΔFAZ 与中心凹下方1 mm处视网膜厚度差(ΔI2);各视网膜位点和FAZ的Δ值等于治疗前与治疗后1个月视网膜厚度的差值,BCVA和血管密度的Δ值等于治疗后1个月与治疗前的差值
3 讨 论
目前,大多观点认为脉络膜新生血管形成是wAMD发病的主要因素,局部注射靶向VEGF的单克隆抗体可减少AMD患者新生血管形成,延缓疾病进程[12-13]。雷珠单抗是第二代人源化的抗VEGF单克隆抗体,由于相对分子质量较小,可高效穿透视网膜,提高生物利用度,通过同时作用于多个VEGF亚型及其降解产物来抑制新生血管生成、减轻黄斑水肿和视网膜渗出,从而稳定甚至提高患者的视力,同时具有较高的安全性和有效性[14-15]。眼部给药方案和抗VEGF化合物的全身毒性是人们关注的焦点[16],而本研究随访过程中所有患者均无不良反应发生。
早期研究发现,“3+PRN”方案比“1+PRN”方案在延长给药间隔、改善患者视力、减少视网膜中央厚度等方面具有一定优势[17]。与之前结果相类似,本研究采用OCT对wAMD患者视网膜中心凹及颞侧、鼻侧、上方和下方0.5 mm及1 mm处进行扫描发现,治疗后视网膜厚度与治疗前相比明显减小,BCVA显著提高,说明采用“3+PRN”方案行玻璃体内注射抗VEGF药物治疗wAMD具有很好效果;与之前研究不同之处在于,研究通过OCTA技术分别在治疗后第1和第3个月时进行疗效观察,结果发现视网膜厚度在治疗后3个月的下降趋势不如治疗后1个月的下降趋势明显,而且治疗后第3个月时患者BCVA的改善程度不如治疗后第1个月。有研究发现,抗VEGF治疗常需维持数月或数年,治疗暂停或中断可能会导致新生血管复发[16]。本研究通过对比第1和第3个月的治疗结果发现,“3+PRN”方案在治疗后1个月效果最明显,停药3个月时存在复发风险。
自OCTA成像技术发明以来,出现了许多关于AMD患者的OCTA影像学研究。Toto等[18]通过OCTA检查对早、中、晚期的AMD患眼和正常眼的视网膜毛细血管密度进行了比较,发现浅表和深部的视网膜血管丛在晚期的AMD患者中都发生了改变;另一研究者通过OCTA观察了wAMD患者,发现OCTA对wAMD患者的CNV结构具有良好的分辨率,并且可以从横断面上对CNV的各方位进行观察并分型。研究者观察了5例wAMD患者,发现CNV的病灶大小和血流密度成正相关,Ⅱ型CNV的血流密度明显高于Ⅰ型和混合型CNV的血流密度[19-20]。说明在wAMD患眼中,OCTA可观察到更深层次眼底血管的出现和眼底血管丛的缺失。Moult等[21]和Jia等[22]的研究也发现,相比传统的FFA,OCTA受到视网膜下出血的遮蔽更少。因此,OCTA成像技术可以提供更清晰的血管细节,可以更好地对wAMD患者的CNV病灶进行检测和量化。
一项前瞻性研究发现,治疗后BCVA水平和基线时血管密度相关[23]。Marques等[24]通过对10只AMD患眼治疗前后的OCTA图像观察分析发现8只患眼治疗后7 d时毛细血管减少,血管密度显著降低,大血管无明显变化,而在治疗后1个月时毛细血管再次增多,血管密度增高,与本研究在治疗1个月时的表现相似。Suzuki等[25]的研究结果更为积极,其发现抗VEGF药物治疗能改善视网膜血流,尤其在视网膜深层毛细血管丛,与本研究结果相似。本研究发现,治疗后1个月与治疗前相比,视网膜浅、深层血管密度均显著增加,治疗后3个月与治疗前相比,视网膜浅、深层血管密度无明显变化。说明“3+PRN”方案对于wAMD患者视网膜血管密度恢复具有短暂的治疗效果,但抗VEGF药物对远期视网膜毛细血管密度下降的治疗效果并不理想,存在复发风险,结果支持每月打1针的频率,对于预后有正面作用。
相关性分析发现,与治疗前相比,治疗1个月后患者的视网膜深层和浅层血管密度呈显著正相关,可能与视网膜复杂的血管网有关,视网膜毛细血管网由不同轴向水平排列的浅层、深层及脉络膜毛细血管丛组成[26]。浅表血管丛内的血压可自动调节,同时也会间接地影响深血管丛的血流,因为深层毛细血管的血流来自于视网膜内部的末端小动脉,而浅血管丛的血流来自于周围的毛细血管,并且与深层血管丛的小血管相贯通,这说明浅血管丛可供应深血管丛[27]。分析结果可得,浅层和深层的血管密度在视网膜血流中占有重要作用,且其血流灌注改善可提高患者的视觉功能。
早期研究发现,毛细血管密度与视网膜厚度相关,尤其是浅表的血管密度[28-29]。相关性分析发现距中心凹鼻侧0.5 mm和1 mm处的视网膜厚度下降越明显,视网膜深层血流恢复越显著,说明视网膜水肿吸收可促进视网膜深层血流恢复。因此,本研究认为抗VEGF药物促进了视网膜厚度的降低,改善了部分方位的视网膜微血管密度。由此可知,视网膜厚度可能是导致微血管密度发生改变的重要因素,应引起重视。既往研究发现,视网膜深层毛细血管层的血流密度远远大于视网膜浅层毛细血管层[30]。这提示视网膜深层毛细血管层对于抗VEGF药物治疗可能更敏感。进一步分析了视网膜不同位点的血管丛变化,所有位点的深层血管密度,在治疗后1个月均显著改善,术后3个月鼻侧、上方和下方3个位点仍保持血流恢复状态;同时,浅层血管密度在术后1个月除了鼻侧和下方位点的血流有显著恢复外,其余的均无明显改善,术后3个月仅下方位点血管密度保持着恢复状态。由此可见,同时接受抗VEGF治疗的条件下,深层的血管密度恢复效果优于浅层血管密度。此结果提示临床,通过OCTA扫描观察到黄斑水肿已消退,但视网膜周围微血管结构可能已破坏,导致无法完全恢复再灌注。当然,也可能提示wAMD患者视网膜深层对该药更敏感,但是随着时间推移,可能具有复发风险。
FAZ是一种光滑的类圆环结构,它的大小反映了中心凹区域微细循环的状况,其血供主要来源于脉络膜毛细血管。FAZ形态和结构的完整性与毛细血管的组织代谢相关。wAMD发展过程中,FAZ周围血管因异常的代谢过程而造成损害,导致无灌注区扩大或变形。本研究用OCTA技术测量wAMD的FAZ面积,并分析了FAZ的临床特征和“3+PRN”方案对FAZ面积的影响。相关研究表明,OCTA可精确测量健康人的FAZ面积,亦可用于诊断和监测视网膜微循环疾病,由于存在个体差异,可进行多次重复检查[31]。但是,对于渗出型AMD的临床实验指标仍需要进一步验证[32]。研究发现治疗后1个月与治疗前相比,FAZ面积显著降低,提示抗VEGF治疗可改善血供面积;治疗后3个月与治疗前相比,FAZ面积无显著改变,表明实行“3+PRN”方案后1个月效果最显著,而后期需要制定更加合理的随访时间、监测频率及治疗方案。相关性分析发现,中心凹颞侧、鼻侧、上方和下方处4个位点的视网膜厚度下降程度越大,FAZ面积的改善程度越小。提示FAZ面积变化与视网膜厚度的改变呈负相关,FAZ面积的改善可能受中心凹周围视网膜血管丛的影响。该结果可能涉及视网膜血管的解剖形态及血管走行的因素,由于目前的OCTA技术水平有限,无法观察到患者FAZ周边视网膜血管的具体解剖位置,此因素暂不能很好地得到证实。虽然目前临床上应用OCTA测量FAZ面积应用较广,但是在病理条件下FAZ面积的精准测量仍存在不足之处和局限性:(1) 系统自带软件在测量FAZ面积时,需要鼠标双击FAZ区域,自动形成FAZ面积,但是该方法形成的FAZ面积差异性较大;(2) OCTA在扫描的过程中仍需较长时间,至少需要固定视标3 s,个别受检者因固视不佳,导致成像质量欠佳,进而影响FAZ面积测量的准确性。为了减少偏倚,后续可采取扩大样本量、多次测量后取平均值的方法。
早期基于FFA的研究表明,抗VEGF治疗不会恶化FAZ面积的进展[33-34];wAMD的特点是视网膜或脉络膜下新生血管的产生,导致视网膜内或视网膜下和视网膜色素上皮下的出血或积液[35]。因此,抗VEGF药物可能是通过抑制CNV的生长来减少黄斑内的渗漏,而不是直接改变微血管结构。与之前研究有所不同,本研究结果提示视网膜水肿的消退可观察到部分方位的视网膜血管密度增加,个别方位改善不显著。其原因可能为本研究样本量较小,存在偏倚,后续将以更大的样本量进行研究说明。
综上,本研究结果发现“3+PRN”方案治疗老年性黄斑变性短期疗效较好,远期疗效欠佳,需进行严格的主动随访策略以保证患者的预后;OCTA成像技术可对接受抗VEGF治疗的wAMD患者的疗效进行量化评估,除视网膜厚度指标的评估外,视网膜血流密度和FAZ指标也应在随访中予以重视。

