不同链长聚乙二醇修饰的香豆素6脂质纳米粒对口服吸收的影响
戴江东,李会鹏,孙敏捷*
(1江苏省建湖县人民医院,盐城224700;2中国药科大学药剂系,南京210009)
口服给药具有成本低、顺应性高等优点,因而被广泛的接受和使用。肠上皮绒毛的总面积可达30~400 m2,对药物具有良好的吸收能力[1-2]。纳米脂质载体(nanostructured lipid carriers,NLCs)由固态脂质和液态脂质共同组成,其作为新一代的载药平台被广泛应用于口服药物递送,并且具有非常好的生物相容性和生物可降解性[3-4]。纳米脂质载体可控的纳米结构提供了更大更稳定的空间来容纳药物分子,从而最大限度地提高了载药量并且同时保证了药物在载体中的稳定性。
为了能够达到好的口服治疗效果,药物递送系统必须克服胃肠道黏液层的快速清除和滞留,并且迅速有效地穿过肠上皮细胞进入血液循环[5-6]。为了克服高黏弹性黏液层的阻碍从而提高药物的口服生物利用度,黏膜穿透型纳米载体(MPP)被开发并被广泛使用。MPP通过非离子型长链聚合物的修饰使其具有快速穿越肠上皮细胞的能力[7]。MPP穿透黏液层后到达更深层的肠细胞部位并且均匀地分布在肠道细胞表面,从而能够更好地提高药物的口服生物利用度。
PEG作为一种电中性的亲水性材料被广泛应用于药物递送系统中,其能够增加制剂在体内的滞留时间,减少制剂血液循环过程中的识别和降解。更为重要的是,纳米载体通过一定量的PEG修饰能够展现出快速的黏膜穿透能力[8]。纳米载体通过表面PEG修饰可以提供“黏液惰性”界面可以最大化地减少纳米粒与黏液层的黏附,提高了纳米载体在黏液层的扩散[9-10]。然而在大多数情况下,经过PEG修饰的纳米载体亲水性表面往往会阻碍肠道上皮细胞对其吸收。因此研究MPP的表面亲水性对胃肠道吸收的影响显得尤为紧迫和重要。
本研究制备了3种不同链长PEG修饰的NLCs,以香豆素6作为荧光探针考察NLCs的体内外行为。对不同链长PEG修饰的NLCs的理化性质、体外稳定性、细胞毒性、细胞摄取和摄取机制进行了考察,为后续研究奠定了基础。
1 材料
1.1 药品与试剂
香豆素6(C6,纯度大于98%)、三月桂酸甘油酯(日本TCI公司);大豆卵磷脂(上海太伟药业有限公司);Labrafac CC(法国Gattefosse公司);聚乙二醇(40)单硬脂酸酯(S40)、聚乙二醇(55)单硬脂酸酯(S55)和聚乙二醇(100)单硬脂酸酯(S100)(上海日光化学贸易有限公司);其他试剂均为市售分析纯。
1.2 仪器
JY92型探头超声仪(宁波新芝科器研究所);ZetaPALS型高分辨率电位及粒度分析仪(美国Brookheaven公司);LC-10ATVP高效液相色谱仪、RF-10AXL荧光检测器(日本岛津公司);H-7650透射电子显微镜(日本日立公司);酶联免疫测定仪(美国Thermo Scientific公司);透析袋(截留相对分子质量8 kD,南京晚晴化玻仪器有限公司)。
1.3 细胞
人结肠癌腺癌细胞Caco-2细胞株购自中国科学院上海分院细胞库。
2 方法
2.1 香豆素6荧光分析方法的建立
采用高效液相色谱法检测香豆素6的浓度,色谱柱采用ODSDiamonsil-C18柱(250 mm×4.6 mm,5μm);流动相采用甲醇-水(96∶4);流速设定为1.0 mL/min;柱温为35℃;检测激发波长为465 nm,发射波长为502 nm;进样量设定为20μL。通过制备质量浓度为2,5,10,25,50,100 ng/mL的系列标准液后进样分析,以峰面积(A)对质量浓度(c,ng/mL)进行线性回归,得到线性回归方程及相关系数。并对其专属性和精密度进行考察。
2.2 不同链长PEG修饰的NLCs的制备及处方研究
2.2.1 薄膜分散法制备NLCs 通过薄膜分散法制备NLCs[11],将处方量的香豆素6(100μg)、大豆磷脂(262.5 mg)、三月桂酸甘油酯(21.9 mg)、Labrafac CC(65.6 mg)以及相同质量(占总质量20%)不同链长的PEG加入到乙醇-二氯甲烷(8∶2)10 mL混合溶液中。全部溶解后将其转移到500 mL的茄型瓶中,37℃旋转减压成膜。之后继续抽真空12 h以除尽有机溶剂。加入等渗磷酸盐缓冲液(PBS,pH 7.4),37℃水合30 min,通过控制不同的超声时间(超声强度设为100 W,超声1 s停2 s,90次为1个循环)得到粒径相同的不同链长PEG修饰的NLCs。通过过膜法测定香豆素6的包封率[10]。空白NLCs按照上述相同的方法制备,区别在于不包载香豆素6探针。本文若无特殊说明,所制备的NLCs均包载香豆素6。
2.2.2 NLCs的理化性质表征 粒径和Zeta电位的测定:将制备得到的NLCs稀释一定倍数后用电位及粒度分析仪测定其粒径、多分散系数和Zeta电位。
形态观察:将制备的不同链长PEG修饰的NLCs稀释一定倍数后滴于铜网上,放置形成薄膜,通过透射电子显微镜对NLCs的形态进行观察。
2.3 NLCs的体外稳定性考察
考察不同链长PEG修饰的NLCs在模拟胃液、模拟肠液和等渗PBS中的稳定性。量取不同链长PEG修饰的NLCs100μL,将其重新分散至模拟介质5 mL中,测定不同时间下NLCs的粒径和多分散系数变化。
2.4 水化层厚度的研究
水化层厚度通过Gouy-Chapmann理论计算和验证[12],具体公式为lnψ(L)=lnA-kL。该理论中NLCs的电位和水化层厚度呈线性关系,其中k=为电解质的物质的量浓度),A为Debye-Huckel参数,L为水化层厚度。通过测定NLCs在不同浓度NaCl中的电位,可得出NLCs的水化层厚度(以nm为单位)。
2.5 体外释放实验
采用动态透析法研究NLCs在等渗PBS溶液中的体外香豆素6的释放行为。将制备的不同链长PEG修饰的NLCs各1 mL(其中香豆素6的最终质量浓度为1 000 ng/mL)装入透析袋中(截留相对分子质量为8 kD),然后将透析袋置于等渗PBS80 mL中,设定转速为250 r/min,温度设定为37℃,考察NLCs的体外释放研究,在规定的时间点(1,2,4,6,8,12,24 h)取样1 mL,并立即加入新鲜的释放介质1 mL,释放的介质样品通过有机溶剂萃取涡旋后12 000 r/min离心10 min,取上清液进样,绘制释放曲线。
2.6 细胞毒性实验
Caco-2细胞的培养条件为含有10%的胎牛血清、1%非必需氨基酸、100 U/mL青霉素和100 mg/mL链霉素的高糖DMEM培养基。待细胞生长到对数期时,以每孔1×104个细胞的密度接种于96孔板中,37℃孵育24 h后,加入不同链长PEG修饰的含有香豆素6的NLCs或空白NLCs,37℃孵育24 h,加入噻唑蓝(MTT)溶液(5 mg/mL)10μL,37℃继续孵育4 h。待弃去上清液后,加入二甲基亚砜(DMSO)150μL溶解蓝紫色的甲瓒结晶,用酶联免疫测定仪于570 nm测定吸收度。将非加药孔作为对照。每个样品做3个复孔,计算细胞存活率。
2.7 细胞摄取实验
取对数期生长期的Caco-2细胞铺于24孔板中,待细胞汇合度达到80%以上加入不同链长PEG修饰的NLCs。通过包封不同质量浓度香豆素6(50,100,150,200 ng/mL)的NLCs与细胞孵育相同的时间(设定为2 h)或者包封相同质量浓度香豆素6的NLCs(100 ng/mL)与细胞孵育不同时间(0.5,1,1.5,2 h)来考察NLCs的细胞摄取动力学。待细胞摄取结束后移去NLCs,用PBS清洗3遍通过胰蛋白酶消化后用流式细胞仪进行荧光强度的定量。同时采用激光共聚焦显微镜对NLCs的细胞摄取进行定性观察。将不同链长PEG修饰的NLCs(香豆素6的质量浓度设定为100 ng/mL)与细胞在共聚焦皿上孵育不同时间后移去NLCs,并且加入多聚甲醛进行固定。待通过4',6-二脒基-2-苯基吲哚(DAPI)染色后将细胞放置于激光共聚焦显微镜下进行图片拍摄。
2.8 细胞摄取机制研究
为了研究不同链长PEG修饰的NLCs的细胞摄取机制,NLCs首先与不同通路抑制剂提前孵育30 min,分别为叠氮化钠(细胞能量代谢抑制剂)、氯丙嗪(网格蛋白介导的内吞抑制剂)、制霉菌素(小窝蛋白介导的内吞抑制剂)、巨胞饮通路抑制剂阿米洛利(EIPA)和甲基-β-环糊精(MβCD,通过抑制胆固醇合成同时抑制网格蛋白和小窝蛋白通路)[13]。孵育2 h细胞摄取结束后通过流式细胞仪对NLCs的摄取进行定量测定。相对摄取指数(RUI)通过公式RUI=Fs/Fc×100%测定,Fs代表与不同摄取抑制剂共同孵育的NLCs的细胞摄取量,Fc代表与不含抑制剂共同孵育的NLCs的细胞摄取量。
3 结果与讨论
3.1 香豆素6荧光分析方法
以峰面积(y)对质量浓度(x)绘制标准曲线得到回归方程为y=54 205x-7 798(r=0.998),在2~100 ng/mL范围内,峰面积与香豆素6的质量浓度之间具有良好的线性关系,并且测得的日间精密度和日内精密度良好。
3.2 不同链长PEG修饰的NLCs的处方工艺优化
以粒径和多分散系数(PDI)作为指标,通过控制超声时间,得出最优的制备工艺。由图1可知,PEG40修饰的NLC(pNLC-EG40)和PEG55修饰的NLC(pNLC-EG55)随着超声时间的延长,纳米粒的粒径先减小然后保持不变,PDI呈现先减小后增加的趋势。对于PEG100修饰的NLC(pNLC-EG100)来说,超声时间对粒径的影响较小,PDI呈现出先增加后减小的趋势。由结果可知对于不同链长PEG修饰的纳米载体,增加超声时间对NLCs粒径的影响较小;对于较短链长PEG(PEG40和PEG55)修饰的纳米载体,增加超声时间后其PDI会增加,表明较长的超声时间对载体粒径的均一性产生了破坏。PEG100修饰的脂质纳米载体随着超声时间的增加PDI持续降低,表明增加超声时间有利于较长链长PEG修饰的纳米载体的粒径保持均一。为了获得粒径相同的不同链长PEG修饰的NLCs,将NLC的制备工艺设定为1个循环(每个循环超声90次,超声1 s,停2 s),pNLC-EG40的制备工艺设定为2个循环,pNLC-EG55的制备工艺设定为1个循环,pNLC-EG100的制备工艺设定为5个循环。

Figure1 Optimization of nanoparticlespreparation by adjustingultrasonic time(100 W,90 times/cycle)(xˉ±s,n=3)
3.3 不同链长PEG修饰的NLCs的形态学观察
最终制备的不同链长PEG修饰的NLCs的粒径和电位以及包封率的结果见表1。通过动态光散射(DLS)测得NLCs的粒径均在120 nm左右,从而排除了粒径差异对NLCs口服吸收的影响。由于本研究采用了电负性的磷脂,因此NLCs的电位为负,NLCs的负电性能够更好地增加其在体内的循环时间。图2透射电镜(TEM)图片显示制备的4种NLCs呈类心球结构,粒径与DLS所测的粒径大小基本一致。并且通过过膜法测定香豆素6的包封率均在90%以上。这表明香豆素6能够大部分包载到NLCs中。
3.4 不同链长PEG修饰的NLCs的体外稳定性考察
如图3所示,制备的4种NLCs在PBS缓冲液、模拟胃液和模拟肠液中粒径均能保持稳定。通过PBS缓冲液模拟细胞的生存环境,通过模拟胃液来模拟胃内环境,通过模拟肠液来模拟肠道内环境,4种NLCs的粒径在3种模拟液中均能保持不变,表明6 h内NLCs在胃和肠道中均能够保持自身的稳定性。
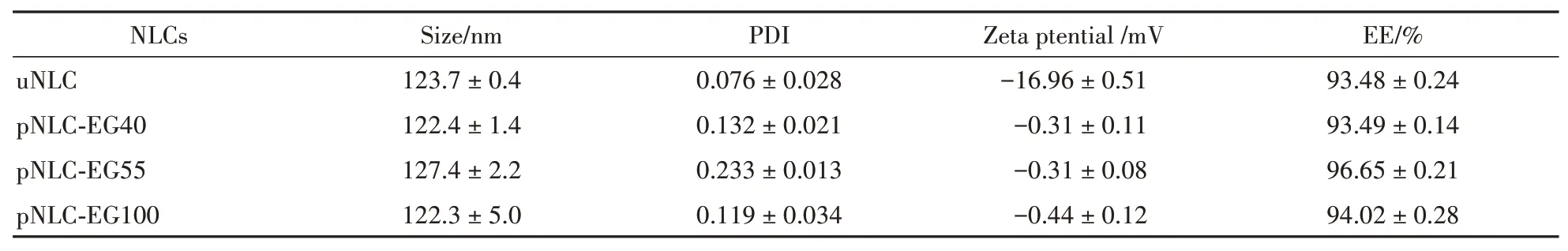
Table 1 Physicochemical property of nanostructured lipid carriers(NLCs)(xˉ±s,n=3)

Figure 2 Transmission electron microscope(TEM)images of(A)uNLC,(B)pNLC-EG40,(C)pNLC-EG55 and(D)pNLC-EG100
3.5 不同链长PEG修饰的NLCs的水化层厚度研究
由公式lnψ(L)=lnA-kL对4种NLCs进行线性拟合得出相应方程。uNLC的方程为y=-0.391 7x+4.092 3(r=0.988)。pNLC-EG40的方程为y=-1.578 4x+3.501 6(r=0.961)。pNLC-EG55的方程为y=-2.188 2x+3.929 7(r=0.987 4)。pNLC-EG100的方程为y=-2.923 5x+3.817 8(r=0.939 6)。上述方程中,y为lnψ(L),x为k。其水化层厚度从小到大依次为uNLC、pNLCEG40、pNLC-EG55、pNLC-EG100(图4)。由结果可知,随着PEG链长的增加,水化层的厚度逐渐增大,表明不同链长的PEG成功地修饰到了NLCs的表面,同时也证明水化层厚度和PEG的链长成正比。
3.6 体外释放试验
体外释放实验如图5显示,4种NLCs在PBS缓冲液中24 h的累积释放量均未超过5%。表明香豆素6的渗漏量很小,制备的4种不同链长PEG修饰的NLCs能够有效包载香豆素6。结果同时表明,NLCs表面不同链长的PEG修饰对药物的释放影响很小,包载香豆素6的NLCs在体内循环中能够保持相对稳定,避免了药物传递过程中香豆素6的快速渗漏。同时也可以通过香豆素6的荧光示踪NLCs的体内外行为。
3.7 不同链长PEG修饰的NLCs对Caco-2细胞的细胞毒性试验
通过MTT实验[14]考察了不同链长PEG修饰的空白和载有香豆素6的NLCs与Caco-2细胞孵育24 h之后的细胞存活率,如图6所示。NLCs在200~3 000μg/mL的范围内,细胞的存活率均大于80%,表明NLCs在使用的质量浓度范围内对细胞不产生毒性。同时不同链长PEG修饰的NLCs的组间细胞毒性无明显差异,表明NLCs具有好的生物相容性和生物安全性。

Figure3 Stability study of coumarin 6-loaded NLCs in PBS(pH 7.4)(A),simulated gastric fluid(B),and simulated intestinal fluid(C)at 37°C
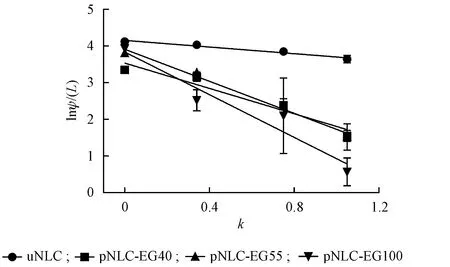
Figure 4 Curve of lnψ(L)to k for nanoparticles with different polyeth⁃ylene glycol coating length(xˉ±s,n=3)
3.8 不同链长PEG修饰的NLCs对Caco-2细胞的细胞摄取研究

Figure 5 In vitro release profiles of coumarin 6-loaded NLCs in PBS(xˉ±s,n=3)
由图7所示,Caco-2细胞对4种NLCs的摄取均具有浓度和时间依赖性,并且pNLC-EG100在各个时间点以及不同浓度均展示出了较高的荧光强度,表明Caco-2细胞对其具有较高的摄取效率。图8的激光共聚焦图像显示pNLC-EG100与其他NLCs组相比具有更高的胞内荧光强度。上述结果表明,S100修饰的NLCs是最佳的PEG修饰长度,能够显著提高Caco-2细胞对脂质纳米载体的摄取和吸收。

Figure6 In vitro cytotoxicity of coumarin 6-loaded NLCs(A)and blank NLCs(B)with different PEGcoatingon Caco-2 cells(xˉ±s,n=3)

Figure 7 Cell uptake of coumarin 6-loaded NLCs with different concentrations of coumarin 6(A)and cell uptake of coumarin 6-loaded NLCs con⁃taining100 ng/mL of coumarin 6 at different timeintervals(B)(xˉ±s,n=3)
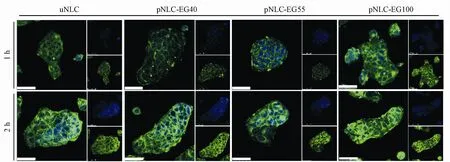
Figure8 Confocal laser scanningmicroscopy(CLSM)imagesof Caco-2 cell after incubation with different NLCs(100 ng/mL of coumarin 6)at 37°C for 2 h(Scale bar:50μm)
3.9 不同链长PEG修饰的NLCs的细胞摄取途径研究
由图9可知,甲基-β-环糊精(MβCD)通过抑制胆固醇的合成对细胞的摄取影响最大,表明胆固醇在NLCs的细胞摄取过程中起到了重要作用,同时,小窝蛋白通路抑制剂制霉菌素(nystatin)和能量抑制剂叠氮化钠(NaN3)均对NLCs的摄取产生了抑制作用,表明Caco-2细胞对NLCs的摄取是由多种通路共同介导的。巨胞饮通路抑制剂阿米洛利(EIPA)对uNLC和pNLC-EG55产生了显著的抑制作用(P<0.01),但对pNLC-EG40和pNLC-EG55无抑制效果,表明PEG链段长度会对纳米载体的巨胞饮途径的摄取产生影响。

Figure 9 Relative uptake efficiency of NLCs treated with various cel⁃lular uptake inhibitors in Caco-2 cells(xˉ±s,n=3)MβCD:Methyl-β-cyclodextrin;EIPA:ethylisopropyl-amiloride
4 结 论
本实验通过优化制备工艺得到了一系列不同链长PEG修饰的NLCs。NLCs水化层厚度随着PEG链长的增加而增大,并且不同链长PEG修饰的NLCs在PBS缓冲液和K-R液中粒径均能保持相对稳定。体外释放试验表明,香豆素6的泄漏量很小,可以通过香豆素6的荧光来示踪纳米粒的体内外行为。MTT实验表明,在要求的浓度范围内空白载体和载药载体均是安全无毒的;细胞摄取动力学实验表明,4种NLCs的Caco-2细胞摄取均具有时间依赖性和浓度依赖性,并且pNLC-EG100表现出了更高的细胞摄取效率,该结果通过激光共聚焦实验得到验证。4种NLCs的细胞摄取是由多种通路共同介导的,并且胆固醇在细胞的摄取过程中起到了重要作用。以上结果表明,不同链长的PEG修饰的NLCs在细胞摄取水平上存在差异性,pNLC-EG100是最佳链长的PEG。同时还需要进一步的细胞实验和动物实验验证该结论。

