西洋参破壁饮片中8种人参皂苷类成分双标多测法的建立
于现花 刘军玲 金传山 张亚中 栗进才
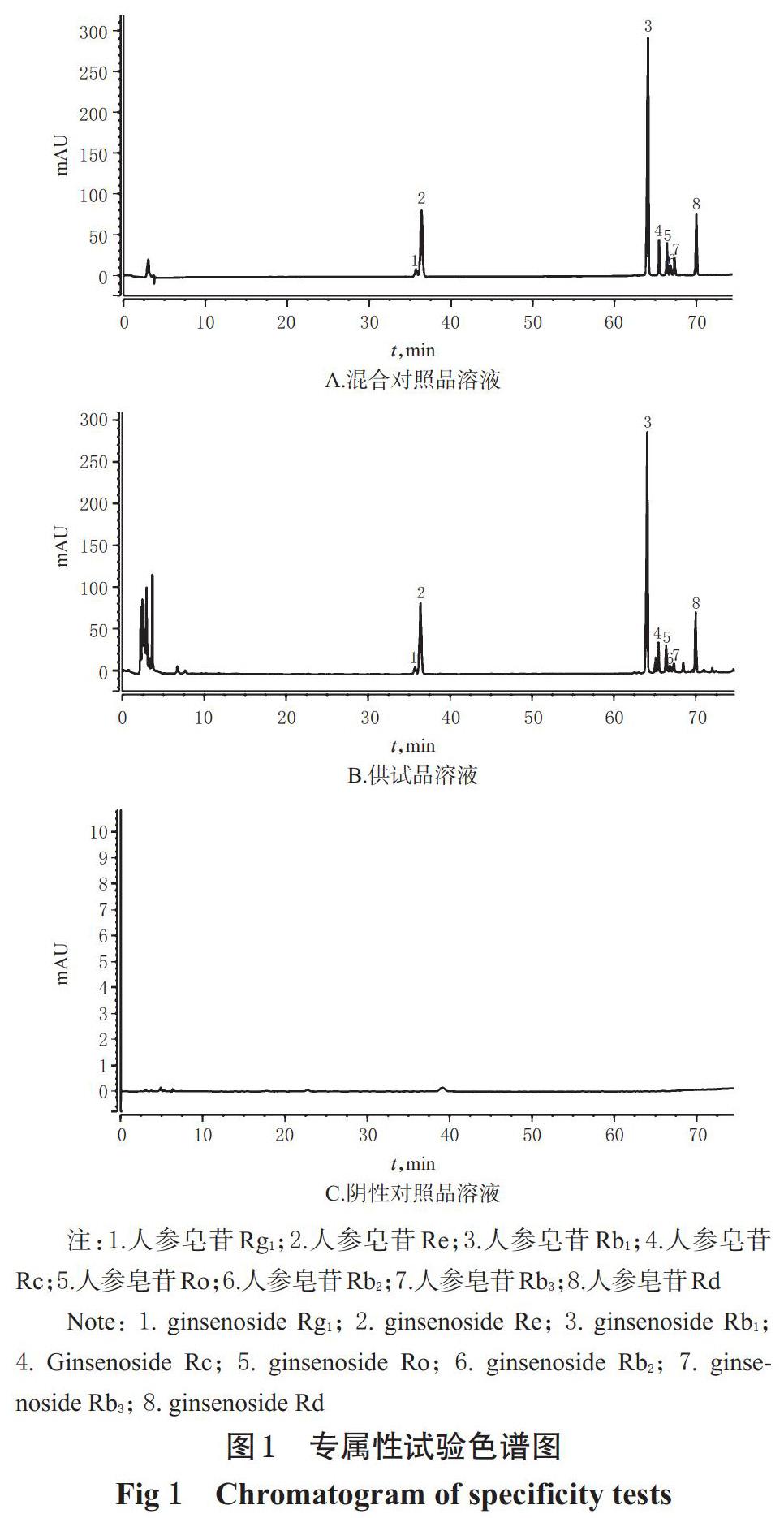

摘 要 目的:建立同時测定西洋参破壁饮片中8种人参皂苷类成分含量的方法。方法:采用高效液相色谱-二极管阵列检测器法(HPLC-DAD)测定西洋参破壁饮片中人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd的含量。色谱柱为Agilent5 TC-C18柱;流动相为乙腈-0.2%磷酸水溶液(梯度洗脱);柱温为30 ℃;流速为1.0 mL/min;检测波长为203 nm;进样量为10 μL。以人参皂苷Re和人参皂苷Rb2为参照物,采用双标线性校正法预测其余6种成分的保留时间以对其进行定性,并比较该方法与相对保留时间法的差异;以人参皂苷Re为参照物,采用相对校正因子法对上述成分进行定量,并与外标法定量结果进行比较。结果:西洋参破壁饮片中人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd的含量分别为10.59~12.78、2.160~2.768、27.492~38.880、3.154~4.018、3.368~4.080、0.343~0.755、0.961~1.415、5.857~6.923 mg/g。采用双标线性校正法预测成分保留时间的准确性更高,且预测保留时间的绝对偏差均低于相对保留时间法;采用相对校正因子法和外标法的定量结果差异不大,相对误差(RE)均小于3%。结论:所建立的双标多测法可同时对西洋参破壁饮片中8种人参皂苷类成分进行准确定性和定量。
关键词 西洋参破壁饮片;人参皂苷;双标多测法;双标线性校正法;相对校正因子法;高效液相色谱
ABSTRACT OBJECTIVE: To establish the method for simultaneous determination of 8 kinds of ginsenosides in Panax quinquefolium broken pieces. METHODS: HPLC-DAD method was used to determine the contents of ginsenoside Rg1, Re, Rb1, Rc, Ro, Rb2, Rb3, Rd in P. quinquefolium broken pieces. The determination was performed on Agilent5 TC-C18 column with mobile phase consisted of acetonitrile-0.2% phosphoric acid water solution (gradient elution) at the flow rate of 1.0 mL/min. The column temperature was set at 30 ℃. The detection wavelength was set at 203 nm, and sample size was 10 μL. Ginsenoside Re and ginsenoside Rb2 were used as control, liner calibration with two-reference substances correction was used to predict the retention time of other 6 components, and was compared with the relative retention time method. Using ginsenoside Re as control, above components were quantified by the relative correction factor method, and the results were compared with the external standard method. RESULTS: The contents of ginsenoside Rg1, Re, Rb1, Rc, Ro, Rb2, Rb3, Rd were 10.59-12.78, 2.160-2.768, 27.492-38.880, 3.154-4.018, 3.368-4.080, 0.343-0.755, 0.961-1.415, 5.857-6.923 mg/g. The accuracy of two-reference substances linear correction method to predict the retention time of components was higher, and the absolute deviation of the predicted retention time was lower than that of the relative retention time method. There was no significant difference between the relative correction factor method and the external standard method, and relative error was <3%. CONCLUSIONS: Established two-reference substances for determination of multiple components can be used for qualitative and quantitative analysis of 8 kinds of ginsensides in P. quinquefolium broken pieces simultaneously and accurately.
KEYWORDS Panax quinquefolium broken pieces; Ginsenoside; Two-reference substances for determination of multiple components; Two-reference substances linear correction method; Relative correction factor method; HPLC
西洋参为五加科植物西洋参Panax quinquefolium L.的干燥根,原生长于北美洲的东部,我国于17世纪开始引进种植,已有300多年的应用历史[1-3]。传统中医理论认为,西洋参性凉而补,具有补气养阴、清热生津的功效,主要用于阴虚燥咳、劳嗽咳血等[1]。现代药理学研究表明,西洋参具有抗肿瘤、免疫调节、改善心血管系统疾病等作用[4-5]。相关研究发现,西洋参中含有皂苷类、氨基酸类、糖类、黄酮类和无机元素类等活性成分,其中皂苷类是其最主要的活性成分[6]。
西洋参较为名贵,常将其制成破壁饮片,以最大限度地利用其药效成分,且对节约药材资源具有重要意义[7]。目前,多以2020年版《中国药典》(一部)中规定的人参皂苷Rg1、Re、Rb1含量作为西洋参破壁饮片的质量评价指标[1],但仅测定这3种成分,并不能全面反映西洋参的内在质量。
对于中药的多成分含量测定,相关研究者提出采用替代对照品法或一测多评法[8-14],但这些方法均是以一个成分作为内参,对多个目标成分以相对校正因子法进行定量、以相对保留时间法进行定性,虽节约了对照品,但定性和定量的误差稍大[14]。后续孙磊等[15]提出了“双标多测法”,即以2个对照品采用双标线性校正法对其他色谱峰进行定性,并结合相对校正因子法对其他成分进行定量;且在相同分析条件下,双标线性校正法提高了色谱峰定性的准确度和色谱柱的适用性,实现了目标成分在不同品牌、型号的色谱柱和色谱仪间保留时间模型的迁移均存在线性关系。因此,在实际应用中,可利用这种线性关系提高保留时间的重现性[15-16]。基于此,本研究建立了测定西洋参破壁饮片中人参皂苷 Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd 含量的双标多测法,以期为该饮片多指标成分综合质量控制和评价提供思路。
1 材料
1.1 主要仪器
UItiMate 3000型高效液相色谱(HPLC)仪及所配备的二极管阵列检测器(DAD)检测器购自美国Dionex公司; LC-20AT型HPLC仪购自日本Shimadzu公司;1260 型HPLC仪及所配备的VWD检测器购自美国Agilent公司;XP26型百万分之一电子分析天平购自瑞士Mettler Toledo公司;185型超纯水仪购自美国Millipore 公司。
1.2 主要药品与试剂
人参皂苷Rg1(批号110703-201128,纯度≥93.4%)、人参皂苷Re(批号110754-201626,纯度≥92.7%)、人参皂苷Rb1(批号110704-201122,纯度≥92.9%)、人参皂苷Rc(批号110021-14-0,纯度≥98%)、人参皂苷Ro(批号111903-201102,纯度≥98%)、人参皂苷Rb2(批号111715-200501,纯度≥98%)、人参皂苷Rb3(批号111686-200501,纯度≥98%)、人参皂苷Rd(批号111818-201001,纯度≥94.4%)均为对照品,均购自中国食品药品检定研究院;乙腈、甲醇为色谱纯,磷酸、正丁醇为分析纯,水为超纯水。
10批西洋参破壁饮片样品(编号S1~S10)均购自安徽宏信药业发展有限公司,经安徽省食品药品检验研究院张亚中主任中药师鉴定为五加科植物西洋参P.quinquefolium L. 的干燥根。
1.3 其他材料
本研究共用到14根色谱柱(编号col 1~col 14) ,其中col1为ZORBAX Eclipse Plus C18,col2为Agilent5 TC-C18,col 3为DIKMA Diamonsil C18,col4为DIKMA Inspire C18,col 5为Phenomenex Kinetex C18 100A,col 6为JADE-PAK ODS-AQ,col 7为Innoval C18,col 8为TechMate C18 ST,col 9为TechMate CR(1 ∶ 5)-ST,col 10为Venusil ASB C18,col 11为Waters XBridge C18,col 12为ZORBAX Eclipse XDB C18,col 13为Shim-pack VP-ODS,col 14为Phenomenex Luna C18,所有色谱柱的规格均相同(250 mm×4.6 mm,5 μm)。
2 方法与结果
2.1 色谱条件
选用UItiMate 3000型高效液相色谱仪;定性研究的色谱柱选择col 1~col 13;定量研究色谱柱选择col 2;流动相为乙腈(A)-0.2%磷酸溶液(B),梯度洗脱(0~15 min,81%B;15~20 min,81%B→79%B;20~35 min,79%B→75%B;35~55 min,75%B→68%B;55~70 min,68%B→57%B;70~73 min,57%B→47%B;73~75 min,47%B→81%B);流速为1.0 mL/min;检测波长为203 nm;柱温为30 ℃;进样量为10 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液的制备 分别取人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd对照品适量,精密称定,置于同一5 mL量瓶中,加甲醇溶解,配制成質量浓度分别为 0.25、1.378、3.86、0.41、0.388、0.076、0.166、0.65 mg/mL 的混合对照品溶液。
2.2.2 供试品溶液的制备 参考文献[1]方法,取西洋参破壁饮片粉末(过三号筛,下同)约1 g,精密称定,置于具塞锥形瓶中,精密加入水饱和的正丁醇50 mL,称定质量;水浴加热回流提取1.5 h,放冷,再称定质量,以水饱的正丁醇补足减失的质量,摇匀,滤过;精密量取续滤液25 mL,置于蒸发皿中,水浴蒸干,残渣加50%甲醇溶解并转移至10 mL量瓶中,加50%甲醇定容,摇匀,滤过,取续滤液,即得。
2.3 方法学考察
2.3.1 专属性试验 取混合对照品溶液、供试品溶液(编号S2)和阴性对照溶液(即50%甲醇溶液)适量,按“2.1”项下色谱条件(色谱柱为col 2)进样测定,记录色谱图。结果显示,各待测成分峰分离度均大于1.5,见图1。
2.3.2 线性关系考察 精密量取“2.2.1”项下的混合对照品溶液2、1、0.5、0.35、0.25 mL, 分别置于2 mL量瓶中,以甲醇定容, 摇匀,即得系列浓度的混合对照品溶液;按“2.1”项下色谱条件进样测定,以目标成分质量浓度(x,mg/mL)为横坐标、峰面积(y)为纵坐标,进行线性回归,结果见表1。
2.3.3 精密度考察 取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件连续进样6次,记录峰面积。结果,人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd 峰面积的RSD分别为1.35%、1.57%、0.91%、1.08%、0.91%、1.57%、1.21%、0.86%(n=6),表明仪器精密度良好。
2.3.4 重复性考察 取同一批西洋参破壁饮片粉末(编号S2)6份,每份约1 g,按“2.2.2”项下方法制备供试品溶液,然后按“2.1”项下色谱条件下进样测定,记录峰面积并代入回归方程中计算8种成分的含量。结果,人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd 的平均含量分别为2.467、12.338、36.054、3.301、2.692、0.306、0.818、6.420 mg/g,RSD分别为0.40%、0.35%、0.14%、0.14%、1.80%、2.92%、1.39%、0.16%(n=6),表明方法重复性较好。
2.3.5 稳定性考察 取同一份供试品溶液(编号S2),分别于室温放置0、2、8、10、12、24 h时,按“2.1”项下色谱条件进样测定,记录峰面积。结果,人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd 峰面积的RSD分别为0.36%、0.33%、0.14%、0.10%、1.74%、2.86%、2.39%、0.14%(n=6),表明供试品溶液于室温放置24 h内稳定性良好。
2.3.6 加样回收率考察 取已知成分含量的西洋参破壁饮片粉末(编号S2)约0.5 g,精密称量,共6份,精密加入人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd的对照品各适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积,并计算加样回收率,结果见表2。
2.4 基于双标线性校正法的定性研究
2.4.1 不同色谱柱上保留时间的线性关系考察 基于“2.1”项下色谱条件,采用13根不同的色谱柱进行试验,并以同一成分在13根色谱柱上的实测保留时间的平均值作为预测保留时间(SRT)[15-16]。结果,人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd的SRT分别为31.316、31.972、60.348、61.997、63.194、63.590、64.117、66.825 min。基于双标线性校正法的平衡分配机理,组分的保留时间在不同色谱仪及色谱柱上的保留时间具有线性关系[16],以8种人参皂苷类成分的SRT为横坐标(x)、实测保留时间为纵坐标(y),采用OriginPro 9.0软件进行拟合,即得8种人参皂苷类成分在不同色谱柱上保留时间的线性方程及相关系数,见表3。
2.4.2 双标化合物的确定 将色谱图(cdf格式文件)导入 DRS Origin 软件中,点击“增加参照”,设定双标成分,再于该软件的样品测试页面点击“关联对照品”,然后于方法开发页面点击“方法优化”,即得10种优化方案(见表4,其中CRS为化学标准物质)。当10种优化方案的色谱峰预测准确率和色谱柱符合率均达到100%,则说明试验所选的13根色谱柱适用性较好[17]。按照双标化合物选择保留时间回归偏差相对较小和所选化合物保留时间段尽可能分布在色谱峰的两端的原则[15,18],本研究选定人参皂苷Re和人参皂苷Rb2作为双标化合物来验证色谱柱col 14。以人参皂苷Re、Rb2的SRT值31.972、63.590 min为横坐标(x),以两者的实际保留时间为纵坐标(y),进而得到两点线性方程:y=0.960 1x+3.423 1;再将其余6个成分的SRT值代入方程,得到人参皂苷Rg1、Rb1、Rc、Ro 、Rb3、Rd的预测保留时间分别为33.489 6、61.363 2、62.946 4、64.095 7、64.981 8、67.581 8 min,其与实际保留时间的相对偏差分别为 0.57%、0.42%、0.30%、0.27%、0.02%、0.16%。这符合定性条件下,预测保留时间与实测保留时间的误差≤0.5 min 的要求[18],表明该方法在col 14色谱柱上的预测效果良好。
2.4.3 双标线性校正法与相对保留时间法的比较 基于“2.4.2”项下结果,采用双标线性校正法并以人参皂苷Re、Rb2作为双标化合物,采用相对保留时间法并以人参皂苷Rb2为参照物,分别对保留时间进行预测,然后得出其余6种人参皂苷类成分预测保留时间的绝对偏差。结果,双标线性校正法预测的6种人参皂苷类成分保留时间的绝对偏差均低于相对保留时间法,且前者绝对偏差值的波动范围相较后者更小,表明采用双标线性校正法来预测人参皂苷类成分的保留时間的准确性更高,见表5。
2.5 基于相对校正因子法的定量研究
2.5.1 相对校正因子的计算 采用多点校正法[19-20],即以多点计算所得的相对校正因子(fsi)平均值用于定量。取“2.3.2”项下混合对照品溶液,共5份,按“2.1”项下色谱条件进样测定,记录峰面积。以人参皂苷Re为参照物,分别计算人参皂苷Rg1、Rb1、Rc、Ro、Rb2、Rb3、Rd的相对校正因子fsi(fsi=fs/fi=As×ci/cs×Ai,其中As为参照物的峰面积,cs为参照物的浓度,Ai为某待测成分的峰面积,ci为某待测成分的浓度[21]),结果见表6。
2.5.2 相对校正因子的适用性考察 考察Dionex Ultimate 3000、Shimadzu LC-20AT、Agilent 1260等3种高效液相色谱系统和col 10[Venusil ASB C18(250 mm×4.6 mm,5 ?m)]、col 2 [Agilent 5 TC-C18(250 mm×4.6 mm,5 ?m)]2根色谱柱的相对校正因子。结果,8种人参皂苷类成分在不同高效液相色谱仪和色谱柱的RSD均小于5%,见表7。
2.6 西洋参破壁饮片样品中8种人参皂苷类成分的含量测定
取10批西洋参破壁饮片样品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”色谱条件,进样测定,记录峰面积。然后采用相对校正因子法和外标法分别计算8种人参皂苷类成分含量。结果,两种方法测得的西洋参破壁饮片中8种人参皂苷类成分的相对误差(RE)均小于3%,表明相对校正因子法与外标法差异不大,可对西洋参破壁饮片中上述8种成分进行准确定性和定量,见表8。
3 讨论
在中药质量控制和评价分析中,药效成分的含量是其重要的评价指标;而基于中药所含成分的复杂性,以多成分含量为质量控制指标的评价方法已被广泛应用[8,14]。
西洋参中活性成分多样,具有抗肿瘤、免疫调节等药理作用[5-6]。因其较为名贵,常将其制成破壁饮片,以有效地利用其药效成分。目前,2020年版《中国药典》(一部)以人参皂苷Rg1、Re、Rb1作为该饮片质量控制的指标,并采用外标法进行含量测定。但是,仅测定这3种成分,并不能全面反映西洋参的内在质量;且以外标法测定多成分含量时,所需对照品的价格较高,使用量也较大,操作条件的稳定性和进样量的重现性要求也较高。基于此,本课题组采用孙磊等[15]提出的“双标多测法”测定西洋参破壁饮片中8种人参皂苷类成分的含量。首先通过DRS Origin 软件对13根色谱柱采集数据拟合进而对色谱峰定位;确定双标化合物后,再用双标线性校正法预测目标化合物的保留时间,从而达到定性目的。定量方面则结合相对校正因子法,并以人参皂苷Re为参照物进行计算。同时,笔者还将相对校正因子法与常规外标法测得的含量结果进行对比。结果发现,利用双标多测法所测定的西洋参破壁饮片中人参皂苷Rg1、Re、Rb1、Rc、Ro、Rb2、Rb3、Rd的含量分别为10.59~12.78、2.160~2.768、27.492~38.880、3.154~4.018、3.368~4.080、0.343~0.755、 0.961~1.415、5.857~6.923 mg/g,且与外标法所测得的含量的RE均小于3%,表明两种方法含量测定结果无明显差异。
综上所述,所建立的双标多测法可对西洋参破壁饮片中8种人参皂苷类成分进行准确定性和定量,后续可为该饮片多指标成分综合质量控制和评价提供方法基础。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:136.
[ 2 ] 林红强,李平亚,刘金平.野生西洋参鉴别、化学成分及药理作用研究进展[J].天然产物研究与开发,2017,29(12):2157-2162.
[ 3 ] 于志博.西洋参茎叶二醇组皂苷酸降解产物的成分研究 [D].长春:吉林大学,2009.
[ 4 ] 李蕾,谢丽娟,王国明,等.人参、西洋参不同部位提取物中14种皂苷含量比较[J].人参研究,2018,30(3):11-13.
[ 5 ] 冯坤苗,孟洪涛,张强,等.西洋参茎叶中多糖提取优化及其抗病毒活性研究[J].辽宁中医药大学学报,2017,19(4):52-55.
[ 6 ] 张浩.人参活性成分蛋白质、氨基酸、有机酸及核苷类成分研究[D].长春:吉林大学,2016.
[ 7 ] 李飞鹤,苏静杰,赵建斌.中药破壁饮片的研究进展[J].当代化工研究,2018(11):174-175.
[ 8 ] 王智民,高慧敏,付雪涛,等.“一测多评”法中药质量评价模式方法学研究[J].中國中药杂志,2006,31(23):1925- 1928.
[ 9 ] 宋亚芳,王智民,朱晶晶,等.一测多评法测定吴茱萸中吴茱萸内酯、吴茱萸碱及吴茱萸次碱的含量[J].中国中药杂志,2009,34(21):2781-2785.
[10] GAO X Y,JIANG Y,LU J Q,et al. One single standard substance for the determination of multiple anthraquinone derivatives in rhubarb using high-performance liquid chromatography-diode array detection[J]. J Chromatogr A,2009,1216(11):2118-2121.
[11] HOU J J,WU W Y,DA J,et al. Ruggedness and robustness of conversion factors in method of simultaneous determination of multi-components with single reference standard[J]. J Chromatogr A,2011,1218 (33):5618-5622.
[12] 曹恒涛,鲁静,林瑞超,等.重楼药材中4种重楼皂苷含量测定的对照品替代方法研究[J].药物分析杂志,2011,31(9):1641-1645.
[13] 许佳,金红宇,孙磊,等.替代对照品法测定龙血竭原料中龙血素A和B的含量[J].药物分析杂志,2011,31(11):2058-2062.
[14] 逄瑜,孙磊,金红宇,马双成.替代对照品法在中药多指标含量测定中的应用与技术要求探讨[J].药物分析杂志,2013,33(1):169-177.
[15] 孙磊,金红宇,逄瑜,等.双标多测法Ⅰ-双标线性校正技术用于色谱峰的定性[J].药物分析杂志,2013,33(8):1424-1430.
[16] 王龙星,肖红斌,梁鑫淼.一种提高色谱指纹谱保留时间重现性的新方法[J].分析化学,2003,31(10):1232-1236.
[17] 陈蓉,张超,张华锋,等.双标线性校正法辅助色谱峰定性用于双黄连制剂的多组分分析[J].中国实验方剂学杂志,2018,24(8):40-48.
[18] 刘军玲,张亚中,等.双标多测法测定补骨脂中补骨脂苷、异补骨脂苷、补骨脂素、异补骨脂素的含量[J].药物分析杂志,2020,40(10):1799-1807.
[19] HE F C,LI S X,ZHAO Z Q,et al. Simultaneous quantitative analysis of four lignanoids in Schisandra chinensis by quantitative analysis of multi-components by single marker[J]. Yao Xue Xue Bao,2012,47(7):930-933.
[20] ZHU J J,WANG Z M,KUANG Y H,et al. A quantitative method using one marker for simultaneous assay of ginsenosides in Panax ginseng and P. notoginseng[J]. Yao Xue Xue Bao,2008,43(12):1211-1216.
[21] 王智民,錢忠直,张启伟,等.一测多评法建立的技术指南[J].中国中药杂志,2011,36(6):657-658.
(收稿日期:2020-12-23 修回日期:2021-04-12)
(编辑:唐晓莲)

