金黄色葡萄球菌抗生素耐药研究进展
蓝素桂,李治蓉,苏爱秋,彭燕鸿,廖燕科,刘雪梅,谭强
(广西中医药大学 药学院,广西 南宁,530200)
金黄色葡萄球菌(Staphylococcusaureus)为革兰氏阳性菌,广泛分布于自然界、动物和人的体表以及与外界相通的腔道中(如鼻腔等)[1],是医院内和社区感染的重要病原菌之一[2]。常见的S.aureus感染性疾病如毛囊炎、疖疮、脓疱、乳腺炎、伤口感染和葡萄球菌烫伤皮肤综合征等,而更严重的感染性疾病如菌血症、肺炎、心内膜炎、骨和关节感染以及中毒性休克综合征等[3]。前抗生素时代S.aureus菌血症患者的致死率超过80%[4]。20世纪40年代初,青霉素的发现极大地改善了S.aureus感染性疾病预后情况,但随着青霉素的广泛使用,出现了青霉素耐药菌株[5]。这些耐药菌株产生青霉素酶可水解青霉素β泛内酰胺环,导致青霉素失去活性。
耐药菌是指在长期的抗生素选择之后出现对相应抗生素产生耐受能力的菌株。细菌耐药性是指细菌多次与药物接触后,对药物的敏感性减小甚至消失,致使药物对耐药菌的疗效降低甚至无效。耐药菌株的出现增加了感染性疾病治愈的难度。耐青霉素酶的半合成青霉素甲氧西林于1959年应用于临床,到1961年JEVONS便首次发现了耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus, MRSA)[6]。MRSA感染从发现至今几乎遍及全球,易感人群也遍及所有年龄段[7]。
为解决不断出现的耐药性问题,科学家们对新型抗菌药物投入大量的研究,四环素、头孢菌素和其他天然的、半合成的和合成的抗菌素相继被开发出来[8]。而在大多数常见S.aureus感染性疾病发病率和死亡率得到降低的同时,出现十分严重的S.aureus抗生素耐药问题。根据ATLAS平台(https://atlas-surveillance.com/#/login)的抗生素耐药监测数据,总结分析2005~2018年全球S.aureus对抗生素产生耐药情况(表1),S.aureus几乎对所有抗生素都产生了不同程度的耐药性,这正是全球所面临的抗生素耐药的现状。

表1 2005—2018年全球S.aureus对抗生素的耐药情况
抗生素耐药增加了临床上S.aureus感染性疾病的治疗难度和风险,增加了患者因长期住院而产生的巨大经济负担,同时也增加了全球的卫生负担。另外,抗生素耐药也是S.aureus感染性疾病患者死亡率增加的重要原因。研究数据表明,在美国,超过80 000例侵入性感染和每年超过11 000例死亡是MRSA引起的[9-10]。预计到2050年,抗生素耐药性将导致约3亿人死亡,给全球经济造成高达100万亿美元的损失[11]。
本文主要对S.aureus的抗生素耐药机制、产生原因及对策进行综述,为抗菌药物的规范使用和减少抗生素耐药的新药研究提供理论指导,同时也为抗生素耐药性应对策略的制定提供一些新的思路。
1 S.aureus抗生素耐药机制研究
1.1 细胞壁相关的耐药机制
S.aureus细胞壁主要由肽聚糖骨架、四肽侧链和五肽交联桥组成。对于敏感型S.aureus,抗生素通过特异性地与细胞壁合成过程中五肽末端的D-Ala-D-Ala残基结合,阻碍S.aureus细胞壁合成过程中的转糖基或(和)转肽作用,抑制细胞壁合成,导致S.aureus无法生长或死亡,从而使抗生素发挥抗菌作用。而在耐药S.aureus中,通过增加D-Ala-D-Ala残基数量合成大量的肽聚糖,导致细胞壁增厚、形状不规则。L-谷氨酰胺在五肽桥上的酰胺化作用减少,使肽聚糖链的交联也减少,从而有更多的D-Ala-D-Ala残基与抗生素结合,结合后的抗生素进一步阻碍药物分子到达细胞膜上的作用靶点,最终形成对药物的抵抗作用,如图1-a所示[12-13]。此机制多见于S.aureus对糖肽类抗生素(如万古霉素、替考拉宁等)的耐药性。
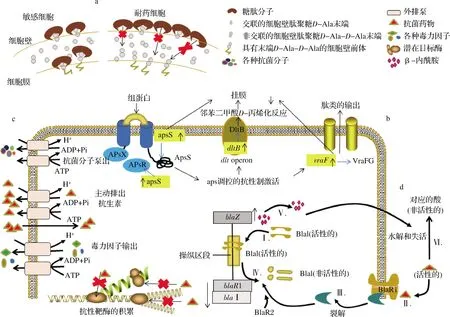
a-细胞壁相关的耐药机制;b-组蛋白传导系统作用机制;c.-多药外排泵;d-β-内酰胺酶的产生及其对青霉素的灭活过程
1.2 生物膜耐药机制
细菌生物膜的形成是抗生素治疗细菌感染性疾病失败的主要原因[14]。细菌生物膜对抗生素的耐药性通常是游离菌的10~1 000倍[15-16]。S.aureus生物膜的形成涉及到多种基因的表达和调控,S.aureus分泌的多糖胞间黏附素(polysaccharide intercellular adhesin,PIA)是其生物膜形成过程中细菌聚集阶段必须的也是最重要因子,PIA 合成主要由ica操纵子编码,具体包括icaR(调节基因)及串联存在的icaA、icaD、icaB、icaC基因[17]。
S.aureus生物膜耐药机制较复杂,且不同机制之间存在协同作用。分泌的胞外聚合物形成致密的天然屏障,阻碍抗生素向菌膜内部渗透,降低了菌膜内部药物浓度。同时,菌膜中的灭活酶可水解进入的抗生素,使抗生素失活[18]。另外,被包裹在菌膜深层的S.aureus细胞代谢速率减慢甚至进入休眠状态,因此菌株对繁殖期杀菌剂的抗性也会增强[19]。
S.aureus生物膜耐药机制及其相应的治疗药物在不断的进行研究。近年来研究发现,组蛋白对S.aureus生物膜具有活性。如图1-b所示[20],组蛋白与ApsS的负离子环结合,激活了编码aps系统传感器和调节蛋白的ApsS和apsR基因,vraFG转运基因介导的aps调控抗性机制被激活,从而对S.aureus生物膜产生活性。这研究结果对开发针对耐药菌株生物膜形式的抗菌药物具有重要意义。
1.3 外排泵耐药机制
外排泵也称外排蛋白,是细菌将胞内的药物或毒性物质排出胞外的蛋白转运系统,在外排过程中需要进行质子交换或水解ATP提供能量,如图1-c所示。外排泵耐药机制是引起S.aureus对四环素类抗生素产生耐药性的重要机制。外排泵的编码基因位于染色体或质粒中,外排泵通过作用底物诱导编码基因在耐药菌中超表达。根据外排泵氨基酸序列的同源性可分为ATP结合盒超家族(ABC)、主要易化子超家族(MFS)、多药及毒性化合物外排家族(MATE)、小多重耐药家族(SMR)和耐药节结化细胞分化家族(RND)。在S.aureus中,染色体或质粒编码的外排泵超过15个(图2)[2,21-22]。S.aureus对四环素类抗生素的耐药主要由MFS家族外排蛋白负责。Tet蛋白是MFS中研究最清楚的蛋白,由tet基因负责编码,可将四环素泵出胞外,降低了细胞内药物浓度,从而保护了胞内的核糖体,导致S.aureus产生耐药性[23-24]。

图2 S.aureus四类多药外排泵
1.4 产生灭活酶或钝化酶耐药机制
S.aureus可通过产生灭活酶或钝化酶,破坏各种抗菌药物(如四环素类、β-内酰胺类抗生素,包括半合成青霉素类和头孢菌素类等)使其失去活性。目前主要发现的灭活酶或钝化酶有β-内酰胺酶类、氨基糖苷类灭活酶、红霉素类钝化酶、氯霉素酰基转移酶等。β-内酰胺酶的产生及其对青霉素的灭活过程如图1-d所示[19],DNA结合蛋白Blal与操作区段结合,抑制了blaZ和blaR1-blal RNA的转录,在没有青霉素的情况下,β-内酰胺酶的表达水平较低。当青霉素存在时,青霉素与跨膜传感器BlaR1结合,刺激BlaR1自催化激活,激活的BlaR1直接或间接(通过另一种蛋白BlaR2)将Blal裂解成非活性片段,blaZ和BlaR1-Blal开始转录,导致青霉素的β-内酰胺环被blaZ编码的β-内酰胺酶水解,青霉素失去活性[19]。
氨基糖苷类修饰酶的失活是S.aureus对氨基糖苷类抗生素耐药的主要机制。在氨基糖苷类修饰酶中,乙酰转移酶(AAC)、磷酸转移酶(APH)和核苷酸转移酶(ANT)尤其是腺苷转移酶是临床重要的耐药相关酶。AAC以乙酰辅酶A为供体,乙酰化氨基糖苷类药物1,3,61,21位氨基,而APH和ANT均以ATP为供体,APH作用于氨基糖苷类药物的31位—OH和4位(潮霉素)、311位和6位(链霉素)—OH,ANT作用于氨基糖苷类药物211、41位—OH和311位、9位(大观霉素)使之磷酸化,从而使氨基糖苷类药物钝化[25-27]。
1.5 代谢途径、作用靶位改变耐药机制
代谢途径、作用靶点的改变也是S.aureus对抗生素常见的耐药机制。抗生素作用靶位酶的基因发生突变,会导致抗菌药物的作用降低,如 β-内酰胺类抗菌药物作用靶位改变。青霉素结合蛋白(PBPs)是细菌细胞膜的几种蛋白质分子与青霉素结合形成的相对稳定化合物,是β-内酰胺类抗生素的主要靶点。PBPs是细胞壁肽聚糖合成的必要酶,PBPs的改变是引起S.aureus对β-内酰胺类药物产生耐药性的主要原因。青霉素和头孢菌素的结构与肽聚糖末端结构D-丙氨酰相似,可以竞争性地与酶的活性中心共价键结合,抑制黏肽转肽酶所催化的交联反应,破坏S.aureus细胞壁的形成,从而引起溶菌作用,导致细胞裂解死亡。当PBPs发生基因突变时,β-内酰胺类抗生素与其目标PBPs之间的亲和力丧失,药物无法与作用部位结合,从而导致S.aureus耐药性的产生[28-29]。S.aureus对喹诺酮类抗生素主要耐药机制也是作用靶位的改变。喹诺酮类药物对S.aureus的主要作用靶点是DNA旋转酶,当S.aureus长期与药物接触的过程中抗药位点发生突变,降低了靶标(DNA旋转酶和拓扑异构酶IV)对喹诺酮类药物的亲和力,从而产生耐药[30]。该种耐药机制对抗菌药物特异性较差,使临床有效药物的选择难度加大。
2 S.aureus抗生素耐药产生原因分析
S.aureus耐药菌株的产生既是自然选择的结果,也是人为因素(如抗菌药物的使用)作用强化的结果(图3)。适者生存是自然界的法则,S.aureus势必会朝着有利于自己生存的方向进化。但随着抗菌药物的使用,耐药性变得越来越复杂。细菌获得的抗性基因可以通过遗传稳定地传递给下一代,甚至可以通过水平基因转移传播给其他细菌[31]。
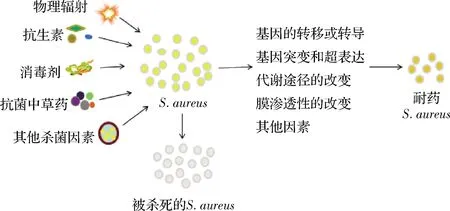
图3 S.aureus自然选择作用介导耐药产生示意图
2.1 自然选择结果
影响自然选择的因素有多种,比如细菌种群间的生存斗争,细菌个体与群体之间的斗争以及生存环境的斗争,包括阳光(紫外线等)、本身就具有良好杀菌或抑制微生物功能的物质(如部分带有特定基团的有机化合物、一些无机金属材料及其化合物、部分矿物质等)和天然抗生素(微生物分泌代谢产物)等。在各种因素的压迫下,细菌为了生存,不断发生变异改变自身的机能来适应其不断变化的生存环境。此外,细菌还可以通过质粒或转座子的水平转移获得其他物种的外源抗性基因,从而导致抗性变异的进一步发展。变异菌株再循环将这些特性遗传给下一代,下一代就有更多的具有抗性的个体,经过长期的自然选择,有些细菌就可以耐受生存环境中各种压迫因素的影响。S.aureus对抗生素产生耐药的原因之一是自然选择的结果。在没有使用人工合成抗生素之前,S.aureus在不断的自然进化中对不利于它生存的物质已有一定的抗性能力。青霉素、衣霉素等天然抗生素是一些特定的微生物为了生存竞争获得优势而分泌的次级代谢产物,以抑制其他微生物的生长。经过长期的接触,S.aureus对这些天然抗生素就产生一定的抗性,如野生型葡萄球菌对新生霉素的天然抵抗[32]。
2.2 抗生素使用引起
抗生素的不断开发及其过度使用甚至是滥用是S.aureus产生耐药性的重要原因[33]。临床上不必要或不适当的处方抗生素、坚持用抗生素治疗非细菌性感染、患者未按照处方完成整个抗生素疗程以及病人滥用抗生素等都是S.aureus对抗生素产生耐药性的重要原因。抗生素的广泛应用使S.aureus的适应能力比以往任何时候都要强大。一种新的抗生素被开发出来应用于临床上,对其耐药的S.aureus菌株很快就会产生。从第一种磺胺类抗菌剂到第一代抗生素(青霉素),以及后来的β-内酰胺类、大环内酯类、氨基糖苷类、四环素类、喹诺酮类等各种高效抗菌药物[34]抗生素的作用靶点从叶酸代谢过程(磺胺类),到细胞壁的生物合成(青霉素、磷霉素、衣霉素、雷莫拉宁、万古霉素等)、蛋白质的生物合成(四环素类、氨基糖苷类抗生素)以及DNA和RNA的复制(利福平、环丙沙星等)等已遍及S.aureus的整个生长繁殖过程(图4)[35]。S.aureus通过与抗生素作用靶点密切相关的变异过程而获得了耐药性。新型抗生素的开发速度已经赶不上耐药菌株产生的速度[36]。
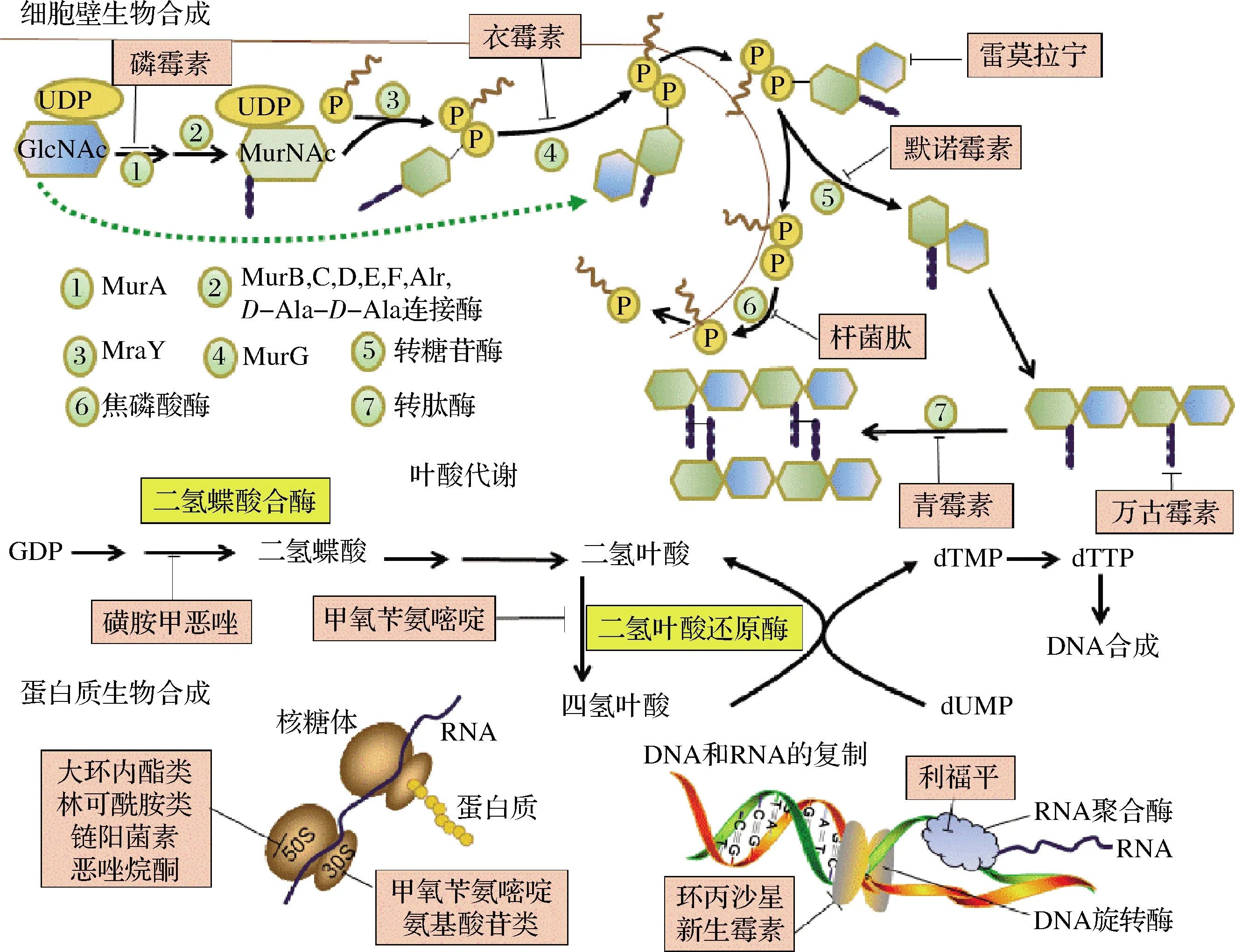
图4 S.aureus中抗生素作用靶点
2.3 消毒剂使用引起
消毒剂是抑制或杀灭传播媒介上病原微生物,使其达到无害化要求的化学制剂。消毒剂作为切断感染疾病传播途径、减少交叉感染的传统重要手段,在医疗卫生等众多领域得到了广泛使用。按其效果分类可分为高效消毒剂(如过氧化氢、二氧化氯、过氧化氢银离子消毒剂等)、中效消毒剂(如碘类消毒剂、酒精等)和低效消毒剂(如胍类消毒剂、季胺盐消毒剂等)3类。由于消毒剂不像药物般具有一定的专一性,往往是起到预防感染的作用而使用于公共物品或公共场所中,对整个自然环境微生物都有一定的作用,再加上消毒剂的处理不当甚至是滥用等问题,长此以往,S.aureus已经对消毒剂具有一定的适应能力,导致其对消毒剂敏感性下降甚至出现抵抗增强的现象。这种抵抗机理与抗生素耐药机制具有一定的相似性(如渗透屏障、外排作用等,如图5)所示[37],可导致细菌对抗生素出现交叉耐药现象。S.aureus对消毒剂敏感性降低的问题在很早以前就已经有报道,虽然目前消毒剂在适宜的浓度下仍然保持其杀菌的能力,但相关研究已发现,非致死浓度消毒剂能引起S.aureus对抗生素产生交叉耐药现象[38]。由此可见,消毒剂也是S.aureus对抗生素耐药性产生的重要原因。

图5 消毒剂抵抗与抗生素耐药性的关联示意图
2.4 抗菌中药使用引起
具有抗菌活性成分的抗菌中药在临床上的应用已有几千年的历史,由于其来源广泛,安全性高,毒性小,同时具有与化学药不同的抗菌机制,已成为细菌耐药性研究领域的热点。相比化学药来说,抗菌中药多为复方组分,各成分之间具有一定相互关系,通常表现为整体量效作用,而不是简单作用于某个单一的靶点,故一直被认为不容易产生耐药性[39]。抗菌中药和其他中药一样,它们的临床运用目的主要是通过调节患者机体内环境的平衡等产生疗效,而不是单纯地用来杀死病原菌。因此多数情况下,抗菌中药的临床处方用量往往没有达到病原菌的致死剂量,这导致整个疗程中,患者体内病原菌可能没有被杀死而使它们能够适应抗菌中药并出现对抗生素的交叉耐药。近期研究发现黄连能引起细菌对抗生素的交叉耐药和对消毒剂产生药物抵抗。另外,抗生素和消毒剂的使用同样能降低细菌对黄连的敏感性[40]。该实验结果说明,大量抗菌中药的药渣随意地排放至自然界,也是有可能诱导环境中细菌对抗生素产生交叉耐药。因此,抗菌中药的使用也是S.aureus对抗生素产生耐药的潜在因素。
总之,抗生素耐药性的产生可能是上述某种原因单独所致,但更多的是几种原因共同作用的结果,特别是抗生素交叉耐药性的产生。因此,细菌耐药性对策的制定和实施尤为重要。
3 细菌耐药性对策
包括S.aureus耐药在内的细菌耐药性对全球公共卫生造成严重威胁。为了应对这一持久的威胁,世界各国纷纷以尽量减少抗菌素耐药性的发展和传播、确保研究开发有效抗菌素为主要战略目标,制定了相关的国家行动计划,目前发布并实施的国家有74个,表2列出了部分国家主要战略目标。

表2 各国应对细菌耐药性的行动计划
各国抗菌药物的规范使用是抗击耐药性威胁的重要举措。抗生素和消毒剂是世界各国使用最多的抗菌药物,因此抗生素和消毒剂的规范使用对细菌耐药性的防控、耐药机制研究以及新型抗菌药物的开发都具有重大意义。各国在制定行动计划时也将抗菌药物的规范使用列为主要目标,如中国明确指出全国二级以上医院基本建立抗菌药物临床应用管理机制,使医疗机构主要耐药菌增长率得到有效控制。英国通过国家政策和指导来规范医生处方行为,要求医生不得给患有感冒,咳嗽、扁桃体发炎、咽喉痛等症状的非适应症患者开具抗生素处方。由于疾病种类及其复杂程度不同,就诊对象及需求也存在差异,因此还制定了多层次抗生素用药指南。
由于目前新型抗生素的研发处于瓶颈阶段,抗菌中药为预防和控制耐药细菌感染提供了新的思路,这对使用抗菌中药的国家来说是一个很好的机遇也是个重大的挑战。在中国,黄连、黄柏、鱼腥草、五倍子、金银花等一百多种抗菌中草药在S.aureus感染疾病的治疗中广泛运用。随着现代医药的发展,为满足患者的需求,很多中医院都设有中药代煎的服务,医院必定会因此而产生一定量的抗菌中药残渣,而针对抗菌中药残渣的处理目前尚未有一个统一的方法。医院本就是感染菌株的聚集地,如果抗菌中药残渣得不到有效的处理或随意丢到环境中,其残留的低于病原菌致死剂量的药物浓度存在诱导病原菌产生抗生素耐药的隐患。因此,抗菌中药的规范使用应该引起足够重视,需要制定出相关的政策规范抗菌中药的使用,使抗菌中药残渣得到有效处理。这也是应对全球耐药性威胁的重要策略。同时,包括中国在内的抗菌中药使用国家应该积极开展抗菌中药介导抗生素耐药的机制研究,为遏制细菌耐药性的进一步发展提供更加完善成熟的理论研究基础。另外,加大抗生素耐药机制研究的科研投入,充分了解耐药性产生的机制,特别是抗生素与消毒剂交叉耐药机制,是新药开发的前提。新一代的抗菌药物既要有效地抗击各类病原菌,又要有效地降低它们产生耐药的机会,这是新型抗菌药物研发的一个前所未有的重大挑战。
4 结语
细菌耐药性对全球人类健康构成了严重的威胁。目前对抗生素耐药机制、耐药原因及对策的深入研究已迫在眉睫。S.aureus对抗生素主要耐药机制有细胞壁结构改变、生物膜的形成、外排泵主动排出、产生灭活酶或钝化酶和代谢途径及作用靶位的改变等。而耐药性产生的原因既有自然因素,也有人为因素。人为因素包括抗菌药物(抗生素、消毒剂等)的过度使用甚至是滥用以及抗菌中药残渣不规范处理等。耐药性的产生加速了后抗生素时代的到来。为减少耐药性的出现,各国除了实施各自国家行动计划,规范抗菌药物的使用等策略之外,更需要加大对耐药性机制,特别是交叉耐药性机制研究的科研投入。另外,抗菌中药作为预防和控制耐药细菌感染的新资源,在规范其使用的同时,应加大抗菌中药对耐药菌逆转作用及其机制的研究,为新型抗菌药物的研发提供理论指导。总之,解决细菌耐药性问题需要全球人类共同努力与齐心奋战。

