乳腺癌新辅助化疗后钼靶下钙化的改变与临床病理特征和预后的关系
呼国庆,张欣,刘世浩,张保付
新辅助化疗(neoadjuvant chemotherapy,NAC)是乳腺癌治疗的重要手段之一,通过细胞毒性药物缩小肿瘤病灶体积,降低肿瘤临床分期,提高病理完全缓解率(pathological complete response,pCR),从而达到手术切除的目的[1]。目前,对乳腺癌NAC疗效的评价主要以乳腺超声、钼靶(mammography,MG)及MRI等影像学检查和术后病理学检查为主,其中乳腺钼靶能清晰显像乳腺腺体内的微小钙化灶。钙化是乳腺癌的一种主要征象之一,乳腺浸润性导管癌是由导管原位癌发展而来的,多数情况下浸润性导管癌和原位导管癌都是伴行的,原位癌及浸润性导管癌的X线检查结果中钙化较为常见,而伴有钙化的乳腺癌患者往往表现出较差的预后[2]。多项报道显示[3-4]乳腺癌NAC后乳腺钙化从形态、大小、密度等均有不同程度改变,且钙化的改变与病理特征及分子分型存在明显相关性,目前对伴有钙化的乳腺癌病理特征及分子分型之间的关系鲜有报道,本研究回顾性分析乳腺癌患者NAC后钼靶下钙化的改变与临床病理特征和预后之间的关系,为乳腺癌临床治疗和预后评估提供更多参考。
材料与方法
1.一般资料
本研究回顾性分析本院2012年1月1日-2016年1月1日乳腺外科收治的经病理确诊为乳腺癌患者74例,均为女性,并在本院接受NAC,年龄32~62岁,平均年龄(38.49±8.62)岁,临床分期Ⅱ~Ⅲ期,其中乳腺浸润性导管癌(invasive ductal carcinoma,IDC)62例,浸润性导管癌伴原位癌(ductal carcinoma in situ,DCIS)12例。纳入标准:①无放疗或化疗史;②钼靶检查均为单发钙化灶;③乳腺钼靶评估为乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)分级为4B~5级;④病理确诊为IDC或DCIS;⑤单侧乳腺癌。排除标准:①远处转移;②妊娠或哺乳期;③合并其他重大疾病;④既往存在精神疾病;⑤合并其他恶性肿瘤。本研究经本院医学伦理委员会批准。
2.检查方法图像分析
所有患者于NAC前、后行乳腺钼靶检查,应用全数字化钼靶X线乳腺摄影机及配套医疗系统,采用常规双侧乳腺轴位、内外侧斜位(MLO位)及头尾位(CC位)进行摄影,对常规检测未能显示清楚者进行局部加压放大摄影。
由两位具有丰富经验的副主任医师单独进行阅片,根据美国放射学会(American College of Radiology,ACR)制定的BI-RASD标准[5]对乳腺癌相关钙化情况进行诊断,结果不一致时,经讨论后达成一致。钙化分布分为区域性、弥漫性、乳腺腺叶区段性及簇样分布,钙化形态分无定型、微小圆形、细线分支状及多型不均质。采用测量方法对钙化面积和肿块在NAC前后进行测量,测量钙化面积与肿块的最大尺寸,并观察对比NAC前后钙化形态、大小及数目分布情况。
3.病理组织学判定标准
所有患者NAC前经空心针穿刺活检取病理组织标本,采用免疫组化学染色技术(immunohistochemistry,IHC)检测雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)、Ki-67的表达状态。ER、PR:肿瘤细胞核染色率≥1%以上为阳性,肿瘤细胞核染色率<1%为阴性;HER-2:肿瘤细胞核染色显示“”为阳性,“”原位杂交技术(fluorescence in situ hybridization,FISH)检测明确是否有基因扩增,基因扩增为阳性,无扩增为阴性,“-”及“+”为阴性。Ki-67:肿瘤细胞核染色≥14%为高表达,肿瘤细胞核染色<14%为低表达。参照St Gallen共识[5]对乳腺癌进行分子分型,分为Luminal A型、Luminal B型、HER-2型及三阴型。病理完全缓解(pathological complete response,pCR)定义为乳腺原发病灶及腋窝淋巴结均无浸润性肿瘤细胞残留。
4.化疗方案
NAC方案选取多西他赛联合表柔比星(TE),表柔比星联合环磷酰胺序贯多西他赛方案(EC-T),多西他赛联合表柔比星及环磷酰胺(TEC)方案,部分HER-2阳性者行多西紫杉联合卡铂及赫赛汀方案(TCH),患者行4~8个疗程后手术。
5.随访
本研究随访截止至2019年4月1日,随访方式以门诊复查、电话等方式进行,无病生存(disease free survival,DFS)事件定义为从手术时间到出现初次发生复发或远处转移及对侧乳腺出现恶性肿瘤的时间,总生存(overall survival,OS)事件定义为从手术至发生任何原因所导致死亡的时间间隔。
6.统计学分析
采用SPSS 20.0软件对本研究入组患者的临床病理数据进行分析和处理。采用卡方检验对临床资料的组间进行比较。采用Kaplan-Meier法绘制患者生存曲线,采用Log-rank检验比较生存率。以P<0.05为差异具有统计学意义。
结 果
1.乳腺癌临床病理因素与乳腺钙化的关系入选本次研究的74例患者行NAC后根据钙化改变状态分为三组,钙化无变化组46例、钙化减少组23例、钙化增加组5例,74例患者中获得pCR的患者共30例,pCR率为40.5%。三组患者在肿瘤大小、淋巴结状态、组织学分级、pCR率的比较中差异具有统计学意义(P均<0.05),但在年龄、ER、PR、Ki-67表达及病理类型等方面差异无统计学意义,见表1。

表1 乳腺癌临床病理因素与乳腺钙化的关系 (%)

表2 乳腺癌分子分型与乳腺钙化的关系
2.乳腺癌分子分型与乳腺钙化的关系
74例患者行NAC后Luminal A型获得pCR为4例,Luminal B为4例,HER2-扩增型为15例,三阴型为7例。钙化状态的变化与HER-2扩增型(P=0.014)及三阴型乳腺癌(P=0.027)患者的pCR率相关(P均>0.05);钙化状态的变化与Luminal A型及Luminal B型乳腺癌患者的pCR率无关,见表2。NAC前后达到pCR及未达到pCR患者的典型图像见图1、2。
3.乳腺癌NAC后钙化变化预后生存分析
本研究随访时间为13~71个月,中位随访时间为58个月。在随访期间74例患者中发生复发或转移的共10例,其中钙化无变化组6例,减少组0例,增加组4例,3 组DFS之间比较差异有统计学意义(P=0.001),见图3。三组患者发生死亡6例,其中钙化无变化组5例,减少组0例,增加组1例,3 组间OS差异无统计学意义(P=0.074),见图4。

图1 未达到pCR的患者。a) NAC前钼靶图像MLO位(箭); b) NAC前钼靶图像CC位(箭); c) NAC后钼靶图像MLO位(箭); d) NAC后钼靶图像CC位(箭)。 图2 达到pCR的患者。a) NAC前钼靶图像MLO位(箭); b) NAC前钼靶图像CC位(箭); c) NAC后钼靶图像MLO位; d) NAC后钼靶图像CC位。
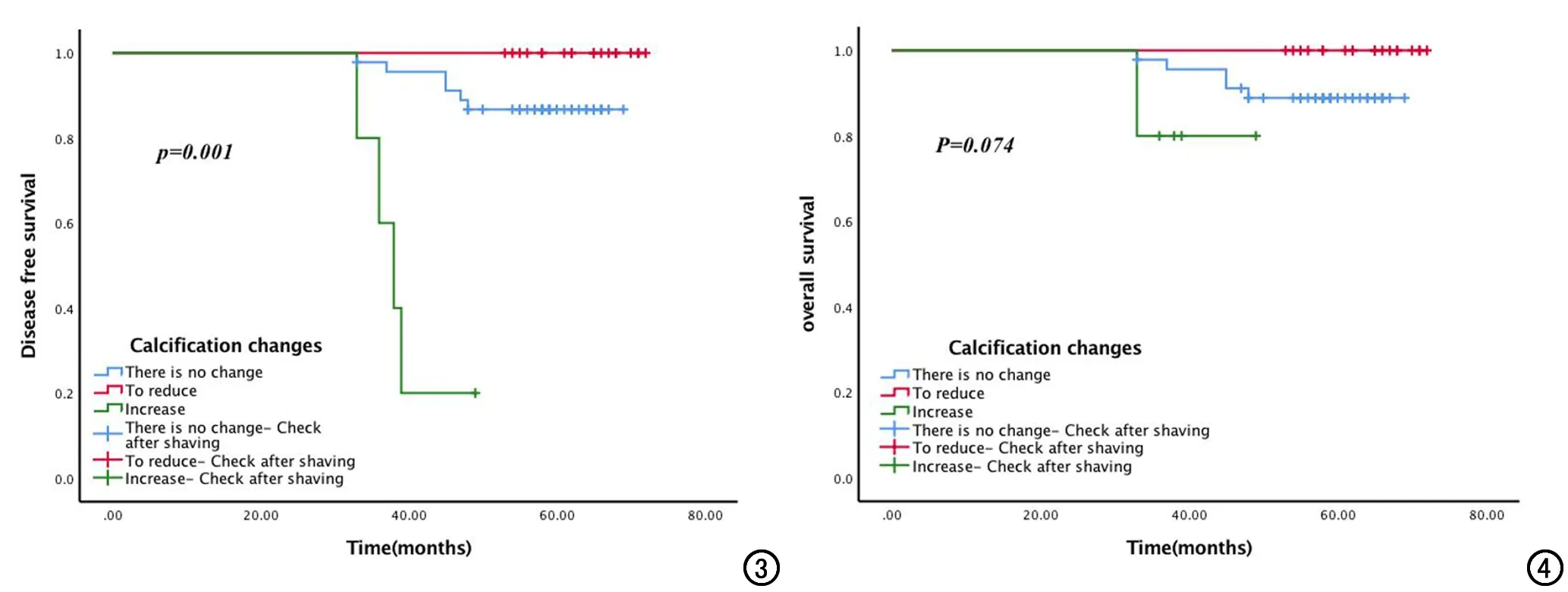
图3 三组患者NAC后无病生存比较。 图4 三组患者NAC后总生存比较。
讨 论
乳腺钙化是乳腺钼靶检查中最常见的影像学征象,乳腺钼靶能清晰分辨并显示乳腺钙化、结节、局部腺体致密度、腋窝淋巴结肿大及乳腺组织扭曲变形等征象,尤其对乳腺微小钙化灶具有较高的敏感性,相比超声和MRI,钙化检出率可高达96%[6]。NAC是治疗乳腺癌的重要手段之一,NAC后肿瘤病灶常发生液性坏死且体积无明显缩小或增大,临床常用的测量方法常显示病灶无变化,而乳腺钼靶可以清楚显示肿瘤病灶缩小程度及钙化、密度的改变变化,乳腺钼靶较传统临床触诊测量更为精准[7]。目前对于钙化的发生机制,现仍不完全明确,病理学认为乳腺癌钙化是由部分肿瘤细胞的活性增加、分泌及癌组织坏死导致组织中钙盐沉积相关,乳腺钙化多发生在终末导管癌腔中癌细胞变性坏死区或腺泡内小叶中,最易出现在导管原位癌及导管原位癌伴微浸润中[8]。多项报道显示[9-10]乳腺癌NAC后乳腺钙化在钼靶X线表现从形态、大小、密度等均有明显改变,Vinnicombe等[11]研究显示NAC后95例患者有44例钙化发生改变,其中钙化减少的患者占9%,不变占48%,增加占9%,其中钙化改变尤为明显的占34%,且钙化多存在于浸润性导管癌。Noguera等[12]对99例NAC乳腺癌的研究结果显示,10例患者在NAC后钙化发生改变,其中钙化增加的有2例,钙化减少的4例,钙化稳定的3例,1例失访,由此可见NAC后钙化会随之发生改变。
乳腺恶性钙化灶患者通常表现为肿瘤直径较大、组织学分级高、预后差等特点,肿瘤大小是决定乳腺癌TNM临床分期的一个重要指标,并且与无复发生存率及总生存率相关,肿瘤越大患者预后相对越差,NAC后肿瘤体积缩小钙化、形态、大小及密度也会随着肿瘤缩小而改变[13]。本研究结果显示肿瘤大小、组织学分级、淋巴结状态、pCR率与NAC后钙化的状态密切相关。近年来多项报道显示NAC后乳腺钙化的改变与病理特征及分子分型存在明显相关性,NAC后HER-2阳性及三阴型乳腺癌原发病灶更容易出现向心性退缩,向心性退缩使体内激素循环回流引起癌细胞催化加快肿瘤细胞增殖能力,增殖性越大对化疗药物反应约敏感,进而使肿瘤退缩模轻度变大,而Luminal A型、Luminal B型退缩模式则不明显,这可能是由于该类型表现为细胞凋亡率低[14-15]。Golan等[16]对进一步对钙化患者与分子分型之间的关系进行分析后发现,NAC后HER-2扩增型及三阴型较Luminal A、Luminal B型乳腺癌钙化减少比例及pCR率比例高,且钙化减少患者相比钙化无变化及钙化增加者更容易获得pCR,与本研究结果一致。本研究结果显示,钙化减少组pCR率明显高于钙化增加组及钙化无变化组(P<0.05),与钙化增加组及钙化无变化组相比,钙化减少组HER2-扩增及三阴型乳腺癌更容易获得pCR(P<0.05),而Luminal A、Luminal B型乳腺癌NAC后钙化改变不明显。由此表明NAC后钙化状态会发生改变,钙化减少者更容易获得pCR,且HER-2扩增型及三阴型pCR率高。
以往的研究分析中表明钙化可作为评估乳腺癌预后的一个指标[17-18]。Ling等[19]的研究显示伴有钙化乳腺癌患者比不伴有钙化乳腺癌患者更容易发生复发,复发率约是不伴有钙化乳腺癌的2倍,进一步分析发现钙化灶≥2cm是影响预后的不良因素。罗蕈[20]等研究显示乳腺癌钙化患者较非钙化患者有着较高的复发转移风险,3年DFS明显低于非钙化患者,OS则没有明显差异。先前的研究表明NAC后钙化范围、形态及密度均会发生改变,本研究通过对NAC后不同钙化表现的患者进行生存分析结果显示,NAC后钙化减少组患者DFS明显优于钙化增加组及钙化不变组(P<0.05),但三组患者的OS差异没有统计学意义,由此提示钙化可能是影响乳腺癌预后的因素。
综上所述,乳腺癌患者NAC后钙化状态会发生改变,钙化减少的患者更容易获得pCR,钙化灶改变与肿瘤大小、组织学分级、淋巴结状态、pCR率具有相关性,NAC后钙化改变在一定程度上可反映乳腺癌的生物学行为及预后。本研究存在一定局限性,首先本研究为单中心回顾性临床病理对照研究,样本量较小,另外,乳腺癌钙化的形成机制尚不完全明确,NAC后钙化变化是否能成为化疗疗效评价指标后续还需要进行大量病例研究。

