黄病毒入侵中枢神经系统的分子机制研究进展
陈浩威,崔旻
华中农业大学动物医学院/农业微生物学国家重点实验室,武汉 430070
黄病毒作为危害严重的人畜共患病病原,包括70多种病毒,由节肢动物传播(主要是蚊子和蜱虫),每年在全球约造成3亿人感染,威胁数百万人的健康,随着气候变化和全球交流的增加,黄病毒的传播在全球呈现扩大蔓延趋势,目前对于黄病毒引起的神经系统疾病并无特效药物和针对性的治疗方法[1-2]。主要流行的嗜神经黄病毒包括流行性乙型脑炎病毒(又称日本乙型脑炎,Japanese encephalitis virus,JEV)、寨卡病毒(zika virus,ZIKV)、西尼罗病毒(west nile virus,WNV)、登革病毒(dengue virus,DENV)、黄热病病毒(yellow fever virus,YFV)和蜱传脑炎病毒(tick-borne encephalitis virus,TBEV)。大多数感染者不出现在临床症状或仅出现自限性发热疾病,约有1%的严重病例会出现神经症状。一旦出现神经症状,致死率高达10%~30%,预后有30%~50%的幸存者伴随永久性的神经系统的后遗症[3]。
病毒通过蚊虫传播后首先感染角质形成细胞、朗格汉斯细胞、成纤维细胞、肥大细胞和单核细胞,随后在局部引流淋巴结大量增殖,最终迁移进入中枢神经系统(central nervous system,CNS),病毒在CNS复制可以造成神经元丢失、胶质增生、以及血管周围和脑实质的免疫细胞浸润等典型的病毒性脑炎现象。大部分黄病毒可以感染脑微血管内皮细胞(brain microvessel endothelial cells,BMEC),但不能直接诱导紧密连接蛋白(tight junction protein,TJP)的改变,增加血脑屏障(blood brain barrier,BBB)的通透性。BBB通透性的改变发生在病毒进入CNS之后,病毒在神经元和胶质细胞中复制触发的炎症反应是BBB破坏的主要诱因。本文主要针对神经嗜性的黄病毒进入CNS的途径和破坏BBB的方式进行讨论和总结,以便更好地了解黄病毒的致病机制,为更有效地防范黄病毒提供参考依据。
1 血脑屏障的结构及生理功能
BBB是循环系统和CNS之间的物理屏障,主要由内皮细胞、周细胞、星形胶质细胞和基底膜构成。中枢神经系统脉管内衬的BMEC通过TJP连接,BMEC位于大多数哺乳动物和其他生物体的CNS的大脑和脊髓的毛细血管中,是血脑物质交换的最大界面。周细胞投射出的手指状末足包裹毛细管壁,可以调节毛细管直径和脑血流量。此外,周细胞具有吞噬功能,有助于去除有毒代谢产物。星形胶质细胞是CNS的主要神经胶质细胞类型,其末端形成伪足投射在毛细血管内壁(约占脑毛细血管表面积的99%),参与不同的生理和生化任务:神经实质的区室化、维持细胞外空间的离子稳态、pH调节、通过向神经元提供能量底物来摄取和加工神经递质、从神经元到脉管系统的信号介导。星形胶质细胞参与神经系统的动态调节,在CNS炎症中发挥重要作用。基底膜是一层细胞外基质,包裹着毛细血管,进一步稳定BBB[4-7]。BBB主要的生理功能包括:(1)维持离子稳态和大脑营养的供给;(2)调节神经递质的水平,减少外周神经递质的“串扰”;(3)限制血浆大分子物质通过细胞旁路或扩散途径进入CNS;(4)限制细菌、病毒和其他病原体的进入,保护CNS免受病原菌的侵袭。BBB维持的微环境稳态是CNS发挥功能的结构基础。
2 黄病毒进入CNS的方式
黄病毒进入CNS有多种途径,其中包括:(1)血液中游离的病毒粒子直接感染BMEC后在基底侧释放,入侵CNS;(2)以特洛伊木马途径方式,由病毒感染的免疫细胞携带经细胞旁路或感染BMEC后进入CNS;(3)病毒感染外周神经系统(peripheral nervous system,PNS),通过轴突转运分别将病毒输送到脊髓和大脑;(4)病毒经血液转运到脑脊液(cerebral spinal fluid,CSF),进而感染CNS细胞[8-9]。病毒突破BBB进入CNS后,在神经细胞中大量复制导致神经元损伤和BBB的破坏,造成严重的神经系统疾病 (图1)[10]。其中,黄病毒经过CSF感染CNS途径的前提是病毒以前3种方式突破血脑脊屏障,因此,下文着重介绍前3种病毒进入CNS的方式。
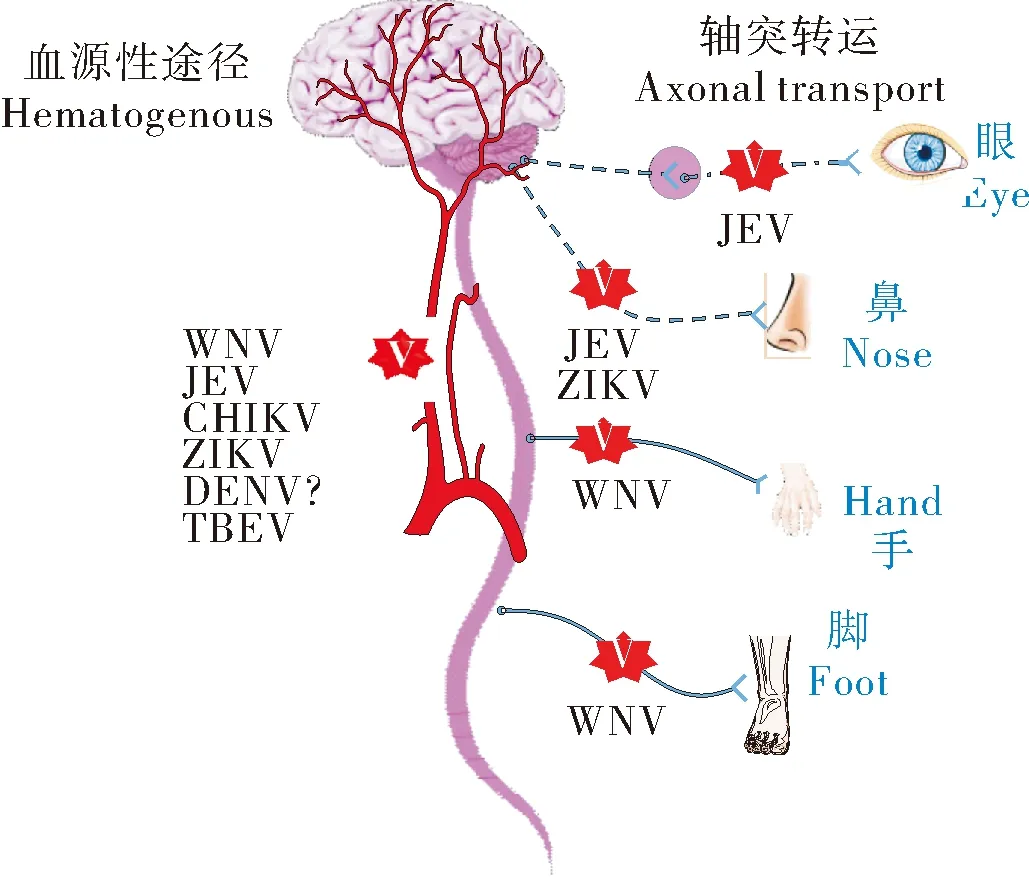
图1 黄病毒进入CNS途径
2.1 病毒感染BMEC直接进入CNS
黄病毒主要通过蚊虫叮咬皮肤表皮,感染角质形成细胞、朗格汉斯细胞、成纤维细胞等,在皮肤组织建立初级感染位点[11]。树突状细胞是黄病毒常见的初始靶标,被感染的树突状细胞迁移到淋巴样器官,在此病毒大量复制后进一步传播到其他系统。JEV、WNV、ZIKV可以在BMEC中建立感染,并不是所有黄病毒都可以感染BMEC[12-13], YFV虽然可以有效地感染内皮细胞,但是对BMEC的感染并没有确切的报道[14]。TBEV作为非蚊媒传播的黄病毒也被证实可以有效地感染原代人脑微血管内皮细胞(human brain microvascular endothelial cells,HBMEC)[15]。
JEV、WNV、ZIKV和TBEV在单独感染BMEC时,不会引起细胞的病理学变化[6,8,15]。在体外细胞实验中发现ZIKV在HBMEC中连续复制9 d,不产生细胞病变效应(cytopathic effect,CPE)[6]。在不同的BBB实验模型中证实了黄病毒感染BMEC后,感染性病毒颗粒由基底膜外侧释放进入CNS,因此血源性途径是黄病毒进入CNS最主要的方式[6,15]。有研究表明WNV单独感染BMEC后,虽然观察到Claudin-1的mRNA和蛋白质表达水平的下降,但BBB的通透性并没有增强[16]。几乎所有能够感染BMEC的黄病毒,单独感染均没有观察到单层BBB模型通透性的改变[6-7,13,17]。这些研究提示,黄病毒可以在BMEC中复制,释放病毒导致CNS的感染,但病毒复制本身并不是导致BBB破坏的主要原因。
2.2 病毒通过特洛伊木马途径进入CNS
黄病毒感染BMEC后,一般不会出现CPE,但可以激活BMEC,显著增加黏附分子和趋化因子的表达和分泌。有文献报道在单独感染状态下,BMEC表达的趋化因子和黏附分子足以招募循环的白细胞至内皮细胞并促进白细胞向脑实质的浸润[18-19]。
WNV在感染后可以观察到血管细胞黏附分子(vascular cell adhesion protein 1,VCAM-1)和E-选择素与WNV的复制动力学曲线保持一致的增加趋势。UV-WNV不会引起细胞黏附分子表达的增加,表明病毒复制是刺激黏附分子增加的主要原因[16]。WNV在感染原代神经元后可以诱导分泌型骨桥蛋白(osteopontin,OPN)的表达,OPN可以募集白细胞,通过依赖和非依赖的精氨酸-甘氨酸-天冬氨酸序列结合位于细胞表面的多种受体促进细胞黏附[20-22]。同样,活病毒而非热灭活或紫外线灭活的JEV处理BMEC后细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)及趋化因子CXCL1和RANTES的表达显著增加。用ICAM-1中和抗体预处理后,减少与中性粒细胞和PBMC与BMEC的黏附[23]。病毒感染后主要通过激活ERK/NF-κB、CREB和ERK/cPLA2/NF-κB、CREB途径诱导ICAM-1、CXCL1和RANTES等分子的表达,其中ERK是关键激酶[24]。另外,虽然WNV感染内皮细胞会上调表达CXCL12,但CXCL12的表达限制在基底膜外侧内皮表面,会阻碍T细胞转运进入CNS[25]。ZIKV的PRVABC59株、MR766株和PE243株均能感染HBMEC,诱导IL-6和RANTES的产生,有助于炎症细胞的募集和活化[26]。ZIKV感染HBMEC后,晚期糖基化末端受体(receptor for advanced glycation end products,RAGE)的表达量上调。RAGE属于多配体受体,现已发现的RAGE配体有糖基化终产物、高迁移率族蛋白-1 (high mobility group box-1,HMGB1)、S100和钙粒蛋白。RAGE主要参与炎症反应、肿瘤生长、细胞迁移及神经元分化等多种生理和病理过程[27]。ZIKV感染也会诱导神经元sOPN的表达增加[28]。
一些病毒可以感染外周免疫系统的白细胞,白细胞可以携带病毒进入CNS,这种途径常被称为特洛伊木马途径[29]。在病毒感染激活HBMEC之后,募集白细胞至HBMEC表面,被感染的白细胞不仅可以通过细胞旁路进入CNS,而且一些细胞释放的蛋白酶类也可以破坏BBB的完整性。JEV感染可以激活肥大细胞,导致其释放与脱颗粒相关的糜蛋白酶,该酶可以直接切割ZO-1、ZO-2、Claudin-5和Occludin上的特定位点[30-32],或活化其他蛋白酶如MMP2和MMP9[31],增强JEV诱导的TJP的裂解和BBB的破坏,抑制糜蛋白酶可逆转BBB泄漏,降低感染期间的脑部病毒载量和减轻神经功能障碍[33]。 JEV或登革病毒(DENV)感染的情况下,肥大细胞感染后会在周围组织中引起明显的血管渗漏和水肿加速病毒的清除[34]。ZIKV可以有效感染人急性单核细胞白血病细胞(MonoMac-1,MM-1)。MM-1感染后趋化因子受体CCR7表达增加,利用趋化实验可以观察到MM-1对CCL-19的反应增强。但对于单层BBB模型只有在LPS刺激和ZIKV感染同时存在的情况下,MM-1迁移才会增强,表明MM-1对于BBB的迁移依赖于炎症的存在。在ZIKV感染MM-1后引起HMGB1释放到细胞外增加其在微环境中的积累。ZIKV感染的MM-1与HBMEC共培养,可以观察到TJP的表达改变,BBB的通透性增加[27]。WNV可以感染多形核中性粒细胞(polymorphonuclear neutrophil,PMN),在WNV感染小鼠模型中,PMN占白细胞总数的75%。同时,在具有神经症状的临床病例中CSF中性粒细胞显著增加。因此,携带WNV的PMN细胞可能在将病毒运输到CNS中起重要作用,从而促进了WNV对神经系统的侵袭,加重疾病的严重程度[20,22]。
2.3 病毒通过轴突转运进入CNS
病毒也可以通过轴突运输的方式进入CNS[35]。嗅觉神经和视神经是黄病毒轴突转运的主要途径。嗅觉神经主要由嗅觉受体神经元(olfactory receptor neuron,ORN)组成,连接鼻腔与CNS。病毒可以感染ORN沿轴突进入CNS,此外ORN与CSF的连接通道是开放的,可以允许高达100 nm的粒子经此途径进入CNS[36]。有报道称,基孔肯雅病毒(chikungunya virus,CHIKV)、WNV、JEV等病毒粒子可以通过这条途径进入CNS。使用JEV强毒株对3周龄的仔猪进行鼻内接种,诱导了非化脓性脑炎,可观察到小胶质细胞结节,整个嗅道梨状皮层形成血管袖套,在嗅球颗粒细胞层的神经细胞中检测到JEV抗原,从嗅球到CNS其余部分的传播路径目前尚不清楚[37]。
另外,通过结膜途径也可以建立小鼠感染模型,小鼠感染后出现特征性临床症状,在视网膜内核层的双极细胞和神经节细胞中发现了JEV抗原信号,提示了病毒粒子进入的可能路径,沿神经节细胞的轴突纤维经视神经交叉至大脑中部,或沿一些视神经纤维进入脑干区域[38]。这些结果表明,在一定条件下黄病毒可能会在无载体的情况下,通过口、鼻、眼、黏膜表面感染动物机体进行传播。这可能是今后在疫情防控中需要注意的问题[39-40]。
在小鼠和恒河猴的动物模型中已经确定WNV感染外周神经后先沿着特定的运动神经元在轴突顺行和逆行方向传播。在恒河猴模型中,超微结构分析证实WNV可以感染小脑皮层浦肯野细胞和脊髓腹角运动神经元,但在大脑皮层、基底神经节、丘脑、脑桥和延髓中并没有检测到病毒粒子[41]。在WNV引起的临床症状中,急性弛缓性麻痹可以独立于脑炎或脑膜炎发生,感染患者中神经系统疾病发病率在10%~50%,远高于病毒性脑炎的发病率[42]。病毒在PNS建立感染后,在轴突传播过程中绝大部分在进入CNS之前被免疫系统清除,不能进入CNS导致中枢神经系统疾病。
圣路易斯脑炎病毒、CHIKV、TBEV在实验条件下感染模型动物,也可以观察到以轴突传播的方式引起神经退行性疾病,但相关途径没有临床报道支持[43]。
3 血脑屏障的破坏
通常由病毒复制或神经炎症引起的内皮细胞通透性增加导致的BBB破坏是中枢神经系统感染的标志[44]。Morrey等[45]认为BBB的通透性增加是黄病毒感染导致的致死性病例的主要诱因。现有的研究表明黄病毒感染内皮细胞不足以破坏BBB,BBB通透性的改变发生在病毒进入CNS后或是病毒在外周感染引起的炎性因子作用于内皮细胞和周细胞导致的。
JEV、ZIKV和WNV不仅可以感染内皮细胞,而且可以感染组成BBB的其他细胞以及CNS的固有细胞如周细胞、星形胶质细胞、小胶质细胞和神经元。这些细胞被激活后释放大量的炎性因子和抑炎因子,如IL-6、TNF-α、IFN-γ、IL-1β、IL-10、IL-4、MMP2/3/9等,作用于紧密连接或基底膜导致BBB的通透性增加[44,46-47]。通常病毒首先激活小胶质细胞,然后炎症信号被星形胶质细胞进一步放大,星形胶质细胞作为CNS数量最多的支持细胞,是炎性因子的主要来源[45]。
在体外实验中利用黄病毒感染周细胞、星形胶质细胞、小胶质细胞或神经元,收集细胞培养上清来处理体外单层BBB模型,也可以发现Claudin-5、Occludin和ZO-1的表达明显降低或发生重排,BBB的通透性增加[45-46]。在使用感染动物模型的脑组织匀浆上清处理BBB模型时也观察到类似的变化(图2)。
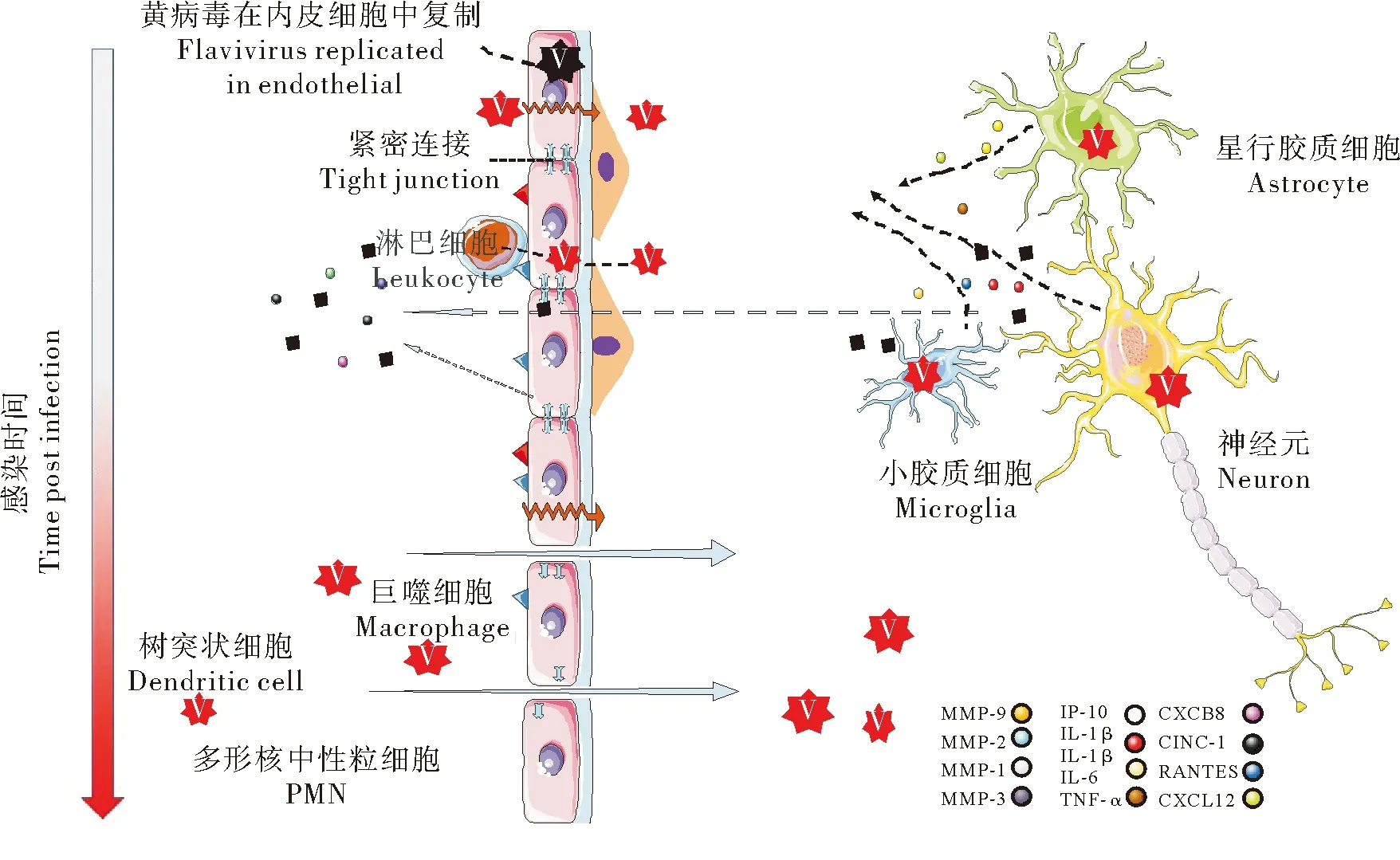
图2 黄病毒破坏BBB的方式
3.1 基质金属蛋白酶对血脑屏障的作用
基质金属蛋白酶家族(matrix metalloproteinases,MMPs)是一个超过25个成员的蛋白酶超家族。在生长发育过程中,MMP可以促进神经元生长,成年人的中枢神经系统中,大多数MMP的表达水平较低。黄病毒感染CNS后,在CSF中可以检测到MMP1/2/3/9的表达增加[48-50]。MMP来源于浸润的白细胞(淋巴细胞和巨噬细胞)和CNS的细胞(胶质细胞是MMP的主要细胞来源)[48]。病毒感染诱导MMP表达的具体机制已有文献报道:JEV刺激RBA-1通过p42/p44 MAPK、p38 MAPK和JNK1/2介导NF-κB活化,诱导MMP9表达;JEV可以通过ROS/c-Src/PDGFR/PI3K/Akt/MAPKs依赖的AP-1途径在大鼠脑星形胶质细胞中诱导MMP9表达,MMP9基因在不同细胞类型中的表达受不同MAPK的调控[51-52]。MMPs对细胞外基质的重塑功能已经有较为经典的解释[53]。MMPs破坏了围绕脉管系统的基底膜,并导致BBB受损。MMPs在溶解基底膜之外还可以作用于BMEC减少ZO-1、Occludin、Claudin-5的表达从而进一步增加BBB的通透性[54],被激活的白细胞也可以表达MMPs,促进其进入CNS。CNS中的MMPs可能还具有一定的神经毒性,Vos等[55]发现MMP1在体外对脊髓神经元具有毒性,同时发现MMP2表达升高,可以导致神经元死亡。与野生型小鼠相比,MMP9敲除小鼠对感染的抵抗力更高,在外周循环系统中表现出相同的病毒血症和相似水平的炎症细胞因子,但是MMP9敲除小鼠的脑组织呈现较低的病毒载量,BBB通透性更低,以及白细胞浸润程度和CNS炎性因子水平的降低[56]。
3.2 干扰素对血脑屏障的作用
3种类型的干扰素均可影响黄病毒进入CNS的过程。研究表明,Ⅰ型干扰素信号在被激活后,可以通过免疫调节限制病毒的复制及传播,或者直接作用于内皮细胞增强BBB的屏障功能;Ⅲ型干扰素增强BBB屏障功能也依赖于Ⅰ型干扰素信号。在WNV的存在下,Ⅰ型干扰素通过作用于GTPases Rac1和RhoA直接调节TJP的形成,而且还可以通过抑制TNF-α和IL-1β间接降低内皮细胞通透性[57]。在动物模型中,WNV外周接种或颅内接种后,Ⅰ型干扰素信号传导的减弱导致BBB通透性增强,并伴有相关的TJP破坏。TBEV感染小鼠星形胶质细胞通过上调Ⅰ型干扰素引发了快速的干扰素效应基因反应,从而限制了病毒的复制和传播[58]。
在体外BBB模型中,IFN-γ或IL-17A可以在30~60 min内打开BBB[59]。IFN-γ促进Rho激酶活性,诱导BMEC中肌动蛋白细胞骨架收缩,牵拉ZO-1使相邻内皮细胞膜之间空隙增大,从而导致血管连接紊乱和细胞分离。ROCK激活肌球蛋白轻链(myosin light chain,MLC)的磷酸化以及随后的MLC磷酸酶的失活诱导细胞骨架收缩[60]。尚不清楚在IFN-γ启动条件下ROCK使MLC磷酸化直接发挥作用还是使MLC磷酸酶失活间接发挥作用[61]。IFN-γ也可以通过影响周细胞的状态间接破坏BBB,IFN-γ通过增强血小板衍生生长因子(PDGF-BB)激动剂诱导的受体的降解,降低周细胞依赖PDGF-BB的增殖以及降低周细胞中的细胞代谢率。中和IFN-γ可以减弱病毒感染期间BBB的渗透性的增加[62]。
大量研究表明IFN-λ可以限制病毒的感染,但其抑制机制仍不明确[63-64]。研究显示IFN-λ处理并不影响WNV在细胞内的复制和活性,且IFNLR1-/-小鼠对WNV感染产生正常的适应性免疫应答。在WNV感染情况下,IFNLR1-/-小鼠BBB通透性增加。用聚乙二醇化的IFN-λ2处理小鼠可降低BBB通透性,减少脑中的WNV载量,提高感染的小鼠的存活率。BBB的体外模型表明,IFN-λ增强BMEC的屏障功能,WNV感染后IFN-λ生物学功能需要IFN-α/β信号传导,而不是通过由模式识别受体信号传导。循环的IFN-λ结合BMEC上的受体,通过非依赖STAT1的方式,增强BBB屏障功能限制病毒对中枢神经系统的侵袭[65-66]。在YFV感染中可以同样证实IFN-λ的信号传导在维持BBB的完整性和预防病毒脑部侵袭中发挥关键作用[67]。与WNV感染不同的是,在YFV-17D感染期间,Ⅲ型IFN信号传导会影响外周血淋巴细胞亚群的比例,IFN-λ信号传导的受损会抑制T细胞活化。同样肯定的是Ⅰ型干扰素信号通路在IFN-γ作用过程中发挥重要作用。来自WT、IFNLR-/-和IFNα/βR-/-小鼠在感染后BBB对埃文斯蓝的渗透性没有发生显著改变,但IFNα/βR-/-、IFNLR-/-双缺失小鼠BBB渗透性则显著增加[68]。IFN-λ激活p38-MAK导致肌动蛋白的重排和细胞形态发生改变,进而介导内皮细胞通透性升高,F/G-actin的比例变化可能在其中发挥重要的调节作用[69]。
3.3 其他因素
在黄病毒所致的神经系统疾病中,不同的细胞因子在BBB的破坏过程中发挥了不同作用。JEV感染可以刺激星形胶质细胞大量表达IP-10,IP-10通过激活星形胶质细胞CXCR3-JNK-c-Jun 信号通路并介导TNF-α上调表达。因此,IP-10间接通过TNF-α影响了BMEC中TJP的表达和细胞内分布,并导致JEV感染期间BBB损伤[70]。使用IL-17A刺激bEnd.3细胞可以增加IL-17A受体、Occludin和Claudin-5的表达,以及MMP-2/9表达增加[71],在CNS炎症期间,IL-17A也可以刺激CNS细胞生产促炎性细胞因子和趋化因子[72-73]。IL-6/SIL-6R复合物可以通过STAT-1α的磷酸化诱导ICAM-1和VCAM-1在内皮细胞和HepG2细胞上调表达,但在星形胶质瘤细胞和原代星形胶质细胞中IL-6/sIL-6R不能激活STAT-1α,观察不到ICAM-1和VCAM-1上调表达[74-75]。
关于TNF-α、IL-1β在内的多种炎性细胞因子破坏BBB完整性的现象,已经被大量试验和临床病例证实,然而具体机制目前并没有完全阐明[57,76-77]。
4 展 望
黄病毒引起的神经系统疾病仍然是困扰人类健康的严重的公共卫生问题,尽管学者们已经对黄病毒致病机制行了广泛研究,但也存在很多未解决的问题和研究的局限性。大多数关于黄病毒感染和BBB破坏对神经侵袭和疾病作用的研究是在体外或在小鼠实验模型中进行的。野生型成年小鼠通常能够控制黄病毒的全身感染,不表现神经系统症状,对于ZIKV和DENV侵袭CNS的研究实验模型仅限于颅内接种或在免疫缺陷和哺乳期小鼠中进行。这不能真实反映在CNS损坏之前病毒与机体的相互作用。在自然状态下大部分为无症状感染者(70%~80%),虽然小鼠模型和体外模型可以模拟与人类相似的神经病理状况,但研究忽略了促进神经侵袭过程的机制的研究,即黄病毒在感染过程中如何由外周转向神经系统,将病毒最大限度地限制在外周并清除是研究黄病毒神经侵袭过程的意义所在。一些研究将其归因于不同毒株的神经侵袭性潜能与个体免疫系统之间的差异,但现有的动物模型不能体现这些差异性的存在,主要原因是啮齿动物模型和体外模型的单一性,在病毒血症和CNS感染特征等方面不能替代宿主。
现在已经有很多新的模型和技术运用到黄病毒穿越BBB进入CNS的研究中,体外BBB模型经过2D内皮细胞连接发展到3D脑微环境、动态灌注模型、微流控模型以及BBB芯片模型等[78-80]。基于系统生物学的方法,如RNA测序、蛋白质组学、脂质组学、代谢组学和计算机建模等运用到BBB研究中,BBB新的体外模型的结构和功能方面都更加接近BBB的生理状态,使我们可以更全面地了解病原体侵袭CNS的过程以及黄病毒感染的致病机制。

