泥鳅cyp19a1基因克隆及其在倍性间的表达差异
曹文怡,易少奎,杨楠,苏君晓,罗双双,高泽霞,周小云
1.华中农业大学水产学院/农业动物遗传育种与繁育教育部重点实验室,武汉 430070;2.湖州师范学院生命科学学院,湖州 313000
作为脊椎动物中分布最广、种类最多的一个类群,鱼类的性别决定机制有着原始性、多样性以及可塑性等特点,同时存在雌雄异体、雌雄同体和单性群体等性别决定类型。但无论是哪种性别决定类型,其下游的性别决定因素却都是相当保守的,尤其是芳香化酶(aromatase),可以催化雄激素转化为雌激素,从而控制性腺发育甚至影响性别决定[1]。细胞色素P450芳香化酶(P450arom)是由cyp19a1基因编码产生的。硬骨鱼类中存在2种cyp19a1基因亚型:cyp19a1a和cyp19a1b。cyp19a1a主要在性腺中表达,因此其编码产物称为性腺型芳香化酶(P450aromA);cyp19a1b则主要在脑中表达,其编码产物称为脑型芳香化酶(P450aromB)[2]。近年来的研究发现,cyp19a1a及其催化产生的雌激素不仅在卵巢分化与维持的过程中起到决定性的作用,而且在精巢的分化中也起到了关键性的作用,cyp19a1a上调对触发和维持卵巢分化是必需的,而cyp19a1a的下调则是诱导精巢分化的一个必不可少的环节[3-4]。而cyp19a1b及其催化产生的雌激素与中枢神经系统发育期间的神经内分泌功能、性行为和性别分化密切相关[5]。此外,有研究发现,cyp19a1b还可能对鱼类精巢的发育有重要的促进作用[6]。
芳香化酶及其催化产生的雌激素,还可以通过GH-IGF通路调节鱼类的生长发育。比如,雌二醇可以调节虹鳟(Oncorhynchusmykiss)[7]、莫桑比克罗非鱼(Oreochromismossambcus)[8]、黄鲈(Diploprionbifasciatum)[9]中GH-IGF通路相关基因的表达水平,进而影响生长。
我国的野生泥鳅(Misgurnusanguillicaudatus)不仅有二倍体,在长江流域还有大量的天然四倍体[10]。四倍体泥鳅的体型明显大于二倍体,具有显著的生长优势[11]。通过诱导雌核发育和雄核发育,研究人员发现,这些四倍体泥鳅是由二倍体泥鳅通过染色体加倍产生的[12]。天然四倍体泥鳅是我国特有的、非常珍贵的种质资源[13],不仅为泥鳅优良品种的培育提供了理想的原材料,还是研究多倍体脊椎动物的生物学和遗传学等的理想模型。鉴于cyp19a1既能调控鱼类的生殖发育,又能影响鱼类的生长代谢,因此,研究其在二倍体、四倍体泥鳅间的表达特点,可能对了解泥鳅倍性间生长和生殖差异有一定的参考价值。近期,笔者所在课题组发现,四倍体泥鳅的生殖发育明显滞后于二倍体,在相同的养殖环境下,二倍体泥鳅1龄即可性成熟并开始繁殖活动,而四倍体泥鳅2龄以后才能达到性成熟。我们推测,四倍体泥鳅的生长优势可能与其相对较晚的生殖发育有关。
本研究中,我们选择12月龄的二倍体、四倍体泥鳅为研究对象,克隆获得了泥鳅的cyp19a1a基因cDNA序列和5′侧翼序列,并分析cyp19a1在泥鳅组织间和倍性间的表达特点和差异,研究其与泥鳅倍性间生长和生殖差异中的相关性,进而探讨四倍体泥鳅性腺发育较晚的分子机制,以期为鱼类生长和生殖的调控关系提供理论依据。
1 材料与方法
1.1 试验鱼来源
以野生二倍体、四倍体泥鳅为亲本,通过人工繁殖获得子一代,将其在相同环境下养殖,随机选取12月龄的二倍体、四倍体雌雄个体各9尾用于本研究。
1.2 DNA和RNA的提取和检测
将试验鱼用MS-222(100 mg/L)麻醉,测量体长、体质量后,分离脑、性腺、肌肉及肝脏,在液氮中速冻后置于-80 ℃冰箱中保存。用醋酸铵/异戊醇法提取各组织的DNA,用Trizol法提取RNA,分别用1%琼脂糖电泳和紫外分光光度计(NanoDrop 2000,USA)检测提取DNA和RNA的完整性和浓度。将每3个个体的RNA等量混合作为1个样本用于后续的基因表达分析。
1.3 cyp19a1a基因的全长CDS和5′侧翼序列克隆
基于笔者所在课题组前期对泥鳅全长转录组测序获得的cyp19a1a部分cDNA序列(GenBank accession No. AB531496.1),分别设计5′RACE和3′RACE引物(表1),按照试剂盒(TaKaRa,Japan)的说明分别克隆其5′-UTR和3′-UTR序列,PCR产物经胶回收、纯化、连接、转化、阳性克隆鉴定后,送武汉擎科生物技术有限公司测序。测序结果经比对确认无误后,用DNA Star软件拼接得到cyp19a1a基因的全长CDS序列。
基于拼接获得的全长CDS序列,采用高效热不对称PCR(high-efficient thermal asymmetric interlaced PCR,hiTAIL-PCR)技术扩增泥鳅cyp19a1a的5′侧翼序列。具体方法为:将泥鳅cyp19a1a的CDS序列与斑马鱼的序列比对推测其第一外显子序列,然后在第一外显子序列上设计3条嵌套的特异性引物(special primer,简称SP1,SP2,SP3)作为下游引物,用Liu等[14]的LAD1-5长随机简并引物(longer arbitrary degenerate primer)作为上游引物(表1)进行连续3轮PCR扩增。其中,第1轮PCR以泥鳅基因组DNA为模板,用SP1特异性引物与LAD1-5兼并引物组合进行扩增;然后将第1轮扩增产物稀释40倍作为第2轮PCR模板,用SP2与AC1组合扩增;随后将第2轮扩增产物稀释10倍作为第3轮PCR模板,用SP3与AC1进行扩增。第3轮PCR产物经胶回收、纯化、连接、转化、阳性克隆鉴定后,送武汉擎科生物有限公司测序。测序结果经人工检查确认无误后,用DNAStar软件拼接得到cyp19a1a基因的5′侧翼序列。
1.4 cyp19a1a基因CDS和5′侧翼序列的生物信息学分析
对克隆获得的CDS序列,用BioXM 2.6导出氨基酸序列,用SWISS-MODEL(https://swissmodel.expasy.org/)预测蛋白质的三级结构,用SMART(http://smart.embl-heidelberg.de/)预测蛋白质的保守结构域,用PROSITE(https://prosite.expasy.org/)预测蛋白质的功能域。然后用Clustal W(2.0)(https://www.ebi.ac.uk/Tools/msa/clustalo/)将泥鳅cyp19a1a基因编码的氨基酸序列与其他物种进行同源性比对。用MEGA X的邻位相连(neighbor-joining,NJ)法,将泥鳅cyp19a1a基因编码的氨基酸序列与其他脊椎动物的氨基酸序列进行比对,构建系统进化树。
用在线软件NNPP(http://www.fruitfly.org/seq_tools/promoter.html)预测cyp19a1a基因5′侧翼序列的核心元件(promoter core element,PCE)和转录起始位点(transcript start site,TSS),用AliBaba 2.1(http://gene-regulation.com/pub/programs/alibaba2/index.html)和Cister(https://zlab.bu.edu/~mfrith/cister.shtml)预测5′侧翼序列上潜在的转录因子结合位点。
1.5 cyp19a1在二倍体、四倍体泥鳅间的表达差异分析
根据克隆获得的cyp19a1a的CDS序列,用Primer 5.0软件设计cyp19a1a的qRT-PCR引物。为了解cyp19a1b与cyp19a1a的表达差异,本研究根据全长转录组测序获得的cyp19a1b部分CDS序列,设计qRT-PCR引物,并用泥鳅的β-actin序列(AB200265.1)设计内参引物(表1),比较cyp19a1b与cyp19a1a在泥鳅组织间和倍性间的表达差异。
将提取的总RNA用PrimeScript RT reagent Kit With gDNA Eraser试剂盒(TaKaRa,Japan)反转录为cDNA。然后用SYBR Premix Ex TaqTM试剂盒(TaKaRa,Japan),以二倍体、四倍体泥鳅各组织的cDNA为模板,在ABI 7500 FAST Real-Time PCR System(Applied Biosystems,USA)上检测cyp19a1a和cyp19a1b的表达水平。用2-ΔΔCt方法计算基因的相对表达量。
1.6 数据分析
用SPSS 19.0软件对数据结果进行统计学处理,用单因素方差分析(one-way ANOVA)以及Duncan’ s多重比较进行显著性检验分析,P<0.05为差异显著,用Origin 9.0软件作图。

表1 泥鳅cyp19a1克隆和表达分析所用的引物 Table 1 Primers used for cloning and expression analysis of cyp19a1 gene in M. anguillicaudatus
2 结果与分析
2.1 泥鳅cyp19a1a基因的CDS序列特征
泥鳅cyp19a1a基因的cDNA序列全长为1 905 bp,包括29 bp的5′UTR序列、301 bp的3′UTR序列和1 575 bp的ORF序列,编码524个氨基酸的蛋白质,序列特征如图1所示。蛋白质保守结构域分析显示,泥鳅cyp19ala基因编码的氨基酸序列分别在46~55位有1个低复杂度区(low complexity region),在67~505位有1个P450蛋白结构域(Pfam domain)。用PROSITE对其功能域预测发现,在449~458位存在细胞色素P450半胱氨酸血红素-铁配体识别结合位点。此外,通过与其他物种进行比较发现,在泥鳅的cyp19a1a基因中也存在芳香化酶的3个高度保守片段,分别为I-螺旋区(与类固醇物质结合有关)、芳香化酶特异保守区以及血红素结合区(图1),这表明泥鳅的cyp19a1a基因具有性腺型芳香化酶基因的典型功能。SWISS MODEL软件对泥鳅cyp19a1a基因编码蛋白质三级结构的预测结果如图2所示,发现其蛋白质三级结构主要由α-螺旋、无规则卷曲、β-转角以及延伸链构成。

方框内分别为起始密码子(ATG)和终止密码子(TGA);绿色区域:跨膜区域; 紫色区域:低复杂度区; 黄色区域:I-螺旋区; 红色区域:芳香化酶特异保守区; 蓝色区域:血红素结合区; 棕色下划线区域:P450蛋白结构域。The start codons (ATG) and stop codons (TGA) are shown in red; green region indicate transmenbrane region,purple region indicate low complexity region,yellow region indicate I-helix region,red region indicate aromatase-specific conserved region,blue region indicate heme-binding region and the underlined with brown indicate Pfam domain.
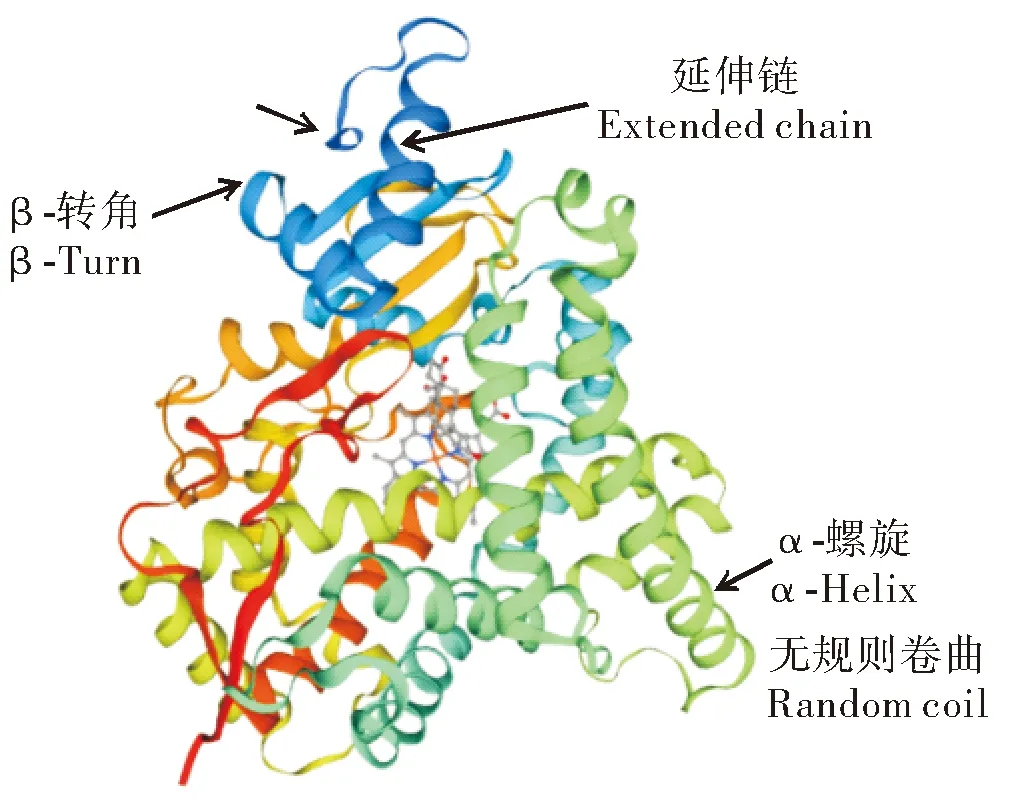
图2 预测的泥鳅cyp19a1a蛋白三级结构
2.2 泥鳅cyp19a1a的同源性及系统发育分析
将泥鳅cyp19a1a的氨基酸序列与其他脊椎动物的序列进行同源性分析,结果显示,泥鳅的cyp19a1a与其他鱼类的cyp19a1a有较高的同源性,其中,与鲤(Cyprinuscarpio)的同源性最高(80.27%),其次为鲫(Carassiusauratus)(79.3%)和斑马鱼(Daniorerio)(79.11%),而与猪(Susscrofa)的同源性最低(50.2%)(图3)。用MEGA X的NJ分析法,构建泥鳅与其他脊椎动物cyp19a1a氨基酸序列的系统进化树(图4),发现泥鳅与斑马鱼、鲤、鲫等鱼类在进化上紧密相关,并形成一个独立的分支,而爬行类的巴西龟(Trachemysscripta)、鸟类的鸡(Gallusgallus)、哺乳类的人(Homosapiens)、鼠(Musmusculus)和野猪则形成一个大的独立分枝,且亲缘关系与泥鳅越来越远。这些结果与氨基酸序列比对的结果相同,也与物种的实际进化关系相一致。

图3 不同物种cyp19a1a氨基酸序列比对
2.3 泥鳅cyp19a1a 5′侧翼序列的生物信息学分析
用hiTAIL-PCR技术扩增得到泥鳅cyp19a1a的5′侧翼序列,其长度为2 040 bp。用NNPP软件对启动子的核心元件进行预测,发现一处分值较高的序列(图5,灰色突出显示)(Score:0.95),其中包括典型元件TATA-box(-32~-25),推测其为cyp19a1a的启动子核心元件。分别用AliBaba 2.1和Cister对泥鳅cyp19a1a5′侧翼序列中的转录因子结合位点进行预测,得到3个SRF、5个Sp1、1个C/EBPβ、1个SRY、3个ER、1个GR等转录因子结合位点(图5)。
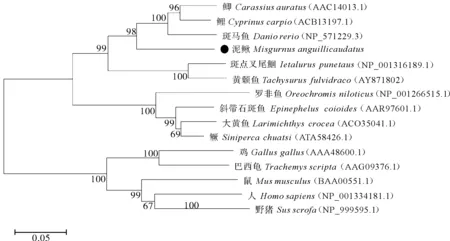
图4 基于氨基酸序列的cyp19a1a基因系统进化分析

图5 泥鳅cyp19a1a启动子区转录因子结合位点预测
2.4 二倍体、四倍体泥鳅的生长和性腺发育比较
比较12月龄二倍体、四倍体泥鳅的体长和体质量参数,结果显示,四倍体泥鳅的雌雄个体均显著高于二倍体(P<0.05),表现出明显的生长优势(图6)。卵巢组织的切片结果显示,12月龄二倍体泥鳅卵巢主要为成熟期的卵母细胞(LMO),为Ⅳ期卵巢,而四倍体泥鳅的卵巢中主要为皮层滤泡期的卵母细胞(CAO)和早期的卵黄卵母细胞(EVO),为Ⅱ期卵巢。精巢组织切片结果显示,二倍体泥鳅的精巢中含有大量的精子细胞(Sz)和少量的精细胞(St),为Ⅳ期精巢,而四倍体泥鳅的精巢中含有部分精母细胞(Sc)和大量的精细胞(St),为Ⅲ期精巢(图7)。
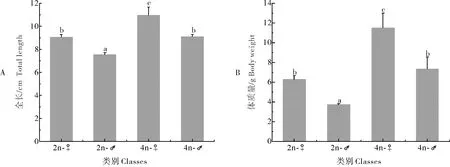
柱形图上相同字母表示无显著性差异(P>0.05),不同字母表示有显著性差异(P<0.05)。下同。Same letters on the bar means no significantly different between each other (P>0.05), while different letters means significantly different (P<0.05).The same as below.
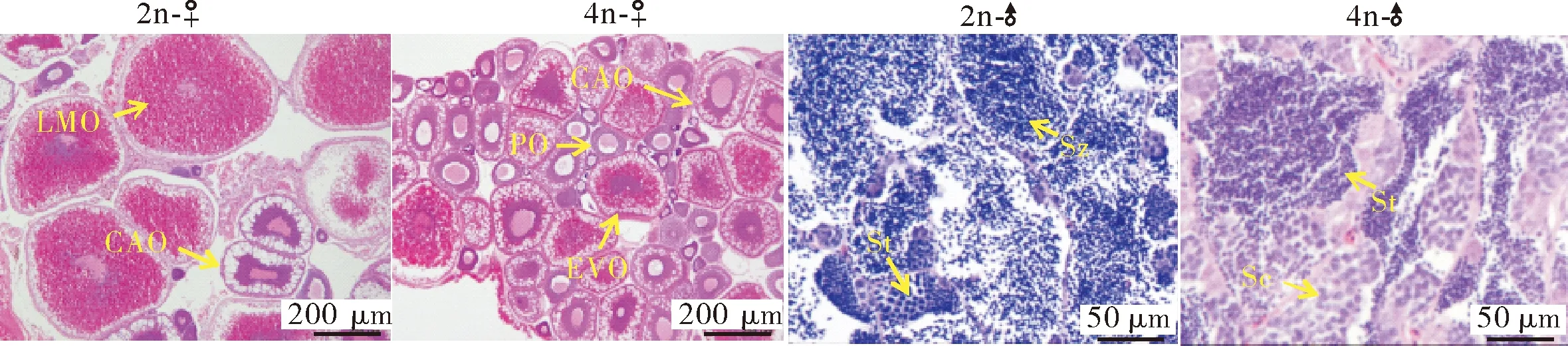
PO:初级卵母细胞; CAO:皮层滤泡期的卵母细胞; EVO:早期的卵黄卵母细胞; LMO:成熟期的卵母细胞; Sc:精母细胞; St:精细胞; Sz:精子细胞。PO:Primary oocytes; CAO:Cortical-alveolar oocytes; EVO:Early vitellogenic oocytes; LMO:Late/mature oocytes;Sc:Spermatocytes; St:Spermatids; Sz:Spermatozoa.
2.5 cyp19a1a/b在二倍体、四倍体泥鳅组织间的表达差异分析
qRT-PCR分析结果显示,cyp19a1a在二倍体雌性泥鳅的卵巢中表达水平最高,其次为肌肉和肝脏,在脑中的表达量最低,但其在雄性二倍体泥鳅肝脏和肌肉中的表达水平却显著高于雌性(P<0.05)(图8A)。四倍体泥鳅与二倍体的表达模式基本一致(图8B)。cyp19a1b在脑中的表达量显著高于其他组织,且在雌性中的表达量显著高于雄性(P<0.05)(图8C)。在二倍体泥鳅的肌肉和精巢中也检测到cyp19a1b的表达,但其在肝脏和卵巢中的表达量很低(图8C)。与二倍体相比,cyp19a1b在四倍体泥鳅肌肉的表达量很低,几乎无法检测到(图8D)。
2.6 cyp19a1在雌雄泥鳅倍性间的表达比较
在雌性泥鳅中,cyp19a1a在四倍体泥鳅脑、性腺、肌肉和肝脏4个组织中的表达水平都显著高于二倍体(P<0.05)(图9A);而在雄性中,cyp19a1a在性腺中的表达水平低于二倍体(P>0.05)(图9B)。在雌性中,cyp19a1b基因在四倍体泥鳅脑中的表达量显著高于二倍体(图9C),但在雄性中其表达水平相反(P<0.05)(图9D)。除此之外,在雌性中,二倍体cyp19a1b在肌肉中的表达水平高于四倍体(P>0.05)(图9C);在雄性中,该基因在性腺、肌肉和肝脏组织中的表达模式均为二倍体高于四倍体(P>0.05)(图9D)。
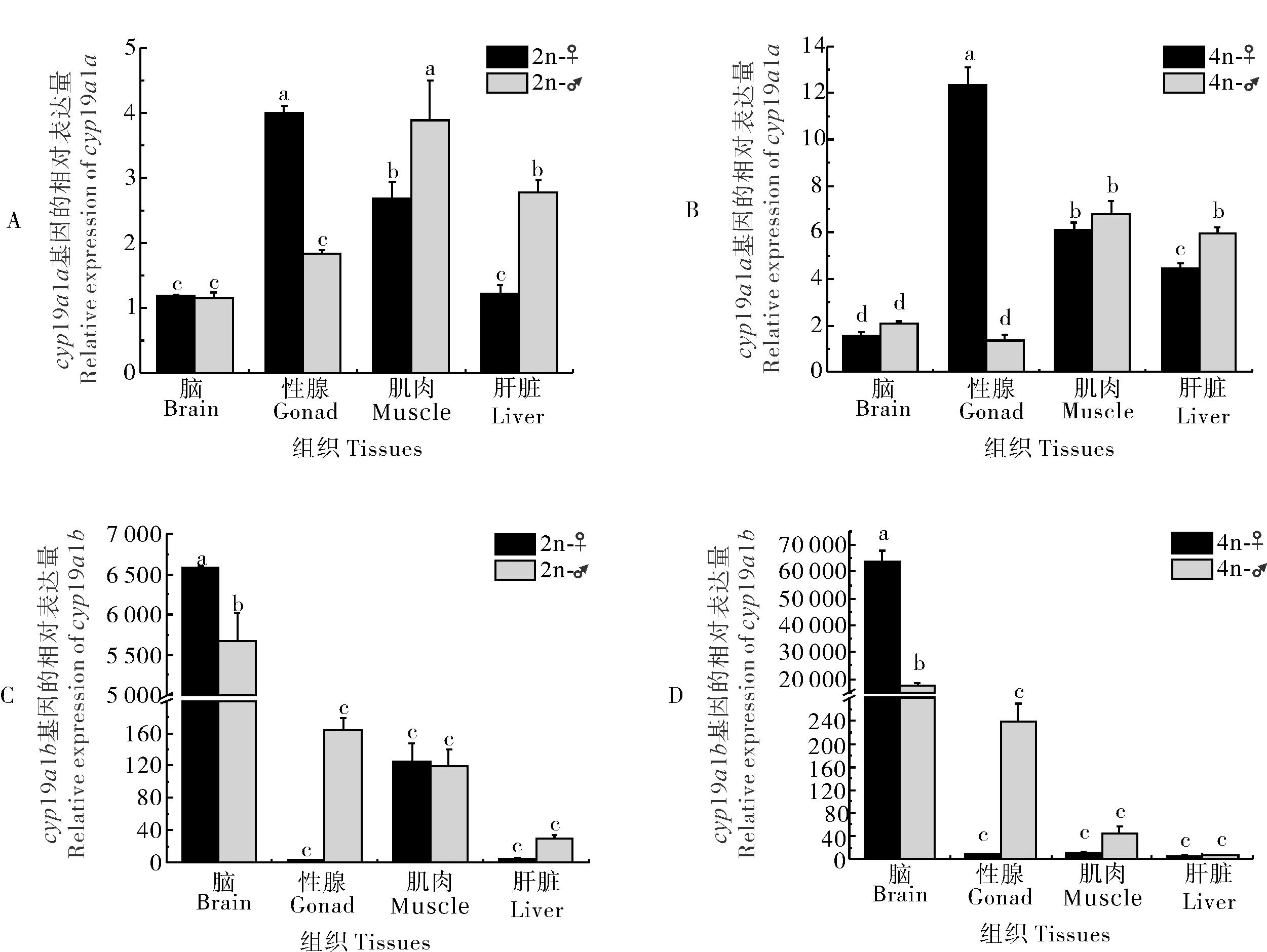
图8 cyp19a1a(A,B)和cyp19a1b(C,D)在雌雄泥鳅组织间的表达比较
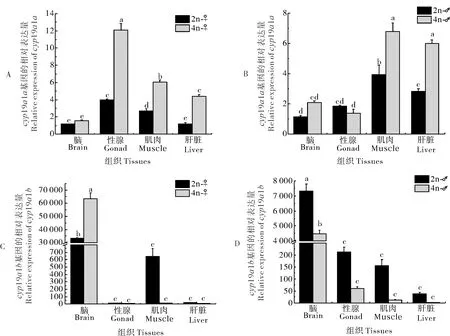
图9 cyp19a1a(A,B)和cyp19a1b(C,D)在雌雄泥鳅不同倍性间的表达
3 讨 论
3.1 泥鳅cyp19a1a基因的5′侧翼序列特征
本研究中,我们在泥鳅cyp19a1a基因的5′侧翼序列上预测到多个转录因子结合位点,其中包括CREB结合位点,该结合位点是硬骨鱼cyp19a1a启动子的保守特征[15]。在5′侧翼序列上,还发现有GR(糖皮质激素受体)结合位点,研究发现,体内皮质醇(与鱼类压力最直接相关的激素)的增加可以通过与cyp19a1a启动子中的GR结合,下调cyp19a1a的表达,从而导致雌二醇(E2)的生成迟缓并最终抑制卵巢分化[16-18]。此外,还发现有多个ER转录因子结合位点,推测E2与ER(雌激素受体)结合后,可以直接作用于靶基因启动子区的雌激素应答元件,从而发挥对靶基因的转录调控作用[19]。因此,泥鳅cyp19a1a的5′侧翼序列上存在cyp19a1a基因的重要转录因子结合位点。
3.2 二倍体、四倍体泥鳅生长和性腺发育的比较分析
比较12月龄的二倍体、四倍体泥鳅的生长参数,结果显示,四倍体泥鳅的体长和体质量均显著高于二倍体,具有明显的生长优势,这与已有的研究结果是一致的[11]。同时,性腺切片的结果显示,在雌性和雄性中,四倍体泥鳅的性腺发育时期都明显滞后于二倍体。一般认为,生长和生殖之间存在着相互制约的关系,生长和生殖能量的分配存在着一个平衡[20],我们推测,四倍体泥鳅的生长优势可能与其相对较晚的性腺发育有关。
3.3 cyp19a1在二倍体和四倍体泥鳅组织间的表达特点
在二倍体、四倍体泥鳅中,cyp19a1a均在卵巢中的表达量最高,且表达水平显著高于精巢(P<0.05),这是由于较高的cyp19a1a可以加速雌激素的合成,而雌激素在鱼类卵巢分化与维持等方面起着至关重要的作用[21]。与cyp19a1a不同,cyp19a1b在卵巢中几乎不表达,在精巢中的表达相对较高,这与东非慈鲷(Cichlidae)的研究结果类似[6]。Robertson等[22]对小鼠(M.musculus)cyp19a1b进行靶向破坏,发现缺乏芳香化酶的雄性小鼠在4.5个月到1 a之间会出现精子发生中断的现象。由此推测,cyp19a1b不仅参与了性腺分化过程中神经内分泌和代谢的过程,对维持精巢的功能也发挥了重要的作用[6]。
cyp19a1a在泥鳅脑中的表达量较低,这与其他鱼类中的研究结果一致[5],推测在脑中发挥主要功能的是cyp19a1b。在金鱼(Carassiusauratus)[23]和鲤(C.carpio)[24]中的研究发现,cyp19a1b集中在基底前脑的生殖控制中心表达,表明cyp19a1b及其催化产生的雌激素在发育和生殖过程中发挥着重要作用。在斑点叉尾鮰(Ietaluruspunetaus)的脑中,cyp19a1b活性较高的区域还发现了促性腺激素释放激素(GnRH)神经元(负责控制硬骨鱼类的性腺成熟),推测cyp19a1b可能参与调节了脑-垂体-性腺轴(HPG轴),直接或间接调节促性腺激素的分泌[25]。
在泥鳅的肝脏中也检测到了cyp19a1的表达,尤其是cyp19a1a,且其在雄鱼中的表达量高于雌性。类似的结果在人(H.sapiens)[26]、鲤[24]中也有报道。在鱼类中,肝脏是性腺源性雌激素作用的主要靶标之一[27],当鱼类处在卵黄形成的高峰期,肝脏中多量的芳香化酶可以通过促使循环血液中的雄激素转化为雌二醇,进而刺激肝脏合成卵黄蛋白原[28]。
3.4 cyp19a1在二倍体、四倍体泥鳅间的表达及其与生长生殖差异的相关性
cyp19a1a在卵巢和肝脏中,以及cyp19a1b在脑中的表达水平均为四倍体高于二倍体,推测原因可能与四倍体卵巢所处的发育阶段(Ⅱ期)有关。鱼类性别相关基因的表达与其性腺分化的发育阶段密切相关,在乌鳢(Channaargus)[29]和牙鲆(Paralichthysolivaceus)[3]中,均发现了cyp19a1a在卵巢发育未成熟时期的表达量显著高于成熟期的现象。推测其原因可能是由于芳香化酶是将雄激素转化为雌激素的限速酶,雌激素可以促进肝脏中卵黄蛋白原的产生,刺激卵母细胞中卵黄物质的积累,从而在鱼类卵母细胞的发育中发挥重要作用。当卵巢处于分化阶段时,肝脏内需要大量的雌激素来刺激卵黄蛋白原生成,为正在发育的卵母细胞提供营养和功能性物质[28],而芳香化酶是雌激素产生的必要条件,因此,此时cyp19a1a在四倍体泥鳅肝脏中的表达量也较高。Goto-Kazeto等[25]研究发现,脑中的cyp19a1b可能参与调节了脑-垂体-性腺轴(HPG轴),进而调节硬骨鱼的性腺分化,此时四倍体泥鳅的卵巢处于发育阶段,需要大量的类固醇激素来促进自身的性腺发育,所以此时cyp19a1b在四倍体脑中的表达量较高。cyp19a1a在二倍体泥鳅精巢中的表达量低于四倍体(P>0.05),可能与四倍体泥鳅精巢所处的发育阶段有关,Kitano等[30]认为,精巢中cyp19a1a的低表达是精巢分化的先决条件。
生长参数及性腺组织学比较结果显示,与二倍体泥鳅相比,四倍体泥鳅生长快,但性成熟明显滞后;组织间和倍性间的基因表达分析结果显示,cyp19a1a在四倍体泥鳅各组织中的表达量均高于二倍体(除精巢外)。由于芳香化酶及其催化产生的雌激素,不仅在鱼类的性别决定中发挥着关键性的作用,还可以通过GH-IGF通路调节鱼类的生长发育。由此,我们推测,四倍体泥鳅高表达的cyp19a1a可以通过影响IGF/GH生长轴相关基因的表达水平进而促进四倍体泥鳅的生长。

