高活性小分子果胶对放射性核素内污染的抗放与促排功效评价
李 娟,张 馨,王 双,冉永红,赵雅贞,郝玉徽
(陆军军医大学军事预防医学系复合伤研究所,重庆 400038)
贫铀(depleted uranium,DU)被认为是一种新兴的、具有放射性的环境污染物,其存在于土壤、岩石、地表水、地下水、空气、植物和动物中,并微量存在于食物和饮用水中,一定程度上影响着人们的健康[1-2]。预防和治疗放射性核素损伤的措施主要包括限制放射性核素从污染部位吸收以及促进其排泄[3]。目前已有研究合成了多种促排剂,并测试了其与DU螯合的适用性,但是其中许多促排剂显示出较高的毒性[4]。放射性核素促排剂二乙基三胺五乙酸(diethylenetriaminepentacetate,DTPA)的口服制剂被认为是体内螯合铀的金标准,但是其具有肾毒性、致畸性、胚胎毒性等副作用[4-5]。NaHCO3长期以来都被用于螯合DU,具有较小的肾毒性,在体内更稳定,并且可以被肾迅速过滤,但NaHCO3的螯合效率低,且酸碱干扰高。由于核素促排等相关研究较少,新促排剂或螯合剂的研究发展缓慢,因此,探索安全有效的促排剂势在必行。有研究发现,天然植物来源的多糖具有明显的抗氧化、抗肿瘤、抗癌、抗细菌、抗炎、抗糖尿病和抗肥胖活性作用[6]。低分子柑橘果胶(low-molecular-weight citrus pectin,LCP)是通过规定的pH值和温度水解天然果胶(C6H10O7)而得到的分子质量较小、酯化度较低的果胶多糖[7-8]。Wang等[9]发现LCP可有效抑制胃肠癌细胞的生长和转移。杨国华等[10]发现LCP能抑制小鼠结肠癌的生长、肝转移及血管形成。关于LCP在医学发展方面的潜能值得深入研究。因此,本研究将探索LCP对放射性核素内污染的抗放与促排功效。
1 材料与方法
1.1 材料准备与制备
昆明小鼠210只,雄性,体质量(20±5)g,购于陆军军医大学实验动物中心;高活性小分子果胶(生产批号:180810)由浙江大学生物系统工程与食品科学学院和杭州络通生物科技有限公司联合开发;过滤细菌后的DU溶液(2 mg/L)由陆军军医大学预防医学系提供;NaHCO3(分析纯)购于重庆博艺化学试剂有限公司;总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(S0109)购于上海碧云天生物技术有限公司;脂类过氧化作用[丙二醛(malondialdehyde,MDA)]检测试剂盒(MAK085-1KT)购于西格玛奥德里奇(上海)贸易有限公司;颇尔制水系统购于颇尔(中国)有限公司;MARS微波消解仪系统购于CEM公司;MUA型微量铀分析仪(编号:050302)购于北京羽纶科技公司核工业北京地质研究院分析测试研究中心;医用1 mL注射器,灭菌手术剪,一次性医用灭菌手套、帽子和口罩等耗材购于国润平台。实验方案及流程见图1。
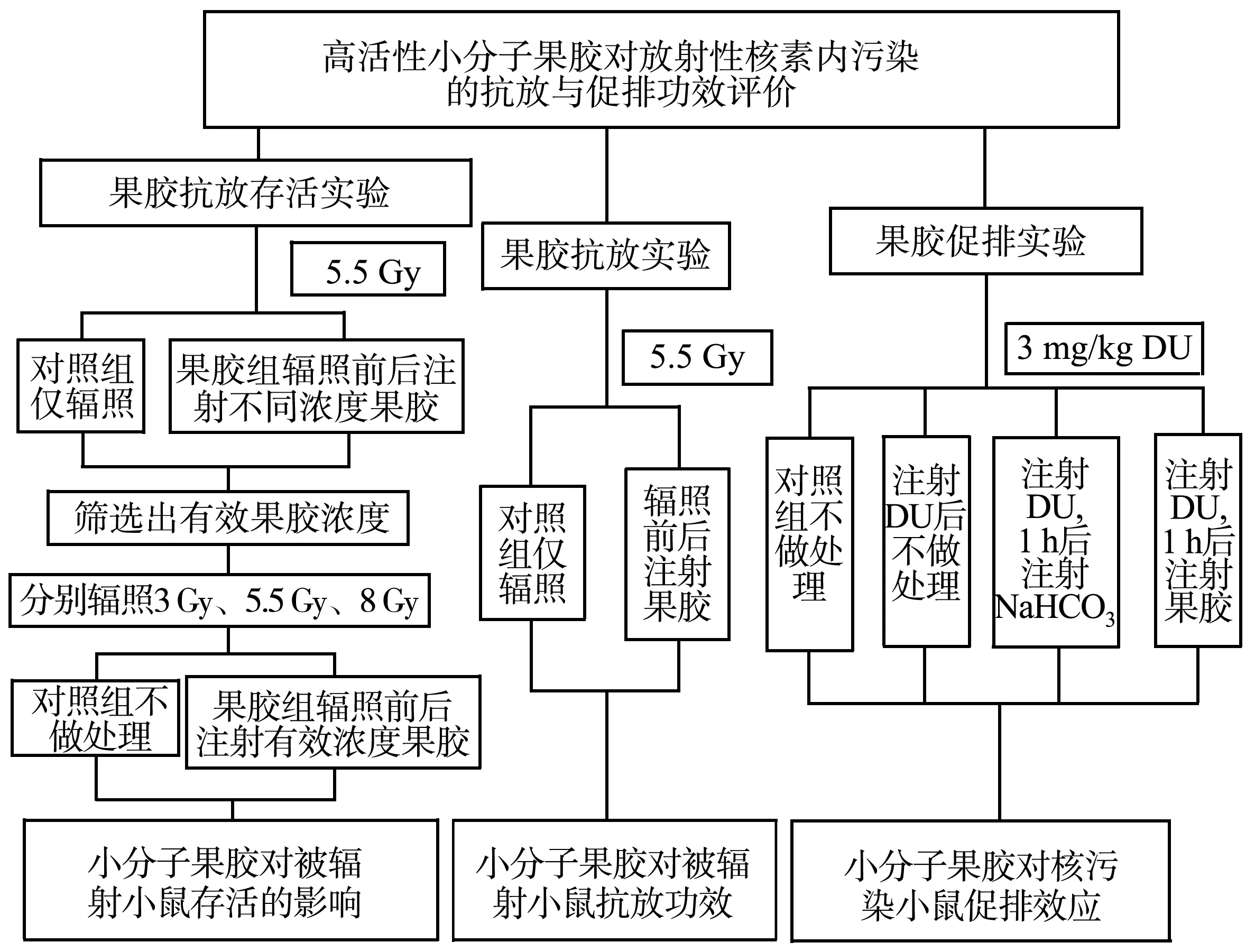
图1 实验方案框架流程
1.2 果胶抗放存活实验
1.2.1 相同辐照剂量,不同果胶浓度 将60只昆明小鼠随机分为对照组、25 mg/kg果胶组、50 mg/kg果胶组、250 mg/kg果胶组,每组15只。对照组:前 5 d不做任何处理,5 d后以总剂量5.5 Gy辐照1次,速率为1.2 Gy/min。其余3组前5 d分别腹腔注射500 μL不同浓度(25 mg/kg、50 mg/kg、250 mg/kg)果胶溶液,每天1次;5 d后以总剂量5.5 Gy辐照1次,速率为1.2 Gy/min,辐照后腹腔注射500 μL不同浓度(25 mg/kg、50 mg/kg、250 mg/kg)果胶溶液,每天1次,连续5 d。每天记录各组小鼠死亡状况,直至30 d。
1.2.2 不同辐照剂量,相同果胶浓度 在筛选出有效果胶浓度后,把90只昆明小鼠随机分为3 Gy对照组、5.5 Gy对照组、8 Gy对照组、3 Gy果胶组、5.5 Gy果胶组、8 Gy果胶组,每组15只。对照组:前5 d不做任何处理,5 d后分别以总剂量3 Gy、5.5 Gy、8 Gy辐照1次,速率均为1.2 Gy/min。果胶组:前5 d腹腔注射500 μL果胶溶液(25 mg/kg),每天1次;5 d后分别以总剂量3 Gy、5.5 Gy、8 Gy辐照1次,速率均为1.2 Gy/min,辐照后腹腔注射500 μL果胶溶液(25 mg/kg),每天1次,连续5 d。每天记录各组小鼠死亡状况,直至30 d。
1.3 果胶抗放实验
将20只昆明小鼠随机分为对照组、果胶组,每组10只。对照组:前5 d不做任何处理,5 d后以总剂量5.5 Gy辐照1次,速率为1.2 Gy/min。果胶组:前5 d腹腔注射500 μL果胶溶液(25 mg/kg),每天1次;5 d后以总剂量5.5 Gy辐照,速率为1.2 Gy/min,辐照后腹腔注射500 μL果胶溶液(25 mg/kg),每天1次,连续4 d。4 d后检测小鼠血常规;取骨髓和肠组织进行病理切片;取肝组织进行SOD、MDA等氧化应激指标检测。
1.4 果胶促排实验
将40只昆明小鼠随机分为对照组、DU组、NaHCO3组、果胶组,每组10只。对照组:不做处理。DU组:3 mg/kg DU腹腔注射给药1次。NaHCO3组:3 mg/kg DU腹腔注射给药1次;1 h后腹腔注射500 μL 5%的NaHCO3,每天1次,连续4 d。果胶组:3 mg/kg DU腹腔注射给药1次;1 h后腹腔注射500 μL果胶(25 mg/kg),每天1次,连续4 d。DU染毒4 d后收集小鼠血清,检测血清肾功能;取肾组织进行病理切片并检测肾铀含量。
1.5 统计学处理

2 结果
2.1 果胶抗放存活率结果
在探究不同浓度果胶对小鼠存活率的影响时,50 mg/kg果胶组和250 mg/kg果胶组小鼠最终存活率均低于对照组,差异有统计学意义(P<0.05);25 mg/kg果胶组小鼠最终存活率高于对照组,差异有统计学意义(P<0.05),见图2。故后续研究采用最终存活率较高的25 mg/kg果胶浓度进行实验,探究此浓度下不同辐照剂量对小鼠存活率的影响,结果显示,25 mg/kg果胶浓度下,3 Gy果胶组、5.5 Gy果胶组最终存活率均高于3 Gy对照组、5.5 Gy对照组,差异有统计学意义(P<0.05);8 Gy果胶组最终存活率与8 Gy对照组比较,差异无统计学意义(P>0.05),见图3。因此,25 mg/kg果胶可提高3 Gy和5.5 Gy辐照小鼠的最终存活率。

*:与对照组比较,P<0.05

*:P<0.05
2.2 氧化应激指标检测结果
体外氧化应激检测结果显示,果胶组MDA水平低于对照组,差异有统计学意义(P<0.05),说明对照组受自由基攻击较果胶组严重;果胶组SOD活力高于对照组,差异有统计学意义(P<0.05),说明果胶组清除氧自由基的能力高于对照组(图4)。

a:MDA;b:SOD活力 *:与对照组比较,P<0.05
2.3 HE染色结果
肾组织切片观察发现,对照组肾小管规则,几乎没有炎性细胞浸润,无纤维化(实质化);果胶组有炎性细胞,存在一定程度纤维化;DU组肾小管不规则,炎性细胞浸润较多,纤维化较严重;NaHCO3组有炎性细胞,存在一定程度纤维化(图5)。
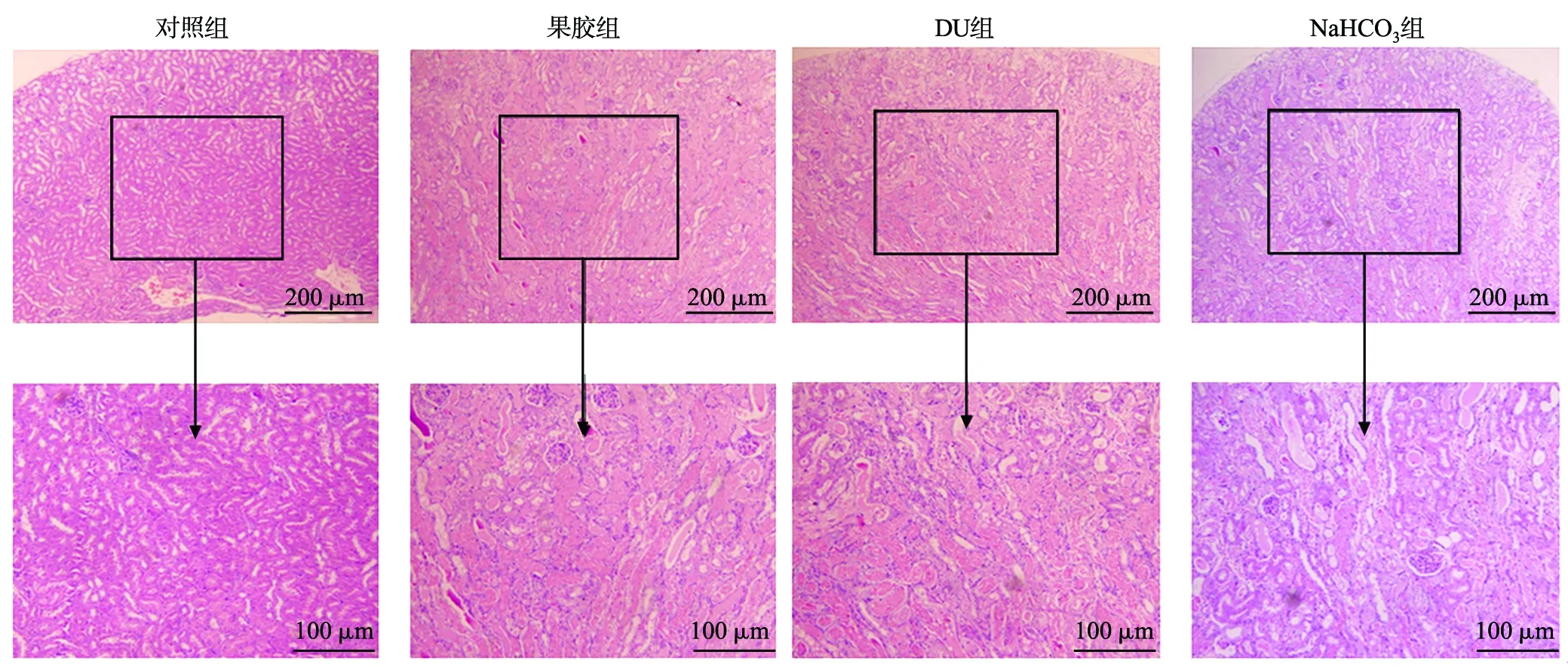
图5 各组肾组织病理切片HE对比
骨髓切片观察发现,对照组小鼠骨髓有大量红细胞填充,果胶组红细胞明显减少,血管细胞、纤维细胞、骨髓细胞开始再生(图6)。
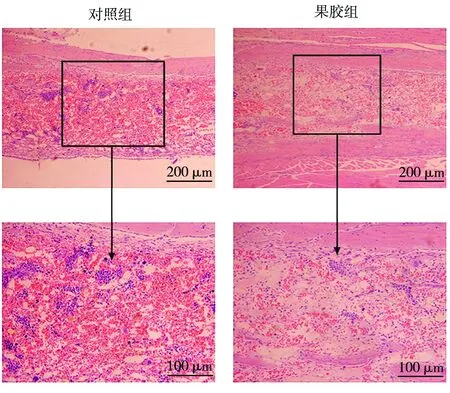
图6 各组骨髓组织病理切片HE对比
肠组织切片观察发现,对照组小鼠小肠绒毛短细,排列紊乱,上皮下间隙扩张;果胶组小鼠肠黏膜形态排列规则,连续性完整,无充血及明显断裂现象(图7)。

图7 各组肠组织病理切片HE染色对比
2.4 血常规检测结果
血常规检测结果显示,经5.5 Gy辐照后,果胶组单核细胞比例高于对照组,差异具有极显著性统计学意义(P<0.01),其余外周各血象与对照组比较,差异无统计学意义(P>0.05),见图8。
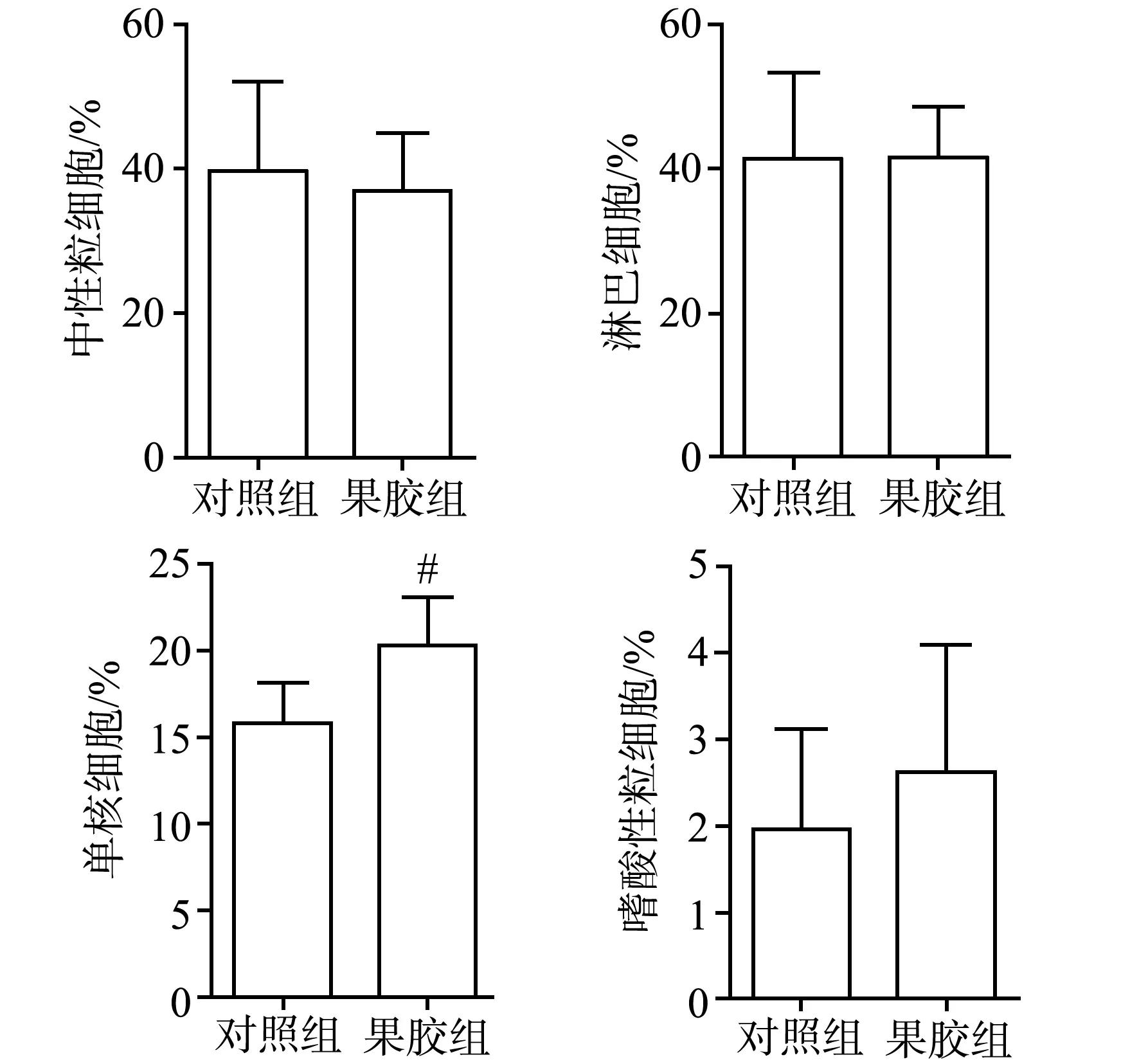
#:与对照组比较,P<0.01
2.5 血清肾功能检测
注射DU后,果胶组和DU组肌酐及尿素含量均高于对照组,差异具有统计学意义(P<0.05),果胶组肌酐及尿素含量低于DU组,差异具有统计学意义(P<0.05),见图9。
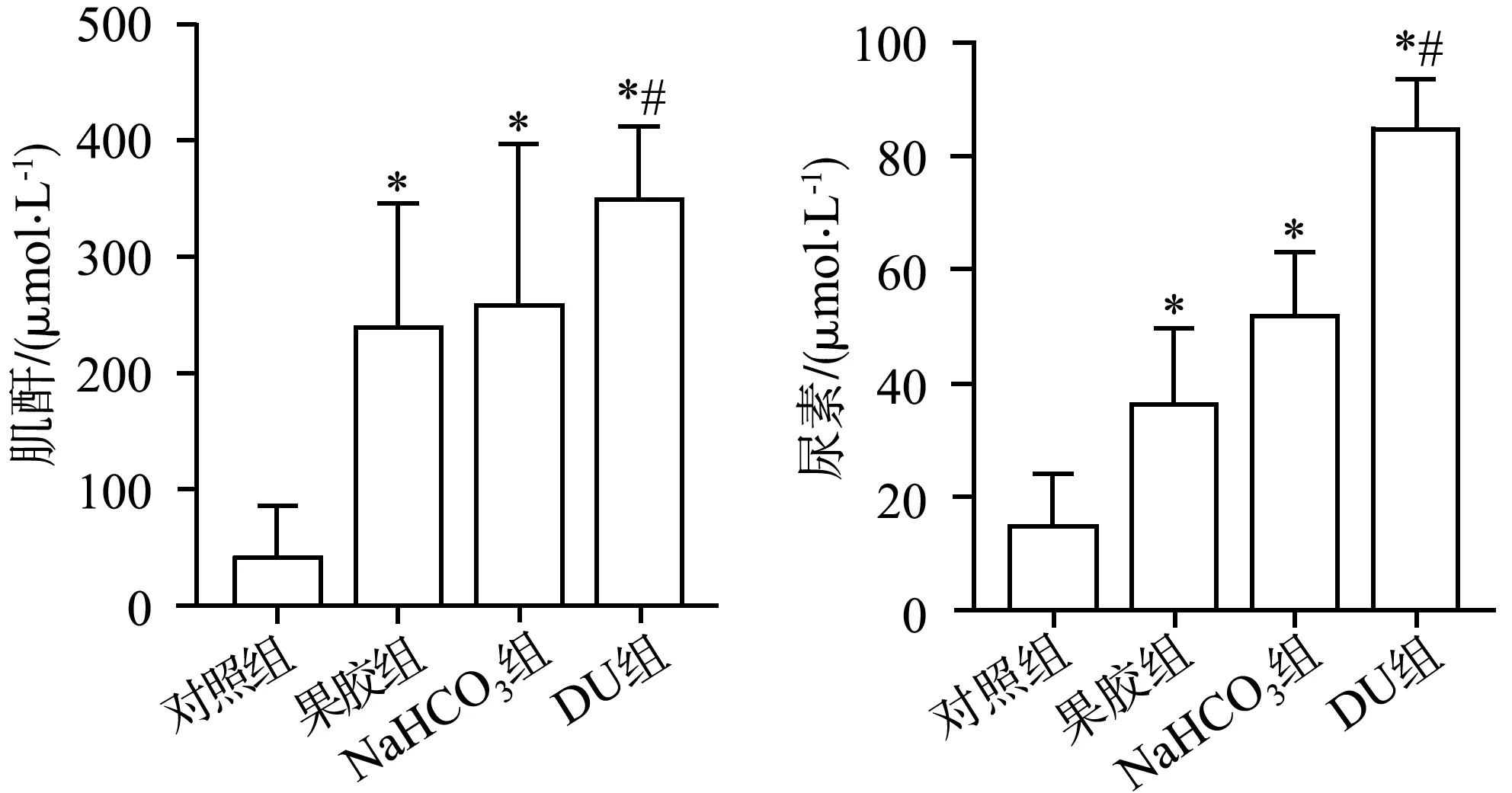
*:与对照组比较,P<0.05;#:与果胶组比较,P<0.05
2.6 肾铀含量检测结果
注射DU后收集小鼠肾组织,经微波消解后检测其铀含量,结果显示,果胶组肾铀含量低于DU组和NaHCO3组,差异均具有统计学意义(P<0.05),说明果胶能降低小鼠体内肾铀含量(图10)。

*:果胶组与其他组比较,P<0.05
3 讨论
铀是一种放射性核素,DU是天然铀浓缩过程的副产品[11]。DU及其化合物的放射毒性和化学毒性是引发肺癌和肾损伤的原因之一,其化学毒性可引起急性效应[12]。DU可通过吸入、食入或皮肤接触进入人体[4],在进入人体后其化学结构会随溶液的pH值发生复杂变化,而且DU可与人体中的各种成分结合,短时间内即可对各个器官造成严重损害[13]。虽然群体暴露于大量DU的可能性很小[12],但是,由于对核燃料需求的增加,预计环境中的DU泄漏量也将增加[4]。临床可以通过增加DU的消除量或减少其吸收量和分布来减少DU的积累。
螯合剂可治疗重金属中毒,使用螯合剂加速铀从体内排泄的螯合疗法是降低铀毒性的独特方法[12]。螯合剂已被广泛用于治疗多种金属的急性和慢性中毒,可溶性螯合剂的使用可减少DU在器官中的沉积并加速其消除,降低毒性[4]。甲基亚氨基二乙酸可以显著降低DU注射部位的铀浓度,并显著加速铀的排泄。Fukuda等[13]发现对受DU污染的伤口采用甲基亚氨基二乙酸局部治疗可有效减少急性损伤。注射4 mg/kg DU(pH 1)后的120 min内使用甲基亚氨基二乙酸,可降低尿液和粪便中的尿铀含量及肾和骨骼中铀的浓度。这与我们注射果胶排铀效果类似。由于螯合剂在生理pH下的溶解度有限,对其形成螯合物的动力学不利,因此,并非所有的化合物都适合用作治疗全身性铀中毒的螯合剂[12]。天然果胶因溶解度小、肠吸收困难而作用有限[14],本研究采用修饰过的果胶LCP,克服了天然果胶分子质量大、不易消化吸收等问题,溶解度更好,且LCP的直链结构具有很强的阳离子结合能力,靶向性较天然果胶更强[2]。
天然果胶作为一种膳食纤维,有抑制结肠癌、降血压、减少肠道有害菌感染和腹泻、改善动脉粥样硬化及心脏病等功效[10]。Edirisinghe等[15]的研究发现,海洋来源的螺旋藻果胶可促进体外人皮肤成纤维细胞迁移和增殖,且无任何细胞毒性作用;低剂量(50 μg/mL)的螺旋藻果胶可促进斑马鱼截肢尾鳍再生,且没有任何毒性;螺旋藻果胶(每条600 μg)可使斑马鱼的伤口快速愈合,且无过多瘢痕形成;暴露于螺旋藻果胶的成年斑马鱼可以实现损伤肌肉和肾的快速修复,与先前针对其他鱼类和哺乳动物伤口进行的研究结果一致。本研究首次从抗辐射、促进放射性物质排出方面对果胶进行分析,通过果胶抗放存活实验发现,浓度为25 mg/kg的果胶溶液可以明显降低辐射后小鼠的病死率,且无明显毒副作用,因此果胶具有成为全身性铀中毒解毒剂的可能。
在研发新药方面,一些研究者通过对天然壳聚糖进行修饰来探索其应用价值。Amirian等[16]基于氧化壳聚糖(oxidized chitosan,OC)和酰胺化果胶(amidated pectin,AP)构建了原位交联的可注射水凝胶。AP-OC水凝胶可以为细胞增殖提供更好的微环境,因为这两种带有氨基的改性天然多糖都可溶于中性溶液。由于其原位交联、可调节的保水能力、良好的生物降解性以及生物相容性等综合优势,AP-OC水凝胶在伤口敷料和皮肤组织工程中有良好的前景。张晓菲等[17]在印迹技术指导下合成了一系列水溶性交联壳聚糖衍生物,其中五二醛交联羧甲基壳聚糖可减少DU在细胞内的积累,这可能是由于五二醛交联羧甲基壳聚糖与DU形成的DU-壳聚糖衍生物的沉淀物体积较大而无法进入细胞,由此减少了细胞对DU的吸收,从而发挥解毒作用。本研究通过向DU小鼠模型注射果胶,发现果胶对肾、骨髓、小肠均具有保护作用,但是果胶保护机体的机制有待进一步研究。近几年有研究发现果胶对辐射后的肠道具有保护作用,Sureban等[18]在研究饮食果胶对致死性全身γ-IR辐射诱导的肠道干细胞缺失、隐窝和总体存活影响的实验中发现,果胶可以防止电离辐射引起的潜在储备肠道干细胞缺失,并促进隐窝再生。也有学者在微生物降低铀毒性机制方面展开研究,Agarwal等[19]在高铀环境下分离了数种细菌菌株,从蛋白质组学水平上得到了该细菌生存在高铀环境时新陈代谢和应激反应的相关数据,这些研究可以确定基因蛋白靶标,测量并预测在历史上受DU污染存活下来的生物自主修复的信号通路。
综上所述,本研究初步探索了果胶对核素内污染小鼠的防护作用,证实了果胶具有抗辐射与促进DU排出的功效,但是果胶的抗辐射及促排机制仍需要进一步研究。

