体重指数与多囊卵巢综合征临床指标的相关性研究
孟小钰 侯丽辉 孙 淼 郝松莉 张春兰
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是育龄期女性常见的一种生殖内分泌疾病,发生率约为5%~10%[1]。其中约50%~70%的患者存在肥胖,而肥胖会加重PCOS患者的生殖障碍和代谢紊乱,主要表现为增加PCOS患者胰岛素抵抗(insulin resistance, IR)和代偿性高胰岛素血症(hyperinsulinism, HI)的发生,增加卵巢和肾上腺雄激素的分泌,抑制性激素结合球蛋白的合成[2]。本研究旨在探讨不同体重指数PCOS患者的临床特征及体重指数与临床指标的相关性,为PCOS患者的临床治疗及疗效评价提供理论依据。
对象与方法
1.研究对象:选取2016年12月~2019年12月黑龙江中医药大学附属第一医院PCOS临床科研信息共享系统中19~39岁、BMI>18.5kg/m2的PCOS患者病例980例,患者平均年龄25.61±5.35岁,平均体重68.99±14.27kg。
2.诊断标准及排除标准:PCOS诊断标准采用2003年鹿特丹诊断标准[3];中国超重/肥胖不孕不育患者体质量管理路径与流程专家共识[4];胰岛素抵抗的诊断标准IR>2.69[5]。排除标准:①近3个月内应用激素类药物或近1个月内服用可能会影响检测结果的中药、西药或中成药者;②其他雄激素过多相关疾病(包括21羟化酶缺乏的先天性肾上腺皮质增生、肿瘤、过量使用产生雄激素的药物、库欣综合征等)。
3.研究方法:通过PCOS临床科研信息共享系统,选定时间节点2016年12月~2019年12月,解析患者病例,导出患者的基本信息及生化指标。基本信息主要包括年龄、初潮年龄、体重指数(BMI)、腰围(WC)、臀围(HC)、腰臀比(WHR)、收缩压(SBP)和舒张压(DBP)。试验室指标主要包括促卵泡激素(FSH)、黄体生成素(LH)、睾酮(T)、雄烯二酮(AND)、硫酸脱氢表雄酮(DHEAS)、性激素结合球蛋白(SHBG)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)和空腹血糖(FPG)和空腹胰岛素(FINS);计算游离雄激素指数(FAI)、胰岛素抵抗指数(IR)、胰岛素敏感指数(ISI)和胰岛β细胞功能指数(HOMA-β)。

结 果
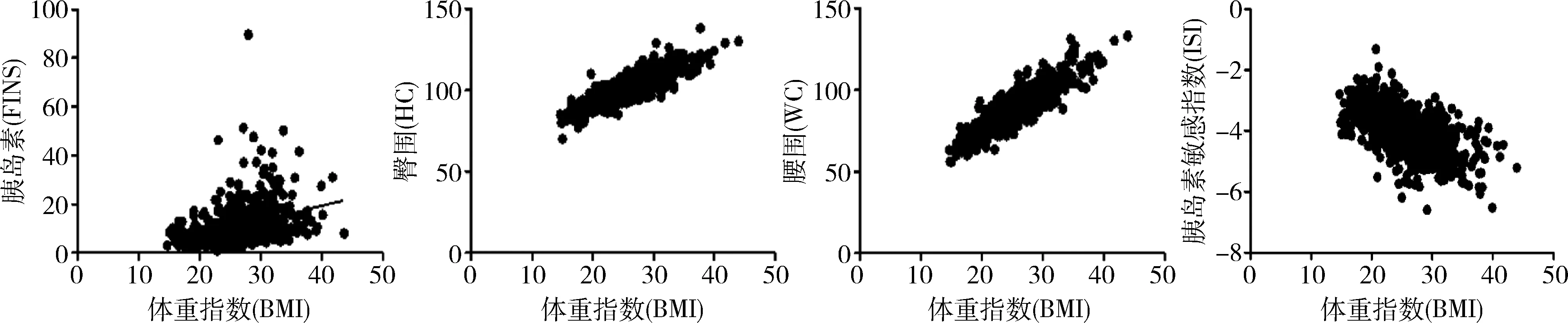
1.PCOS患者BMI及IR的分布情况:研究中共纳入PCOS患者980例,超重和肥胖的发生率分别为33.67%和28.88%。18.5kg/m2 2.组间基础信息的比较:18.5kg/m2 表1 不同体重指数PCOS患者的基础信息比较 3.组间性激素比较:18.5kg/m2 表2 不同体重指数PCOS患者的性激素比较 4.组间糖脂代谢的比较:18.5kg/m2 表3 不同体重指数PCOS患者的糖脂代谢比较 5.BMI与临床指标的相关性分析:PCOS患者的BMI与DBP(r=0.320)、SBP(r=0.371)、HOMA-β(r=0.441)、IR(r=0.454)、FINS(r=0.483)、WHR(r=0.554)、HC(r=0.848)和WC(r=0.869)间呈正相关,r值在0.3~0.9之间;与LH(r=-0.308)、ISI(r=-0.570)间呈负相关,r值在-0.3~-0.6之间,详见图1。 图1 BMI与FIN/HC/WC/ISI的Pearson相关性分析散点图 研究中共纳入PCOS患者980例,其中超重的占33.67%、肥胖的占28.88%;IR的发生率随着BMI的增大逐渐增加,分别为15.80%、48.18%和65.37%。肥胖是引起PCOS患者发生IR的一个独立危险因素。与体重正常的PCOS患者比较,肥胖的PCOS患者更容易出现月经失调和排卵障碍且程度更重。本研究结果显示无论肥胖与否,PCOS患者主要为腹型肥胖,临床表现为腰臀围比例增加,即男型肥胖。本研究结果显示随着BMI的增加,PCOS患者的腰臀比逐渐增加,组间比较差异有统计学意义;同时患者的空腹胰岛素水平也逐渐升高,表现为HI。这主要是由于肥胖患者脂肪的过量储存导致脂肪降解加强,使体内非酯化脂肪酸增多;过多的非酯化脂肪酸一方面可影响肝脏糖代谢过程并抑制肝脏对胰岛素的灭活,另一方面还可以抑制胰岛素受体酪氨酸激酶活性,从而使血液中胰岛素水平增高[6]。此外,INS能够加速形成脂肪,使体重上升。当体重超标达到35%~40%时,INS本身的敏感度也会降低30%~40%,IR将更为严重[7]。 临床检测中游离睾酮的测定受多种因素限制,而相较于总睾酮体FAI更能反映睾酮的生物学活性水平,是诊断PCOS 高雄激素血症的敏感指标[8]。结果显示,随着患者BMI的增加,PCOS患者的SHBG水平逐渐下降,而FAI逐渐升高。这可能与肥胖的PCOS患者体内为HI状态,抑制了肝脏组织SHBG合成水平,从而增加了PCOS患者的血液中游离雄激素的水平以及雄激素生物学活性有关[9]。患者卵巢内的异常和未成熟的卵母细胞长期的暴露在HA状体下,将会阻断优势卵泡发育,使卵泡生长停滞甚至闭锁,子宫内膜由于持续雌激素水平刺激而无孕激素抵抗,进而增加了子宫内膜癌的患病风险[10]。同时,PCOS患者体内HA、HI的激素内环境与肥胖之间相互影响,形成恶性循环[11]。 研究结果显示,随着PCOS患者BMI的逐渐增加,患者的FBG、FIN及IR水平逐渐升高而HDL水平逐渐降低,组间比较差异有统计学意义。同时3组患者的胰岛β细胞分泌功能随着BMI升高逐渐增加,而胰岛素敏感度却逐渐降低,组间比较差异有统计学意义。说明肥胖程度的加重使机体对胰岛素的敏感度降低,同时使IR进一步加重[12]。而为了克服IR,胰岛β细胞代偿性的分泌增加,这可能会导致早期胰岛β细胞功能受损,随着病程的进展,导致糖尿病的发生[13]。提示肥胖加重了PCOS患者糖脂质代谢紊乱,增加了患者远期发生动脉粥样硬化、心血管疾病以及2型糖尿病的风险。 PCOS患者的BMI与DBP、SBP、HOMA-β、IR、FINS、WHR、HC和WC间呈正相关;而与LH和ISI间呈负相关。以上结果提示肥胖PCOS患者的IR、血脂紊乱、高血压、高雄激素血症和相关临床症状的程度更为严重,肥胖的病理改变促进了PCOS的进展,加重了PCOS患者代谢及内分泌的紊乱的风险[14,15]。 综上所述,防治肥胖,遏制肥胖与PCOS的恶性循环,对于PCOS 女性改善生殖内分泌状况以及预防远期并发症的发生具有重要意义[16]。循证医学支持PCOS患者调整生活方式减重有助于预防超重与肥胖,并改善远期生命质量;对于体重正常的PCOS患者,其仍有远期体重增加风险,因此同样需要生活方式干预[17]。研究证实排卵障碍的发生随BMI的增加而增加,肥胖PCOS女性体重下降5%就能改善自主排卵,提高自然妊娠率[18]。同时可以改善内分泌功能、心血管及精神心理健康,进而改善肥胖PCOS患者的妊娠结局。低热量饮食以及运动减重作为一种非药物干预,其可行性强、经济负担少且安全性高。我国首部超重或肥胖医学营养治疗专家共识明确提出,对于超重或肥胖的PCOS患者,首先应进行生活方式干预以减轻体重,以限能量平衡膳食(calorie restrict diet, CRD)为首选,且应对患者实施包括综合教育、个体化方案、密切随访、社会和家庭支持在内的综合管理,这为肥胖的PCOS患者提供了一种新的治疗方法[19]。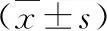
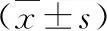
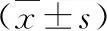
讨 论

