乙酰水杨酸联合双氯芬酸治疗骨关节炎的机制*
侯圣贵 刘建强
济南市第四人民医院,山东 济南 250033
骨关节炎(osteoarthritis,OA)是一种临床常见的慢性关节疾病,主要表现为关节疼痛而降低患者生活质量,病理检查显示病变的关键是关节软骨退行性变合并继发性骨质增生,引起疼痛[1],其病变部位主要累及负重大的关节,如双侧膝、双侧髋,以及脊柱,部分患者累及远侧指间关节[2]。研究证实,OA发病机制涉及到氧化、局部炎症、局部免疫紊乱等多种机制,局部病变的关节软骨细胞凋亡过度伴有细胞外基质降解过度,关节表现为系统损伤[3-4]。损伤过程中主要的炎性因子是白细胞介素-1β(IL-1β),多种致病因素刺激软骨细胞分泌过量的IL-1β,并诱导胞膜IL-1β受体的高表达[5-6],导致软骨细胞损伤。IL-1β不止作用于软骨细胞,还可以活化氧化应激途径,激活机体的活性氧及NO途径,多途径诱导软骨细胞凋亡[7]。乙酰水杨酸属于非甾体抗炎药,而双氯芬酸除抗炎作用外,也具有解热镇痛效果,本研究采用动物模型观察两种药物联合治疗骨关节炎的效果。
1 材料与方法
1.1 实验动物
选用新西兰大白兔建模,由中山大学实验动物中心购买。雌雄兔共计40只,平均体重(2.5±0.5)kg,雌雄分笼。
1.2 主要试剂
乙酰水杨酸(纯度大于98%,上海生工);双氯芬酸(纯度大于98%,上海生工);TRIzol试剂盒(美国BD公司);Primescript RT-PCR试剂盒;SYBR Premix Ex Taq TM II(Perfect Real Time)试剂盒(美国Sigma公司);BCA蛋白定量试剂盒(美国Sigma公司);鼠抗人GAPDH抗体(美国BD公司);兔抗人MMP-3,MMP-13抗体(美国BD公司);羊抗人TIMP-1抗体(美国BD公司);DNA marker(美国Sigma公司);DNA Loading buffer(美国Sigma公司)。
1.3 主要仪器
CO2培养箱(美国ThermoForma公司);超净工作台(苏州净化设备厂);电泳槽、蛋白转印槽、电泳仪和电源(美国Bio-rad公司);GB303基本型电子天平(Mettler—Totado公司);DDL-5型离心机(上海安亭科技仪器厂);酶标仪(DNM-9606酶标分析仪,普朗);PCR仪(ZY325161,Eppendorf)。
1.4 实验方法
1.4.1 兔骨关节炎模型的建立
随机取选取8只新西兰兔作为正常对照组A组,其余32只进行建模。首先以30 g/L戊巴比妥纳行新西兰兔耳缘静脉注射,选取单侧左后肢膝关节,建立骨关节炎模型。左侧股骨近段扎止血带,在膝关节内侧切口,外侧牵开髌骨及髌韧带。屈曲兔左膝关节,充分显露。对照组8只,只探查关节腔,确认腔内无关节原发病变后关闭关节囊并逐层缝合。另32只用于手术造模,显露膝关节,切断交叉韧带及内外副韧带,切除半月板,人为减少关节保护作用,确定关节软骨面无损伤后,逐层缝合切口。术后连续5天肌内注射庆大霉素80万U(一天一次)。
分组:将32只造模成功的新西兰大白兔随机编号。A组:正常对照组;B组:模型对照组;C组:乙酰水杨酸联合双氯芬酸低剂量组治疗组(5 mg/kg,乙酰水杨酸∶双氯芬酸=1∶1);D组:乙酰水杨酸联合双氯芬酸中剂量组治疗组(10 mg/kg,乙酰水杨酸∶双氯芬酸=1∶1);E组:乙酰水杨酸联合双氯芬酸大剂量组治疗组(20 mg/kg,乙酰水杨酸∶双氯芬酸=1∶1),每组各8只,见表1。A组、B组给予生理盐水,C组、D组、E组给予不同浓度的药物,腹腔注射4周。见表1。

表1 分组及各组药物剂量
1.4.2 病理学观察大白兔滑膜组织
取下动物右后膝关节,PBS冲洗后浸泡,甲醛中固定24 h,PBS漂洗,10%EDTA脱钙12周至关节组织变软,硬度与肌肉相仿,无穿刺阻力。脱钙完成后取出,固定脱水包埋后石蜡切片,厚度为4μm,然后进行HE染色,1x70型倒置相差显微镜(型号:TS100美国尼康公司)下观察组织病理学改变。
1.4.3 兔膝关节软骨行大体观察并进行评分
大体观察关节软骨,参照文献标准[8]进行评分,关节软骨表面光滑呈淡蓝色或无色半透明状,计0分。关节软骨表面平滑,仅有软化,计1分。关节软骨变薄,出现小纤维束状改变的表面,计2分。纤维束状变明显,但无磨损,计3分。软骨下骨外露,骨硬化,表面磨损性纤维束状变,计4分。
1.4.4 试剂盒测定各组关节液中的NO、IL-1β含量
向术侧膝关节腔内注射1.0 ml生理盐水,反复抽吸取至试管内。离心取上清液,测量上清液中NO、IL-1β含量。检测方法按照试剂盒以及IL-1β ELISA测定试剂盒说明书进行。
1.4.5 WB法测定MMP-3,MMP-13的蛋白的表达
取兔手术侧软骨退变组织样品约20 mg,充分剪碎后置于匀浆机中搅碎。加入1 ml TRIZOL试剂以及10 mmol/L PMSF40μl,充分混匀后冰上放置10 min,均匀裂解后用无菌注射器反复抽吸获得裂解产物。转移裂解液到EP管中,冰浴30 min,低温离心机12000×g,15 min。上清移入新EP管后,BCA法酶标仪测定蛋白浓度。冻存-80℃冰箱。采用SDS-PAGE电泳,转膜,封闭1 h,分别加入一抗(1∶500,MMP-3,MMP-13),4℃摇床过夜,PBST洗涤三次,二抗(1∶1000)室温孵育1 h,PBST洗涤,化学发光法显色后显影、定影。
1.4.6 PCR法测定TIMP-1的mRNA表达
取兔手术侧关节软骨退变组织样品约20 mg,剪碎搅拌混匀,按RNA提取试剂盒说明书操作。测浓度后保存在-80℃低温冰箱。合成cDNA及反转录根据试剂盒(Code No.9160)的说明书操作。荧光实时定量PCR依据试剂盒说明书操作,设置如下:预变性(95℃,5 min);退火(60℃,30 s);延伸(72℃,20 s),共40个循环;溶解曲线:60~95℃条件下,每个循环温度升高0.5℃,维持20 s,共71循环。取10μl PCR产物在1%琼脂糖凝胶上进行电泳,验证PCR产物。

1.5 统计学方法
各实验重复三次,使用SPSS18.0进行单因素方差分析(One-way ANOVA),两两比较采用Bonferroni Test。P≤0.05则认为差异具有统计学意义。
2 结 果
2.1 各组兔膝关节软骨评分结果
A组关节软骨表面整齐,无裂纹、缺损、软化,无骨赘形成,评分为0分。B组为手术组,表面可见龟裂、虫蚀样变,纤维束状改变易见,动物的软骨广泛软化缺损,外露软骨下骨伴有边缘明显骨赘,评分为3.8分。给药后C组、D组、E组的兔手术侧关节软骨表面较平滑,纤维束状改变缩小并偶见,可见细小裂纹,软骨磨损程度与模型对照组比较,可见明显减轻,软骨边缘骨赘增生减轻,C组评分为3.1分,D组评分为2.5分,E组评分为1.8分,数据对比差异有统计学意义。见表2所示。模型组及小剂量联合治疗组、大剂量联合治疗组病理切片HE染色与评分结果一致,如图2所示。

表2 兔骨关节炎模型各组膝关节软骨评分结果
2.2 对HE染色的病理影响
A组关节软骨病理显示,表面及边缘均整齐排列,无裂纹、缺损、软化,无骨赘形成。模型组(B组、C组、D组、E组)的关节软骨表面粗糙不平,无弹性,明显纤维束状改变及边缘骨赘形成,伴有龟裂、软骨软化、缺损,部分软骨下骨外露。高剂量治疗组关节软骨呈黄白色,表面部分失去正常光泽,较平滑,可见小纤维束状改变,细小裂纹,软骨磨损较模型对照组明显减轻,软骨边缘骨赘增生程度明显较模型对照组轻,比中低剂量的作用都好。见图2。

图1 药物对兔膝关节软骨的影响

图2 不同剂量组药物作用下病理切片HE染色对比
2.3 药物对兔膝关节液中NO、IL-1β的含量影响
通过与A组空白对照组与B组模型对照组NO、IL-1β均值比较,可以得出A组[NO:(5.97±0.9)ng/L、IL-1β:(7.03±0.8)ng/L]含量低于B组[(NO:(13.21±1.2)ng/L,IL-1β:(15.43±1.4)ng/L],差异有统计学意义。经不同剂量药物治疗后的各组,尤其是高剂量给药组的NO、IL-1β[NO:(7.32±0.6)ng/L,IL-1β:(8.43±0.4)ng/L]含量均有下降,差异有统计学意义。提示随着药物剂量的增加关节液中NO、IL-1β含量进一步降低。见图3和表3、表4。
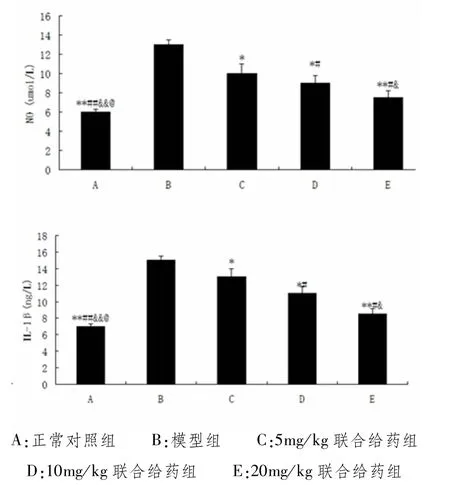
图3 药物对兔膝关节液中NO、IL-1β的含量影响
表3 ELISA检测兔骨关节炎模型各组的关节液中IL-1β含量(±s,n=8)

表3 ELISA检测兔骨关节炎模型各组的关节液中IL-1β含量(±s,n=8)
组别 n IL-1β含量(ng/L)A 8 7.03±0.8 B 8 15.43±1.4 C 8 12.47±0.5 D 8 10.49±0.3 E 8 8.43±0.4
表4 兔骨关节炎模型各组的关节液中NO含量(±s,n=8)

表4 兔骨关节炎模型各组的关节液中NO含量(±s,n=8)
组别 n NO含量(ng/L)A 8 5.94±0.9 B 8 13.21±1.2 C 8 10.01±0.5 D 8 8.95±0.4 E 8 7.32±0.6
2.4 药物对MMP-3,MMP-13的蛋白的表达影响
MMP-3,MMP-13在B组模型中高度表达,给药后均有所下调,高浓度用药后的效果最佳。见图4和表5、表6。

表5 兔骨关节炎模型各组的MMP-3的WB灰度比值
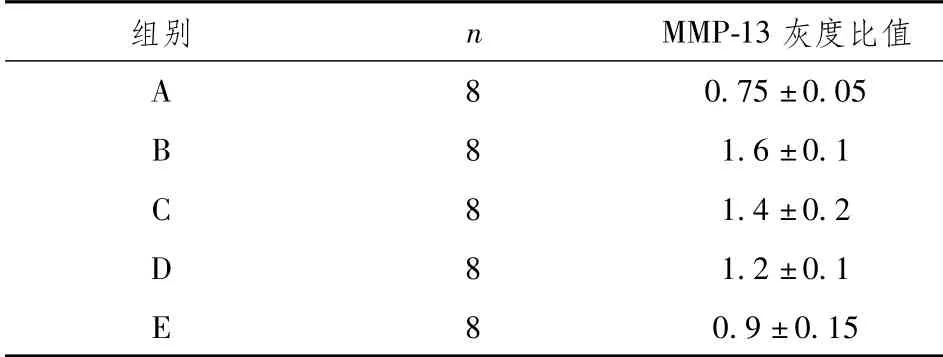
表6 兔骨关节炎模型各组的MMP-13的WB灰度比值

图4 药物对MMP-3,MMP-13的蛋白的表达影响
2.5 药物对TIMP-1的mRNA表达影响
应用PCR方法检测抑制物TIMP-1mRNA的表达,并对比各组动物之间的差异。与模型组(0.31±0.00)ng/μl相比,联合用药后的各组动物组织TIMP-1[低剂量为(0.42±0.01)ng/μl,中剂量为(0.55±0.02)ng/μl,高剂量为(0.73±0.01)ng/μl]的表达明显减少。表达量的减少与浓度增加有关。见图5和表7。

图5 药物对TIMP-1的mRNA表达影响

表7 RT-PCR检测兔骨关节炎模型各组的TIMP-1的mRNA水平的表达
3 讨 论
研究证实,骨关节炎病变部位的软骨细胞和滑膜细胞都高表达基质金属蛋白酶系MMPs。MMPs主要是在软骨降解过程中起作用,大部分软骨细胞外基质都被MMPs水解,导致软骨细胞外基质降解[8-10]。而基质金属蛋白酶抑制剂(tissue inhibitors of metalloproteinase,TIMPs)阻断细胞外基质的降解,是最重要的MMPs生理性抑制剂[11-12]。TIMPs同时还能间接地影响细胞信号的传递[13]。TIMPs与MMPs按1∶1的比例结合,TIMPs氨基末端结合MMPs后,产生位阻效应,抑制MMPs的活性,阻断MMPs对软骨基质的降解活性,减少骨关节炎的发生发展[14-15]。综上所述,MMPs及抑制物TIMPs调控软骨基质的降解过程[16-18]。生理状态下,MMPs与TIMPs按1∶1的比例结合通过位阻效应减少骨软骨基质的降解;病理状态下,如本研究的OA动物模型所示,MMPs水平明显增高导致MMPs-TIMPs失去了动态平衡。在力学负荷和局部炎性因子分泌等共同作用下,软骨基质中的II型胶原被降解,破坏了软骨组织关键性拱形纤维结构,导致细胞外基质不完整并失去弹性,降低了正常的包埋和筛滤作用。最终软骨细胞裸露于软骨基质外,在炎性因子和MMPs的作用下,软骨中基质成分游离,蛋白多糖、软骨胶原持续被破坏,最终出现软骨降解和破坏,临床表现为骨关节炎[19-20]。
本实验通过建模,模拟了骨关节炎的病变发生发展,通过对模型进行了联合药物治疗,探讨了不同药物浓度的作用,证明联合用药能延缓OA进程,起到很好的治疗作用。本研究从临床评分、免疫组化、细胞因子的蛋白表达及RNA水平表达等四个层面,验证了双氯芬酸联合不同浓度乙酰水杨酸的治疗效果。我们的研究证实,通过两种药物联合治疗,能够降低骨关节炎的临床评分,降低MMP-3,MMP-13的蛋白表达下调,上调TIMP-1的mRNA表达。由此我们推断联合用药能够恢复软骨基质的合成和降解之间的相对平衡,逆转关节软骨的降解破坏过程。
综上所述,乙酰水杨酸联合双氯芬酸逆转了关节软骨降解,从而对骨关节炎临床进程起到重要的延缓作用。不同浓度的联合用药,均取得良好的治疗效果。

