突破“摩尔”这座大山
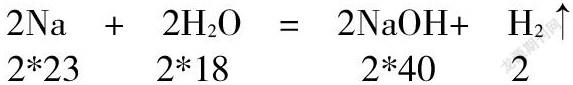
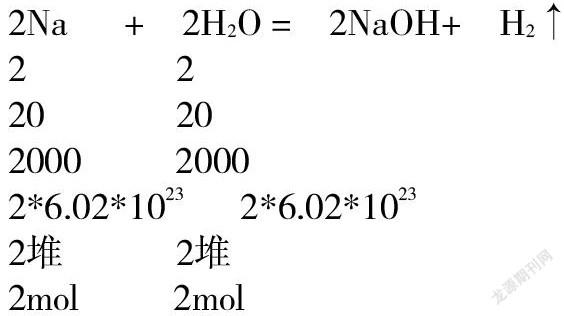
摘要:研究目的:“物质的量”是横亘在学生面前的一座大山,不选考化学,会面临很多专业报考受限的窘境,创新思路,拿下摩尔这座山头。方法:化学计算解决一个定量问题,如果和系数开比例,计算会简单些。规定“12克碳-12含有的碳原子数为一堆。”一堆任何物质都含有6.02*1023个微粒。这是个常数,我们称之为阿伏伽德罗常数,用NA表示。标准堆,“12克碳-12为一堆”,一堆任何物质的质量以克为单位数值都等于它的化学式的式量。
结果:通过多年探索所教学生选化学比例保持在60%以上,会考合格率超97.6%
结论:质量的单位是克,物质的量的单位是堆。题目给了克数,我们只要换成堆数,就可与系数开比例了。要点:除着进去、乘着出来。
关键词:和系数开比例;系数比代表堆数比;克数换成堆数
高一化学学习中,“物质的量”是横亘在学生面前的一座大山,很多同学因为学习不得法,望而却步,对化学学习兴趣了然,从而将精力转向其他学科,在新高考的背景下,即使会考化学不及格,也不影响参加高考,但是面临很多专业报考受限的窘境。
在新高考、新课本的形势下,创新思路,拿下摩尔这座山头,使学生学习一路坦途。激发学生学习兴趣,为学生今后的发展,为建设祖国,报效社会,成为屠呦呦、钟南山那样的偶像,打下坚实的基础。
以鲁科版高一新课本为例,集中阐述一点思路和做法,供大家参考。
首先,用视频进行情景再现,取一小块钠,质量为4.6克,放入事先在烧杯里滴入几滴酚酞的水中,观察现象,同学们很容易通过观察和回忆,答出,浮、熔、游、响、红。这个化学反应中,反应物为钠和水,生成物分别为氢氧化钠和氢气。提问,我们能否根据发热病人的体温高低,随意改变服用药物的剂量呢?显然是不行的。这就需要一个定量问题,我们只知道反应物和生成物是不够的,还需要进一步弄清他们的数量关系,依据质量守恒定律,和化学方程式进行计算即可。
2Na + 2H2O = 2NaOH+ H2↑
2*23 2*18 2*40 2
用质量比开比例进行化学计算,对高一学生还是比较容易做到的。我们发现计算时的数字有点大,过二十甚至过百,都很正常。大家对二十以内的加减乘除特别熟悉。有没有可以把数字变得较小,计算更加轻松的办法呢。答案是有的。化学方程式中的系数一般较小,如果和系数开比例,计算会简单些。我们知道,化学方程式中系数代表微粒的个数比,而微粒个数显然直接联系现实中的化学反应。那么,科学家就引入了一个新的物理量,称为物质的量,符号:n,用来表示物质量的多少,它的单位是“堆”用符号mol表示。一堆一堆的来表示物质的量的多少。像极了自行车可以作为代步工具,会使我们上学行路方便了许多。摩尔(mol)作为一个单位就是来解决化学计算太繁杂的。一堆有大有小,含义不固定不行。科学家制定了“堆”的标准,使得一堆有了科学的含义。规定“12克碳-12含有的碳原子数为一堆。”我们用N来表示微粒个数。那么每一堆物质都含有相同的微粒个数,是多少个呢,这不用我们去查,科学家早查好了,大约6.02*1023个。换句话说,一堆任何物质都含有6.02*1023个微粒。这是个常数,我们称之为阿伏伽德罗常数,用NA表示,记作6.02*1023mol-1。他是有单位的。不过我们在考试中一般都假设阿伏伽德罗的数值为NA,好的,我们先做一下练习,一堆有6.02*1023个,半堆呢,10堆呢。呵呵,同学们答得很准确。我们一般说0.5NA,10NA,下面我们再来看,下面的化学方程式:系数比与微粒个数比
不难推出系数比还可代表堆数比,即物质的量之比。如果知道了反应体系中某物质的堆数,即可利用系数比开比例进行计算了。可是没有一种衡器像天平,可以称量物质的质量来量取物质的量。怎么办呢,我们再来看,标准堆,“12克碳-12为一堆”。一堆碳是12克,一堆其他物質呢,简而化之,一堆任何物质的质量一克为单位,都等于它的化学式的式量,比如,一堆钠的质量为23克,一堆水的质量是18克。我们称为摩尔质量,用M表示,与式量的区别在于它有单位是g.mol-1不过无所谓,化学计算中间过程,可以不用写单位。只要知道,质量的单位是克,物质的量的单位是堆。题目给了克数,我们只要换成堆数,就可与系数开比例了。我们在实验中投入的是4.6克钠,现在先换堆数,我称作除一下,简称除着进去。4.6/23得到4.6克钠为0.2堆,不难算出参加反应的水也是0.2堆,生成的氢氧化钠也是0.2堆,氢气为0.1堆。若问生成的物质质量,再乘一下,或者说乘着出来,氢氧化钠的质量是0.2*40=8(克)。计算要点就是除着进去、乘着出来。登山的到了这一步,难度就已克服了一半。接下来做练习。分别计算下列物质的物质的量(将克数换算成堆数、除以下)1、5.4克和H2O。2、19.6克H2SO4。3、4克NaOH。4、11克CO2 5、10克CaCO3。6、11.7克NaCl。7、11.2克Fe。注意公式n=m/M.再分别计算0.2堆(mol)下列物质的质量(将堆数换算成克数、乘以下)1、H2O 2、H2SO4 3、NaOH。4、CO2 5、CaCO3 6、 NaCl 7、Fe。公式是m=n*M
结论与思考
物质的量作为新授课,要以解决化学计算系数比的升级2.0版为重点,不要过多纠缠阿伏伽德罗常数,和摩尔的叫法。让学生尽可能直观的了解,个数与堆数,质量和堆数的相互转换,就像步行改为骑自行车。摔跟头是不可避免的,不能学周仓扛着马撵关老爷。不会骑,就扛自行车上学,成为一种负担。摩尔也无非像理发店里剃头的王翠芬阿姨,改成了洗剪吹的托尼老师。咱也觉得人家叫王浩然比王建国洋气,李梓萱比李雪琴显得有文化。你要觉得接地气,咱先用堆代替摩尔顶一会。啥时候,和国际接轨了,再高大上的叫摩尔,或摩。
参考文献:
[1]王磊陈光巨[M]普通高中化学教科书必修第一册济南山东科学技术出版社2019年7月21-22.
作者简介:
赵广河,男,生于1965年12月,1985年7月毕业于济南师专化学系,高级教师。1985年72011年获济南市长清区化学优质课一等奖。

