枯草芽孢杆菌Q125降解黄曲霉毒素B1发酵条件优化及活性物质分析
刘亚楠,彭丹丹,王 敏,张明丹,黄继红,刘 娜
河南工业大学 生物工程学院,河南 郑州 450001
黄曲霉毒素(aflatoxin)属于真菌毒素,主要是由广泛分布的曲霉、寄生曲霉等产毒菌株产生的次级真菌代谢物,对食品安全构成巨大风险,具有高毒性、诱变性以及致癌性[1-2]。其中黄曲霉毒素B1(aflatoxin B1,AFB1)具有强烈的毒性,是双呋喃代谢物。此外,黄曲霉毒素对人和动物均有多种毒理学效应,可导致人和动物的肝、肾、肺等器官的异常,具有强肝毒性;低剂量可导致免疫力低下、肝功能受损、消化功能紊乱,更容易感染疾病;高剂量可能导致人体损伤,引发癌变(肝癌)甚至危及生命[3-6]。
目前,黄曲霉毒素可以通过物理、化学和生物法降解。由于安全性、营养保留以及成本要求等限制,物理和化学方法在实际生产中难以推广使用[7-8]。生物降解对产品质量、安全和生态环境的影响最小,且减少或消除食品和饲料中黄曲霉毒素温和而有效[9]。Xia等[10]研究发现枯草芽孢杆菌JSW-1的上清液对AFB1的降解率为67.2%。Guan等[11]研究橙色黏球菌ANSM068(Myxococcusfulvus)降解AFB1的最适培养条件为初始pH值7.5、温度30 ℃,此条件下AFB1降解率76.6%。Kong等[12]采用中心复合试验设计和响应面法优化红球菌(Rhodococcuserythropolis)降解AFB1的效率,AFB1降解率从28.7%提高到95.8%,较优化前提高了2.3倍。尽管这些真菌和细菌能够有效降解AFB1,但在实际使用中受到温度或低降解率的制约。因此,作者以筛选的枯草芽孢杆菌Q125菌株为研究对象,进行优化并提高其降解AFB1的效率,并对其解毒活性物质进行初步探究,为进一步将枯草芽孢杆菌应用到实际生产中提供理论支撑。
1 材料与方法
1.1 试验材料
1.1.1 菌种
枯草芽孢杆菌Q125由作者所在实验室保存。
1.1.2 培养基
种子及发酵培养基均采用营养肉汤(NB)培养基(g/L):牛肉膏3.0、蛋白胨10.0、NaCl 5.0,pH自然,121 ℃高压灭菌20 min。
1.1.3 主要试剂
AFB1标准品:生工生物工程(上海)股份有限公司;甲醇(色谱纯):天津市四友精细化学品有限公司;二氯甲烷:天津市科密欧化学试剂有限公司;硫酸铵、无水乙醇、丙烯酰胺、四甲基乙二胺(TEMED)、十二烷基硫酸钠(SDS)、过硫酸铵(AP)、三羟甲基氨基甲烷(Tris)、巯基乙醇、考马斯亮蓝R-250、冰乙酸、Marker等均为国产分析纯。
1.2 仪器与设备
YXQ-LS型立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;TS-200B型恒温摇床:上海天呈实验仪器制造有限公司;多功能酶标仪:瑞士Tecan有限公司;Muitifuge X1R型高速冷冻离心机:Thermo Fisher公司;PHS-3C型精密酸度计:上海大普仪器有限公司;DYY-6C型电泳仪:北京六一生物科技有限公司;DZKW-S-4型电热恒温水浴锅:北京市永光明医疗仪器有限公司;LC-2030C型高效液相色谱仪:日本岛津公司。
1.3 试验方法
1.3.1 生长曲线的测定
在无菌环境下将菌株Q125接种于100 mL NB液体培养基中,置于37 ℃摇床(180 r/min)培养。0~12 h每2 h取样测定D(600),12~72 h每12 h测定D(600),对照组为NB培养基。横轴为培养时间、纵轴为D(600),绘制生长曲线[13]。
1.3.2 单因素试验
将菌种接至灭菌的100 mL NB液体培养基中,37 ℃摇床(180 r/min)培养18 h。待菌液D(600)达到1左右,以5%(V/V)接种量转接至100 mL NB中,置于摇床发酵36 h,4 ℃、10 000 r/min条件下离心10 min,上清液用0.22 μm滤膜过滤。将900 μL上清液与100 μL黄曲霉毒素B1(10 μg/mL)混合,置于已灭菌的10 mL离心管中,37 ℃、180 r/min避光培养96 h。无菌NB液体培养基为空白对照。分别考察发酵时间(24、36、48、60 h)、接种量(1%、5%、10%、15%、20%)、初始pH(5.0、5.5、6.0、6.5、7.0、7.5、8.0)、发酵温度(28、31、34、37、40 ℃)对AFB1降解率的影响。
1.3.3 AFB1降解率的测定
AFB1的提取及检测参考Teniola等[14]方法并略做修改。向反应结束的样液中加入1 mL二氯甲烷,重复3次,合并有机相,氮气吹干,1 mL甲醇复溶,0.22 μm滤膜过滤,HPLC检测。检测条件如下。C18色谱柱:SB-C18,4.6 mm×250 mm,5 μm;流动相:V(甲醇)∶V(水)=60∶ 40,流速0.8 mL/min,运行时间11 min,柱温32 ℃;检测器:光电二极管阵列(PDA);检测波长365 nm。AFB1降解率计算公式如下。
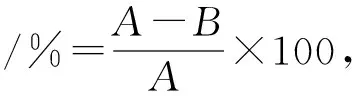
式中:A、B分别表示添加AFB1的对照峰面积和试验组峰面积。
1.3.4 响应面试验设计
根据 Box-Behnken 设计原理,基于单因素试验,选择合适的因素与水平进行响应面试验设计及分析。
2 结果与分析
2.1 生长曲线
生长曲线的测定在微生物学研究中有着重要的意义,可以直观反映出细菌生长和代谢的规律。由图1可知,菌株在0~12 h生长迟缓,12 h后生长较快进入对数生长期,在培养时间到达24~60 h时,D(600)趋于稳定。因为稳定期的某些代谢产物的次级代谢产物在该阶段产生,这些产物可能包括抗生素、多肽、某些蛋白或代谢分泌到胞外的酶类,所以稳定期是发酵生产的最适收获期[15]。因此,须对刚进入稳定期前后的发酵时间进一步研究。
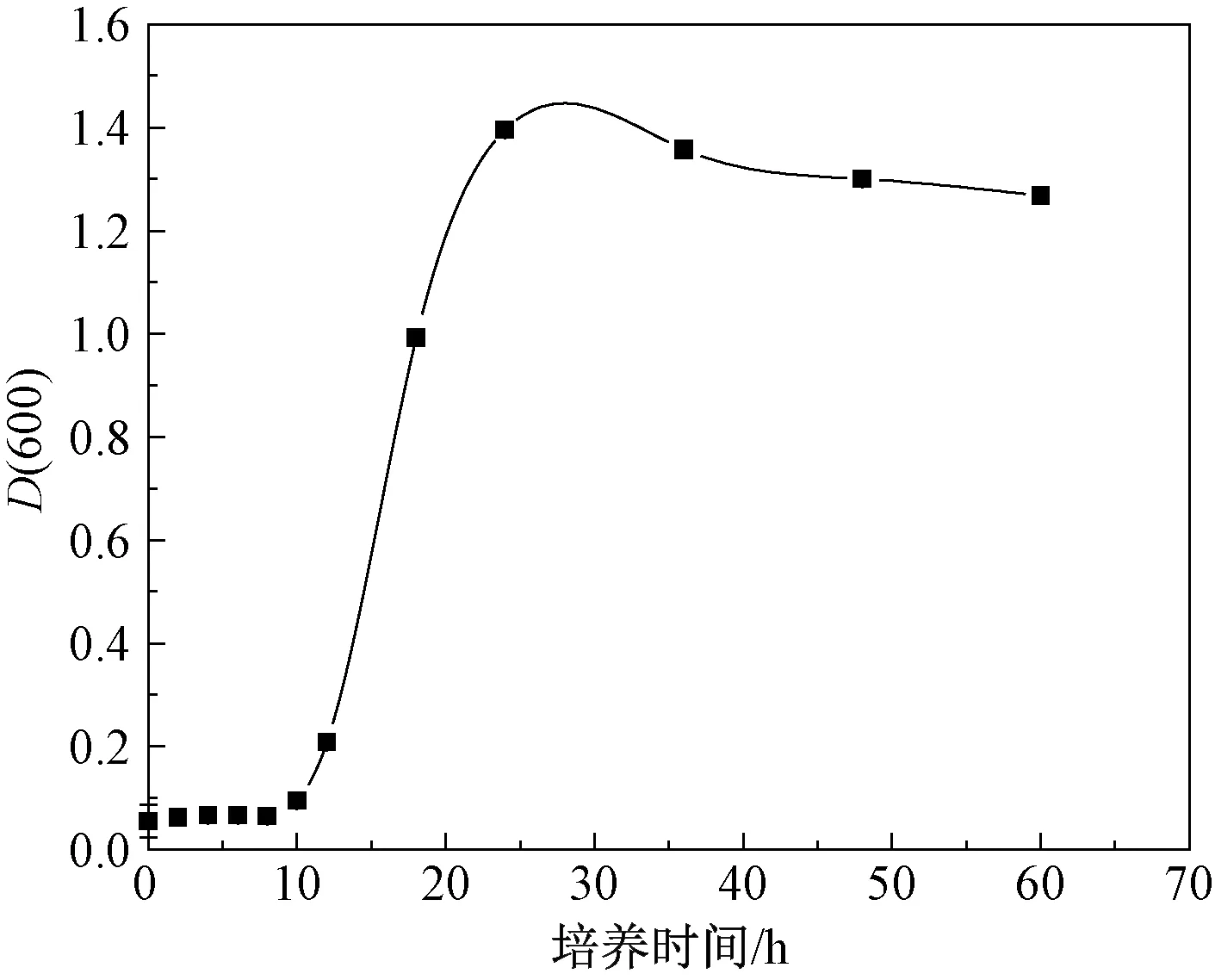
图1 37 ℃条件下Q125在种子培养基中的生长曲线Fig.1 Growth curve of Q125 in seed broth at 37 ℃
2.2 单因素试验结果
2.2.1 发酵时间对AFB1降解率的影响
发酵周期的长短对菌株降解AFB1有一定的影响,发酵初期菌体生长旺盛,能合成大量降解AFB1的活性物质。由图2可知,发酵36 h,AFB1降解率达到69.24%。发酵60 h与36 h的降解效果差异显著(P<0.05)。说明60 h时,细菌进入衰亡期,细胞更容易老化,细胞存活率逐步下降,降解AFB1的能力下降[16-17]。因此,发酵时间36 h为最优周期。

图2 发酵时间对AFB1降解率的影响Fig.2 Effect of fermentation time on the degradation of AFB1
2.2.2 接种量对AFB1降解率的影响
恰当的接种量对降解AFB1的活性物质的高产是至关重要的。由图3可知,接种量5%的条件下降解率相对较高,为70.96%。随着接种量的增加,降解率呈下降趋势。可能是由于菌体的大量繁殖以至于维持细胞所需营养物质供不应求,引起细胞内分解代谢超过合成代谢,不利于降解产物的产生,同时不足以满足发酵必备营养[18-19]。综合考虑,选择5%作为适宜菌株接种量。

图3 接种量对AFB1降解率的影响Fig.3 Effect of inoculation dosage on the degradation of AFB1
2.2.3 初始pH值对AFB1降解率的影响
培养基不同初始pH值可能会影响培养基中微生物对营养物质的吸收,以及代谢反应中各种酶的活性。由图4可知,初始pH5.5~7.5时,降解率保持稳定,差异不明显(P>0.05)。当pH值低于5.5或高于7.5时,AFB1的降解率呈下降趋势。这与Guan等[11]研究结果基本一致。出现这一现象的原因可能是过酸或过碱改变了培养基的环境,因为细菌细胞膜表面电荷性质受pH值控制,影响了细胞膜的稳定性以及对营养成分的汲取[15]。

图4 初始pH值对AFB1降解率的影响Fig.4 Effect of initial pH value on the degradation of AFB1
2.2.4 发酵温度对AFB1降解率的影响
温度会影响细胞内酶活力和细胞膜的通透性,进而影响细菌的生长繁殖。由图5可知,温度在28~40 ℃范围内,菌株降解AFB1的能力呈先上升后下降的趋势,当温度为37 ℃时,降解率最高(78.45%)。这与Farzaneh等[20]研究发现一株枯草芽孢杆菌UTBSP1在发酵温度35 ℃时,上清液对AFB1降解率最高基本一致。Guan等[21]也报道了降解AFB1的嗜麦芽窄食单胞菌35-3的最佳降解温度为37 ℃。
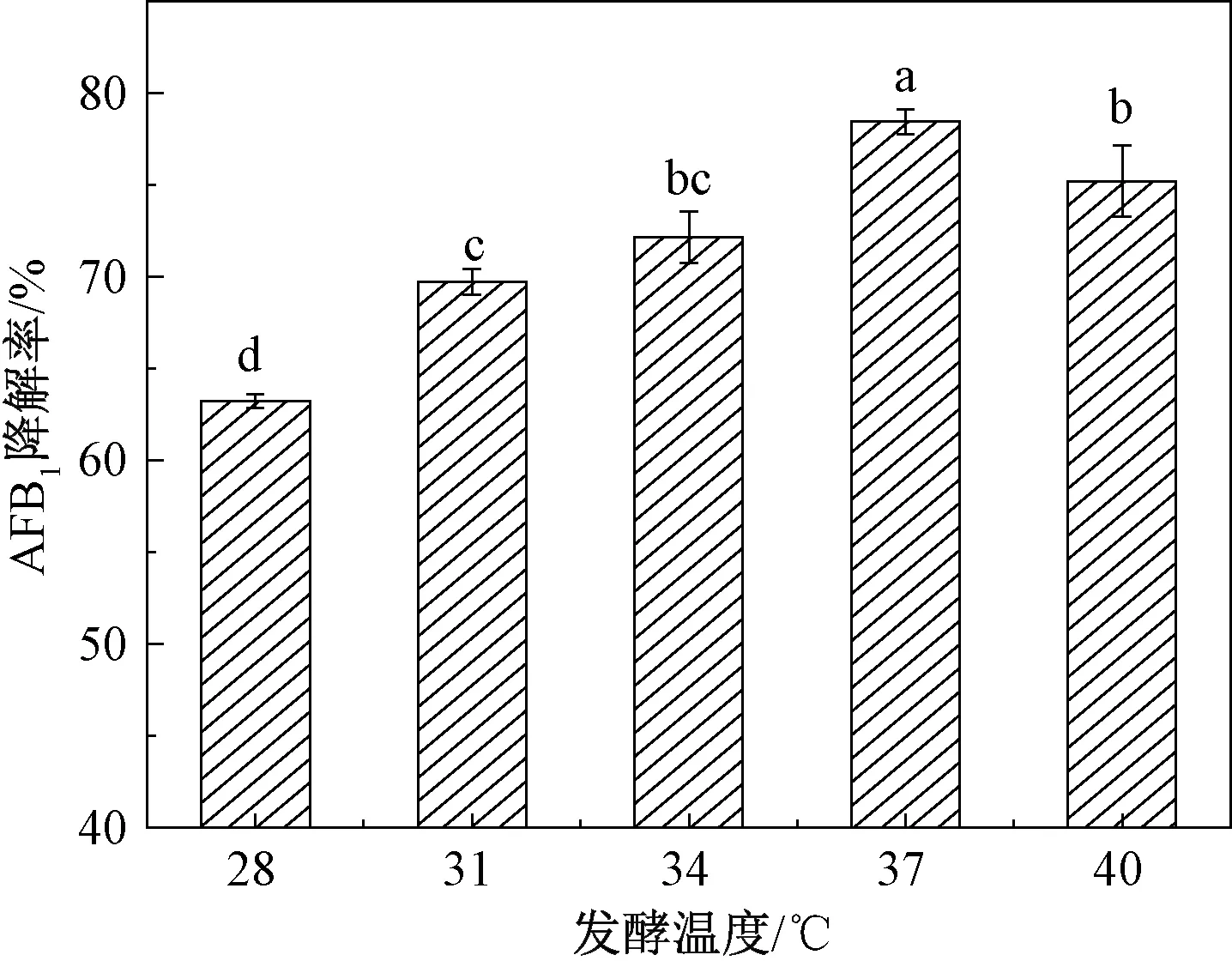
图5 发酵温度对AFB1降解率的影响Fig.5 Effect of fermentation temperature on the degradation of AFB1
2.3 响应面设计与结果
在单因素试验结果的基础上,结合软件Design Expert 8.0.6确定枯草芽孢杆菌Q125降解AFB1的最优水平。试验因素为发酵时间(A)、接种量(B)、发酵温度(C),AFB1降解率为响应值。因素与水平见表1。

表1 响应面试验的因素与水平Table 1 Factors and levels of response surface experiments
响应面设计及结果如表2所示,回归模型及方差分析如表3所示。

表2 响应面设计及结果Table 2 Response surface design and results
进行回归分析后,可拟合出AFB1降解率的响应面模型:
Y=79.68-2.81A+0.52B-2.14C-1.02AB-0.30AC-0.46BC-6.38A2-3.28B2-5.91C2。
由表3可知,模型P(0.003 1)<0.05,说明模型回归显著;失拟项P(0.051 1)>0.05,影响不显著;回归方程决定系数R2=0.927 7,说明试验所得方程与实际拟合误差较小,模型拟合程度良好,可用于枯草芽孢杆菌Q125发酵条件对AFB1降解影响的分析与预测。利用Design-Expert软件得到二次回归方程以及统计结果分析,表明试验因素之间交互作用不显著。

表3 回归模型方差分析及显著性检验Table 3 Regression model variance analysis and significance test
2.4 模型验证
响应面模型预测表明,当发酵时间38.64 h、接种量5.76%、发酵温度36.4 ℃时,AFB1降解率最高,为79.89%。为了验证模型预测与试验测定值是否一致,在此最优水平下进行3次重复试验,结合实际培养条件,将最佳水平确定为发酵时间38.6 h、接种量5.8%、发酵温度36 ℃。试验结果显示,枯草芽孢杆菌Q125对AFB1降解率为79.09%,与预测值无显著差异(P>0.05)。
2.5 菌株Q125发酵上清液活性组分初步探讨
2.5.1 活性组分蛋白电泳
通过不同硫酸铵饱和度对AFB1降解率影响的研究可知,当饱和度为80%时,AFB1的降解率达到最高(56.47%)。这与Song等[22]研究结论一致。进一步对AFB1活性降解酶分子量进行测定,按照Motomura等[23]的方法对80%的沉淀进行SDS-PAGE电泳。由图6可知,呈现出的蛋白分子质量在30~31 kDa和43~66.2 kDa之间。综上所述,从菌株Q125上清液中分离出来的粗酶液对AFB1具有降解活性。

注:M为标准蛋白;1为80%饱和硫酸铵沉淀蛋白条带。图6 SDS-PAGE电泳图Fig.6 SDS-PAGE electrophoresis
2.5.2 热处理、SDS和蛋白酶K对AFB1降解率的影响

注:热处理1为煮沸15 min;热处理2为高温高压20 min。图7 热处理、蛋白酶K处理、SDS处理的枯草芽孢杆菌Q125细胞上清液的AFB1降解率(96 h)Fig.7 Degradation of AFB1 by heat-treated, proteinase K, and SDS-treated cell-free supernatant of Bacillus subtilis Q125.(96 h)
由图7可知,降解温度为37 ℃时,蛋白酶K处理与对照组相比降解AFB1的能力降低了5.05%(P<0.05);SDS处理后,AFB1降解能力显著降低了36.72%(P<0.05)。上述结果表明,降解过程中菌株Q125的上清液可能含有蛋白质或酶。Sangare等[24]研究铜绿芽孢杆菌N17-1降解AFB1时,蛋白酶K处理培养上清液,降解AFB1的能力降低了12.3%;用蛋白酶K+SDS处理培养上清液,降解活性显著降低34.0%。Shu等[25]研究结果表明蛋白酶K略影响降解活性(P>0.05);而SDS处理时,降解活性明显下降。更重要的是热1和热2处理上清液时,降解活性没有下降,反而增强了AFB1的降解效果。此类现象在其他微生物中也被发现,称为酶的热激活现象。如Wang等[26]发现Fusariumsp.WCQ3361的降解活性物质具有较高的热稳定性,在沸水浴10 min条件下,AFB1的降解能力仍保留99.40%。Sangare等[24]研究发现上清液沸水浴10 min时,AFB1降解活性提高3.49%。此外,Kavitha等[27]从多黏菌芽孢杆菌菌株VLB16中分离出具有耐热性的抗真菌蛋白,在121 ℃、15 min处理条件下仍保持很高的活性。
2.5.3 降解温度对AFB1降解率的影响
菌株Q125培养上清液在不同降解温度下对AFB1的降解情况不同(图8)。在培养96 h的条件下,降解温度40~60 ℃时,AFB1的降解率随着温度升高显著上升(P<0.05)。降解温度为60 ℃时,AFB1降解率达到100%,且降解温度60~80 ℃时,降解率仍保持在100%,再次证明菌株Q125上清液中活性成分有较好的热稳定性。这与Shu等[25]发现BacillusvelezensisDY3108培养上清液可在20~90 ℃的较宽温度范围内呈现较高的降解率的结论一致。

图8 降解温度对菌株Q125降解AFB1的影响Fig.8 Effect of degradation temperature on AFB1degradation by Bacillus subtilis Q125
3 结论
枯草芽孢杆菌Q125在降解AFB1的过程中,发酵温度和发酵时间对AFB1降解率有显著影响。通过响应面优化得到最佳发酵条件:发酵时间38.6 h、接种量5.8%、发酵温度36 ℃,AFB1的降解率提升了14.23%。以最优发酵条件为基础,研究热处理、蛋白酶K、SDS及降解温度对降解AFB1的影响,发现培养上清液中的蛋白质或酶可能是降解AFB1的原因,并且具有较广的反应温度范围以及优异的热稳定性。发酵和降解条件的优化显著提高了枯草芽孢杆菌Q125发酵上清液对AFB1的降解效率,降解温度在60~80 ℃时,降解率均能达到100%。

