对比剂后急性肾损伤的临床研究进展
孙耿耿 王玉宝 徐杰
[摘要]对比剂后急性肾损伤(PC-AKI)是目前临床上外源性肾衰竭的第三大致病因素,排在前两位的是肾血流灌注不足和肾毒性药物损伤。随着影像诊疗技术的升级和广泛应用,PC-AKI 目前在普通人群的发生率已上升至1.5%~13%,高危人群甚至高达12%~27%,且无有效、根治性的解救措施。因此深入研究 PC-AKI 是满足临床碘对比剂合理使用、避免外源性肾损伤的迫切需求。本文以综述形式阐述 PC-AKI 的最新临床研究进展,内容主要包括:致病机制;独立的危险因素如对比剂理化性质和患者肾功能,评估肾小球滤过率(eGFR)、血胱抑素 C(Cys C)、血肌酐(sCr)等变化值;现有的预防措施,为进一步探索水化预防的规范性诊疗模式和长期受益效果奠定理论基础。
[关键词]对比剂后急性肾损伤;对比剂;肾毒性;水化预防
[中图分类号] R692 [文献标识码] A [文章编号]2095-0616(2021)23-0066-04
Clinical research progress of post contrast-acute kidney injury
SUNGenggeng1 WANGYubao2 XUJie2
1.Clinical Pharmacy Room of Pharmacy Department, Lianyungang Municipal Oriental Hospital Affiliated to Bengbu Medical College, Jiangsu, Lianyungang 222000, China;2.Department of Cardiology, Lianyungang Municipal Oriental Hospital Affiliated to Bengbu Medical College, Jiangsu, Lianyungang 222000, China
[Abstract] Post contrast-acute kidney injury (PC-AKI) is the third major pathogenic factor of exogenous renal failure in clinic at present, with inadequate renal blood perfusion and nephrotoxic drug injury ranking in the top two. With the upgrade and wide application of imaging diagnosis and treatment technology, the incidence of PC-AKI has now risen to 1.5%-13% in the general population and even up to 12%-27% in the high-risk group, with no effective, radical antidote. Therefore, an in-depth study of PC-AKI is an urgent need to meet the rational use of clinical iodine contrast agent and to avoid exogenous kidney injury. In this paper, the latest clinical research progress of PC-AKI was summarized, including pathogenic mechanism; Independent risk factors, such as physical and chemical properties of contrast medium and renal function of patients, to evaluate the changes of glomerular filtration rate (eGFR), serum cystatin C (Cys C) and serum creatinine (sCr); Existing preventive measures. This paper may lay a theoretical foundation for further exploration of the standardized diagnosis and treatment and long-term benefit effect of hydration prevention.[Key words] Post contrast-acute kidney injury; Contrast agent; Nephrotoxicity; Hydration prevention
随着影像、介入诊疗技术的发展和广泛应用,碘对比剂的临床使用亦大幅增多。对比剂后急性肾损伤(postcontrast acute kidney injury,PC-AKI)的发生率已上升为1.5%~13%[1];而在糖尿病、慢性肾功能不全、高龄等高危人群中的发生率甚至高达12%~27%[2]。PC-AKI 已成为医院获得性肾衰竭的第三大致病因素[3],目前無有效的根治疗法。如何合理使用碘对比剂,避免药物性肾损伤是目前临床研究的热点。本文依据最新发布的《肾病患者静脉注射碘对比剂应用专家共识》[4]选用 PC-AKI 这一术语替代对比剂肾病(contrast-induced nephropathy, CIN),关注其危险因素、识别分层和水化预防等最新研究进展综述如下。
1致病机制
目前研究的机制认为[5]PC-AKI 是由于机体受到药物直接化学毒性、高渗透压性、高黏度等影响,导致肾脏血流改变,肾髓质缺血缺氧,舒缩激素比例失衡等诱发。
1.1直接化学毒性
碘离子原子量大,吸收 X 射线的能力强,但对肾小管上皮细胞和内皮细胞有直接的化学毒性,能够直接激活凋亡相关信号通路,破坏线粒体活性,使得紧密连接的相关膜蛋白重新分布,损伤屏障功能[6-7]。这种直接的化学毒性还体现在其离子性上,先短时扩张肾血管,然后持续性长时间的痉挛性收缩,导致肾髓质进一步的缺血缺氧损伤[8]。
1.2高渗透压
高渗透压是 PC-AKI 的独立危险因素之一。当对比剂渗透压≥800 mOsm/kg H2O 时,肾小管液的渗透压被迅速升高,明显高于周围的肾髓质导致代谢和氧的需求量增加。与此同时肾脏受到药物直接化学毒性的影响,两者协同恶化肾髓质损伤。研究表明高渗透压性还可以诱导肾小管 DNA 的断裂和凋亡,激发血管舒缩激素释放失衡,缩血管激素如腺苷、内皮素、自由基等被大量释放,进一步减少肾血流[9]。
1.3高黏度
当对比剂渗透压<800 mOsm/kg H2O 时,黏度的影响性会显著上升,成为仅次于渗透压的重要致病因素。正常情况下,肾小管内液体黏度是低于血浆的。输注对比剂后(尤其是黏度较大的碘克沙醇),高黏性使得肾血流流体阻力和血管内压力显著增加,肾髓质血流和肾小球滤过率减少,药物在肾脏的滞留时间相对延长。
2独立危险因素
2.1碘对比剂的种类及理化性质
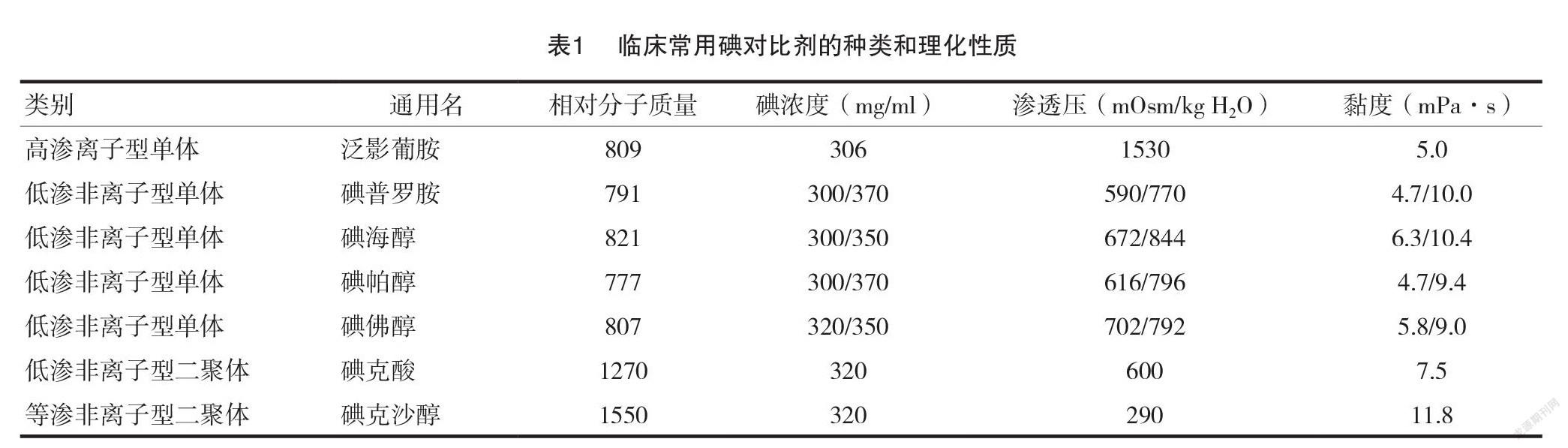
临床常用的低渗对比剂(low-osmolarity contrast media, LOCM)如碘普罗胺、碘佛醇等,渗透压约为610 mOsm/kg H2O;等渗对比剂(iso-osmolarity contrast media, IOCM)如碘克沙醇,渗透压与血浆大致相等,但黏度偏高为11.8 mPa ·s,见表1。 IOCM 渗透压更低相对更安全,但二聚体结构使其黏性增大,仍存在较大的肾损伤风险。研究表明碘对比剂的选择应建立在保证影像图像质量的基础上,选用安全性相对较高的低渗、低黏度品种,并适度的控制用量[10-12]。
2.2肾功能
患者基线肾功能差合并 CKD 或肾癌等,PC-AKI风险将显著增加。诊断标准采用改善全球肾病预后组织推荐的[13]:血清肌酐绝对值升高≥26.5μmol/L (0.3 mg/dl),或较之前基线值增高幅度≥50%。此标准更适于筛选出高危患者。临床研究发现采集患者给药前1~2 d 和给药后24、48、72 h、第7天的肾小球滤过率(eGFR)、血胱抑素 C(Cys C)和血肌酐(sCr)变化值,可以对 PC-AKI 进行综合评估。
2.2.1 eGFR eGFR是 PC-AKI 最重要的独立危险因素,风险阈值为30 ml/(min ·1.73 m2)。若 eGFR <30 ml/(min ·1.73 m2)或30~44 ml/(min ·1.73 m2)合并高危因素可以在综合考虑获益/风险比的情况下谨慎使用[4]。成人 eGFR 值推荐采用临床公认的“金标准”MDRD 方程,或是更简单、更省时、成本更低的 CKD-EPI 方程。针对儿童建议采用修订的Schwartz 方程,eGFR=36.5×身高/sCr。
2.2.2 Cys C、sCr研究表明Cys C、sCr水平也是PCAKI 发生的影响因素。当Cys C <1.09 mg/L 和(或)sCr<77.6μmol/L 有较高的阴性判断价值,可以排除 PC-AKI 的发生;但两者的联合应用并未提高预测的准确率[14]。
3预防措施
3.1风险评估、辨识高危因素、分层患者
PC-AKI 已知的高危因素包括肾病史、肾功能不全[eGFR <30 ml/(min ·1.73 m2)或>120 ml/(min ·1.73 m2)]、老龄、糖尿病等。给药前应充分收集患者的基线资料包括性别、年龄、BMI 值、药物过敏史、基础疾病等。监测血肌酐值计算 eGFR,同时运用预测工具如 Mehran 评分(局限性大、不适宜整体人群)、CHA2DS2-VASc 评分(简单灵活)、Chen 评分,进行充分的筛查和风险分层[15]。
3.2停用肾毒性药物
3.2.1肾毒性药物临床常用的肾毒性药物包括氨基糖甙类抗生素、非甾体消炎药、两性霉素 B、环孢素、万古霉素、阿昔洛韦、大剂量袢利尿剂等。高危患者建议在使用对比剂前停用此类药物至少≥1 d。
3.2.2双胍类双胍类本身不具有肾毒性,但药物以原型的形式经肾脏排泄出体外。肾功能的异常将影响排泄,使其在体内大量蓄积诱发乳酸酸中毒。正在服用该类药物的患者,若肾功能基线正常,可在检查前停用,结束后复查Scr肾功正常者48 h 后继续服用。若基线异常,需在检查前至少48 h 停用,其余同前。
3.3水化预防
3.3.1生理盐水水化水化预防的作用机制目前认为是增加肾血流量、稀释肾小管内对比剂浓度和促舒血管激素释放有关。口服水化方案推荐饮用量100 ml/h,从给药前4~6 h 持续至检查结束后24 h。静脉盐水水化优于口服,0.9%等渗盐水优于0.45%低渗盐水。《美国 CIN 专家共识》[16]建议在对比剂给药前12 h 至给药后6~24 h 持续静脉注射等渗晶体液,滴速维持在1~1.5 ml/(kg ·h)。门诊患者建议检查前3 h 至检查后12 h 静脉水化。2009年的《CIN 中国专家共识》[17]建议对于有 CIN 危险因素者应该在造影前3~12 h 至造影后6~24 h 给予等渗0.9%NS 持续静脉水化,滴速为1~1.5 ml/(kg ·h)。2011年更新的 ESUR 指南[18]建议在对比剂给药前后6 h 给予等渗0.9%NS 持续静脉水化,滴速为1~1.5 ml/(kg ·h)。2021年中国《肾病患者静脉注射碘对比剂应用专家共识》[4]推荐,在检查前1~4 h 至检查后3~12 h 静脉水化,建议使用固定的输液量前后各500 ml,或基于体重调整滴速为1~3 ml/(kg ·h)。一项大型 CAG 检查队列研究显示,水化可有效降低72 h 内 PC-AKI 的发生率( OR=0.97,P=0.01)但不会降低3个月后的肾功能不全发生率( OR=0.98, P=0.18)。這也提示了水化预防治疗可能会短期内延缓但不能从根本上阻止肾脏的功能损伤[19]。3.3.2碳酸氢钠静脉水化短时大量的静注碳酸氢钠可以碱化局部的肾脏环境,降低尿酸值保护肾脏,但容易诱发电解质紊乱和酸碱失衡。与0.9% NS 水化方案12 h ·1 ml/(kg ·h)相比,0.14% NaHCO3方案1h ·3ml/(kg ·h)需要的液体量和输液时间更少,但两者之间比较存在有限性。
3.4选用适宜的对比剂
对比剂储存于37℃的恒温箱内[20],诊疗应用时关注:①种类。首选安全系数稍高的低渗、低黏度、单体品种;②用量。根据检查部位调整用量,参考Cigarroa公式[5 ml×体重(kg)/血清肌酐值(mg/dl)];或采用血管内超声 IVUS 实现“零”剂量[21]。一项关于对比剂使用剂量与 PC-AKI 发生率关系的研究发现,使用剂量每增加100 ml,风险增加约12%;高危 CKD患者使用剂量>125 ml时,风险增加近20倍[22]。
3.5改善缺血
他汀类、抗氧化药(N-乙酰半胱氨酸、普罗布考、维生素 C)、改善循环药(尼可地尔、丹参多酚)等从作用机制上有益于改善肾脏血流、保护肾功能,但针对 PC-AKI 目前尚无确切证据证明其有效性[23-27]。
4小结
综上所述,PC-AKI 的致病机制复杂,不良事件发生率和病死率较高,采取预防措施尤为重要。给药前应积极识别危险因素,进行患者分层,重点监护高危人群(如肾功能不全、甲状腺异常、心力衰竭、糖尿病、高龄、低血压等)以及建立规范的水化预防诊疗模式。目前静脉水化方案耗时长、难执行;最佳的水化持续时间不统一;缩短水化疗程能否等效,具体应如何调整;水化预防的长期临床受益均有待验证。期待更多高质量、大数据的临床研究关注 PC-AKI 的预防。
[参考文献]
[1]王玉萍,沈世林,苏东君,等.对比剂肾病研究进展[J].介入放射学杂志,2017,26(6):572-575.
[2]Li X,Chen J,Zhang L,et a1.Clinical observation of the adverse drug Reactions causedby nonionic iodinated contrast media: Results from 109, 255 cases underwent enhanced CT examination in Chongqing, China[J].Br J Radiol,2015,88(1047):20140491.
[3]MCCULLOUGH PA,SANDBERG KR.Epidemiology of contrast-induced nephropathy[J].Rev Cardiovasc Med,2003,4(Suppl 5):S3-S9.
[4]中華医学会放射学分会质量控制与安全管理专业委员会.肾病患者静脉注射碘对比剂应用专家共识[J].中华放射学杂志,2021,55(6):580-590.
[5]王玉萍,沈世林,苏东君,等.对比剂肾病研究进展[J].介入放射学杂志,2017,26(6):572-575.
[6]Faucon AL,Bobrie G,ClémentO.Nephrotoxicity of iodinated contrast media: From pathophysiology to prevention strategies[J].Eur J Radiol,2019,116:231-241.
[7]Schick CS,Haller C.Comparative cytotoxicity of ionic and non-ionic radiocontrast agents on MDCK cell monolayers in vitro[J].Nephrol Dial Transplant,1999,14(2):342-347.
[8]廖奕娇,易铁钢.造影剂肾病的分子作用机制及中医药治疗研究进展[J].广州中医药大学学报,2021,38(4):859-864.
[9]Wong PC, Li Z, Guo J,et al.Pathophysiology of contrast- induced nephropathy[J].Int J Cardiol,2012,158(2):186-192.
[10]Luo S,Zhang LJ,Meinel FG, et al.Low tube voltage and low contrast material volume cerebral CT angiography[J].EurRadiol,2014,24(7):1677-1685.
[11]黄俊豪.等渗造影剂碘克沙醇和低渗造影剂碘海醇对直接行 PCI 术老年患者的效果对比[J].中国现代药物应用,2021,15(3):33-35.
[12]李飞.低管电压低剂量低浓度造影剂在增强 CT 检查中预防造影剂肾病的临床研究[J].中国 CT 和 MRI 杂志,2021,19(3):92-94.
[13]杜梦阳,姜琳,宋莹,等.经皮冠状动脉介入治疗后两种对比剂诱发的急性肾损伤诊断标准的应用比较[J].中国循环杂志,2021,36(2):126-130.
[14]王征宇,彭志清,相建峰,等.血管介入诊疗中对比剂使用后急性肾损伤的发生及预测[J].中华医学杂志,2021,101(19):1421-1426.
[15]王子龙,孙百义,裴慧,等.对比剂肾病风险预测的研究进展[J].中华卫生应急电子杂志,2020,6(2):118-120.
[16]Stacul F,Adam A, Becker CR, et al.Strategiestoreducethe risk ofcontrast-inducednephropathy[J].Am J Cardiol,2006,98(6A):59-77.
[17]周玉杰.造影剂肾病的中国专家共识(草案).http// www.365heart.com/comment/html/19077.html.
[18]Van der Molen AJ,Reimer P,Dekkers IA,et al.Post- contrast acute kidney injury-Part 1: Definition, clinical features, incidence, role of contrast medium and risk factors: Recommendations for updated ESUR Contrast Medium Safety Committee guidelines[J].EurRadiol,2018,28(7):2845-2855.
[19]Bottinor W,Chawla R,Danyi P,et al.Intravenous fluid therapy is associated wih a reduced incidence of contrast-induced nephropathy but not with a reduded long-term incidence of renal dysfunction after- cardiac catheterization[J].CardiovaseRevasc Med,2020,21(1):20-23.
[20]周鵬,王秋林,蔡国才,等.不同温度对比剂在冠状动脉造影术中不良反应的对比观察[J].介入放射学杂志,2011,20(10):769-771.
[21]王中,李东宝,赵慧强.血管内超声指导的冠状动脉介入治疗对减少肾功能不全患者对比剂肾病的进展[J].心血管病学进展,2019,40(1):23-26.
[22]Sacha J,Gierlotka M,Feusette P,et al.Ultra- low contrast cornary angiography and zero-contrast percutaneous coronary intervention for prevention of contrast-induced nerphropathy: Step-by-step approach and review[J].PostepyKardiol,Interwencyjnej,2019,15(2):127-136.
[23]朱斐斐,马红岗,汪荣华,等.短期高强度阿托伐他汀预防急性脑梗死合并糖尿病患者介入诊疗后对比剂肾病的有效性[J].中国临床药学杂志,2018,25(6):397-400.
[24]殷莹,胡菊萍.阿托伐他汀类药物预防冠状动脉造影/经皮冠状动脉介入治疗对比剂肾病:荟萃分析[J].中西医结合心血管病电子杂志,2019,6(28):9-11.
[25]张鹏,杨世诚,付乃宽.普罗布考对经皮冠状动脉介入治疗术后造影剂肾病的预防[J].临床心血管病杂志,2015,31(11):1163-1166.
[26]Amini M,Salarifar M,Amirbaigloo A, et al.N- acetylcysteine does not prevent contrast-induced nephropathy after cardiac catheterization in patients with diabetes mellitus and chronic kidney disease: a rangomized clinical trial[J].Trials,2009,10:45.
[27]冠心病介入诊疗对比剂应用专家共识组.冠心病介入诊疗对比剂应用专家共识[J].中国心血管病研究,2010,12(8):881-889.
(收稿日期:2021-08-03)

