蒙药古日古木-13对小鼠视网膜光损伤的保护作用
张天资 王彦夫 晓琴 谢飞 李冉 詹艳 韩立坤
(内蒙古民族大学附属医院 1眼科,内蒙古 通辽 028000;2内分泌科)
视网膜光损伤是指光照强度过大或光照时间过长对视网膜造成的损害。研究表明视网膜细胞损伤的3条途径为过氧化物介导,视紫红质介导和细胞凋亡〔1,2〕。光损伤可导致视网膜神经上皮层和色素上皮层损伤〔3〕,且与凋亡相关的基因和蛋白表达相关。因此,抑制视网膜细胞凋亡是预防和治疗视网膜光损伤疾病的重要途径。蒙药古日古木-13治疗青光眼等视神经损伤类疾病的疗效确切〔4〕。研究发现蒙药日古木-13能对视神经损伤起到保护作用〔5〕。本实验以蒙药古日古木-13对视神经损伤的保护和治疗作用为出发点,观察光损伤小鼠视网膜的功能和组织结构的变化及含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3、caspase-8、caspase-9、B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)表达情况,评估蒙药古日古木-13对视网膜光损伤的保护作用及抑制视网膜细胞凋亡的影响。
1 材料与方法
1.1实验动物 采用吉林大学医学院实验动物中心提供的鼠龄7~8 w SPF级雄性C-57小鼠40只,体重18~22 g。饲养条件:按照昼夜节律,光照12 h(80 lux,6∶00~18∶00),避光12 h,温度:18~25℃,相对湿度:40%~65%,未限制摄食饮水。入组前所有小鼠经常规检查双眼前节及眼底,以排除屈光介质混浊和眼底异常。
1.2药物与试剂 RIPA裂解液、蛋白分子量标准、Marker、多聚甲醛、75%甲醛、生理盐水和戊巴比妥钠盐均购自Beyotime生物科技;羊抗鼠、β-actin抗体、Bcl-2抗体、Bax抗体、caspase-3 抗体、caspase-8 抗体和caspase-9抗体均购自ABCOM-Technology forerunner;阿托品眼用凝胶购自沈阳兴齐制药;左氧氟沙星眼用凝胶购自湖北东胜制药,蒙药古日古木-13由内蒙古民族大学附属医院提供。
1.3主要仪器 眼电生理检测仪购自法国迈威;眼科手术器械及显微手术器械均购自新华医疗器械;超净工作台购自日本Airtech,光学显微镜、倒置相差显微镜、体式显微镜和荧光导致显微镜IX70均购自日本Olympus;Thermo酶标仪全自动高压灭菌器、平衡离心机、低速离心机和微量移液器均购自美国Thermo Fisher;纯水机POSEIDON-R150购自锐思捷科学仪器;-80℃超低温冰箱购自日本SANYO;酶标仪550型购自美国Bio-Rad。
1.4动物分组、模型建立及给药 将小鼠随机分成5组:正常组(8只),对照组(8只)和治疗组(24只)。其中,治疗组随机分为3组:治疗高剂量组(8只)、治疗中剂量组(8只)、治疗低剂量组(8只)。将对照组及治疗组进行24 h暗适应后置入光损伤实验箱中进行光照(9 000 lux冷光源,温度:22~25℃;湿度:40%~65%;自由饮食饮水)12 h。照射结束后所有小鼠送返至暗环境12 h。模型建立后开始给药,治疗高剂量组: 1.6 g/(kg·d)剂量的古日古木-13 溶于0.7 ml生理盐水灌胃。治疗中剂量组: 0.8 g/(kg·d)剂量的古日古木-13 溶于0.7 ml生理盐水灌胃。治疗低剂量组: 0.4 g/(kg·d)剂量的古日古木-13 溶于0.7 ml生理盐水灌胃。对照组:0.7 ml生理盐水灌胃。连续灌胃给药7 d。灌胃剂量参考《蒙药学百科全书》《蒙医药实验学》《实验动物学》
1.5ERG检测 实验各组小鼠在暗黑房间中整夜进行暗适应;将小鼠称重,按比例在小鼠腹腔内注射适量麻醉剂,使其进入深度麻醉状态;麻醉完成后,在暗红光照明下,胶带固定小鼠趴在动物试验平台前方,滴涂阿托品散瞳凝胶。电极安装:连接正电极使环形电极分别接触左右眼角膜顶端,使其接触角膜中心,一通道正极接右眼,二通道正极接左眼;双头针电极轻轻插入小鼠下颚,接通两个通道的负接口,同侧正负极方向一致;针电极插入小鼠尾巴,接通地电极。将小鼠及动物试验平台推入闪光刺激球内。于电生理计算机录入小鼠编号,进入ERG-0.01程序,示波信号确认无误后关闭暗红光,可依次进行0.01ERG及3.0ERG检测(3.0ERG检测前进行暗适应15~20 min)。
1.6视网膜组织形态学检查 切片,1%戊巴比妥钠盐溶液麻醉5组小鼠,显微镜下摘除眼球,留取足够长的视神经,于12点位及3点位进行结膜缝线标记,用生理盐水冲洗干净,置于多聚甲醛中保存,标记各组名称。将小鼠眼球置于包埋盒中,垂直悬吊12点位缝线,使眼球标本置于水平方位,OCT包埋剂包埋冷冻后,放置于冰冻切片机。切片机温度:-30℃,切片厚度:4~7 μm,沿视神经的上方和下方,从眼球后壁向角膜方向分别进行切片。苏木素-伊红(HE)染色,37℃烘片30 min;苏木素染色10~15 min,蒸馏水冲洗,70%乙醇冲洗20~30 s;伊红染色10~15 min,蒸馏水冲洗。透明、固定、封片。光学显微镜下观察并记录视网膜组织结构变化。
1.7Western印迹检测正常组、治疗组和对照组的凋亡蛋白caspase-3、caspase-8、caspase-9表达量。
1.7.1视网膜组织蛋白的提取 分离视网膜组织,用液氮研磨组织至粉末状;将视网膜组织粉末倒入EP管,将细胞裂解液和蛋白酶抑制剂(比例9∶1)置于漩涡混匀器震荡混匀60 s;冰箱裂解(4℃)30 min,离心机离心(12 000 r/min,4℃,10 min),取上层血清置于4 ml EP管中;加入二喹啉甲酸(BCA)后进行蛋白总浓度测定。
1.7.2检测 取干净清洁玻璃板,将玻璃短板与带隔条玻璃板相对放置装入板夹中,前后推动,底部对齐后扣上开关,待灌入分离胶;制备10%聚丙烯酰胺凝胶电泳(PAGE)分离胶:双蒸水3.3 ml,30%丙烯酰胺(29∶1)4.0 ml,1.5 mol/L Tris-HCl(pH8.8)2.5 ml,10%十二烷基硫酸钠(SDS)0.1 ml,10%过硫酸铵0.1 ml,TEMED 4 μl;将分离胶从玻璃板左上角灌入,加至玻璃板的2/3高度后再缓慢地加入双蒸水,水液封胶面,待其凝固后可见水与分离胶之间有一折射线,即可用滤纸吸干上层水液,加入浓缩胶;配制5%浓缩胶:双蒸水2.7 ml,30%丙烯酰胺(29∶1)670 μl,Tris-HCl(pH6.8)500 μl,10% SDS 40 μl,10%过硫酸铵40 μl,TEMED 4 μl;灌入浓缩胶,在玻璃板间插入Teflon梳子,室温放置10 min,待梳子之间的浓缩胶回缩,即可将玻璃板装入电泳槽内。电泳:将配好的胶放入电泳槽内,加入电泳液(Tris 15.1 g,Glycine 94 g,SDS 5 g,蒸馏水1 000 ml)后,竖直向上拔除梳子,加入Marker,再将制好的蛋白样品加入加样槽内,设定电压80 V进行电泳,待Marker条带渐进分开且蛋白样品超过浓缩胶后,将电压改为120 V进行电泳,当蛋白样品距离电泳槽底 2 cm时终止电泳。转膜:撬开玻璃板,刮去浓缩胶,切开分离胶,将凝胶反折180°置于转膜液(蒸馏水1 L,Glycine 2.9 g,Tris 5.8 g,SDS 0.37 g)中,取所需大小的聚偏氟乙烯(PVDF)膜没入转膜缓冲液中,将滤纸、PVDF膜、凝胶和滤纸按顺序依次放置在半干转膜仪装置上,倒入少许转膜液后盖好外盖,连接电源设定电压或电流,进行转膜。封闭:转膜完成后将PVDF膜放入5%脱脂牛奶TBST溶液(NaCl 8.8 g,Tris-HCl 8.0 20 ml,Tween-20 0.5 ml,蒸馏水1 000 ml)摇床封闭1.5~2.0 h。一抗孵育: 倒掉5%脱脂牛奶TBST溶液,抗体按照比例用抗体稀释液稀释,将PVDF膜放入含有稀释好的一抗的密封袋中,置于4℃冰箱中过夜。洗膜:将PVDF膜放置摇床用TBST溶液漂洗3次,每次5~10 min。结合二抗:根据一抗来源选择适合的二抗,抗体按照比例用抗体稀释液稀释,将PVDF膜放入密封袋中,加入稀释好的二抗后置于37℃水平摇床上匀速摇动1.0~1.5 h。洗膜:结合二抗孵育后,将膜置于TBST溶液中洗涤3次,每次5~10 min。显影:PVDF膜放于显影仪器中,发光显影液均匀滴涂在膜上,选择程序曝光并显影,可以清晰地显示蛋白条带。蛋白密度统计:应用Image J系统对各组细胞蛋白条带灰度值进行分析,对其光密度强度进行扫描,测量各个条带蛋白密度值,并使用Prism统计分析各组蛋白含量。
1.8统计学方法 采用SPSS17.0软件进行t检验、χ2检验、方差分析。
2 结 果
2.1各组ERG比较 正常组ERG振幅〔(953.27±15.80)μV〕明显高于对照组〔(385.48±12.04)μV,P<0.05〕。治疗低、中、高剂量组ERG振幅〔(575.13±8.66)、(708.60±18.32)、(688.47±8.70)μV〕均明显高于对照组,且均明显低于正常组(均P<0.05)。治疗中、高剂量组ERG振幅数值显著高于治疗低剂量组(P<0.05),治疗中剂量组和治疗高剂量组无显著差异(P>0.05)。见图1。
2.2各组视网膜HE染色及外核层细胞比较 正常组视网膜细胞形态良好,排列整齐,结构层次清晰,外核层细胞排列紧密,大小均匀;对照组视网膜细胞形态排列紊乱,组织结构界限模糊不清,外核层细胞排列疏松,大小不一,可见空泡化及细胞水肿。治疗低剂量组及治疗高剂量组视网膜细胞排列不整齐,纤维间质部分水肿,偶见空泡;治疗中剂量组细胞形态大致正常。见图2。

a波-视锥细胞反应(3.0闪光刺激),b波-视杆细胞反应(0.01闪光的刺激)图1 各组小鼠ERG检测结果

图2 各组视网膜组织结构(HE,×40)
2.3各组视网膜外核层厚度比较 对照组视网膜外核层厚度〔(24.37±3.41)μm〕明显低于正常组〔(31.2±1.43)μm,P<0.05〕。治疗低、中、高剂量组视网膜外核层厚度〔(25.12±2.46)μm,(29.28±2.32)μm,(26.34±1.70)μm〕均明显高于对照组且明显低于正常组(均P<0.05)。治疗中剂量组视网膜外核层厚度显著高于治疗低、高剂量组(P<0.05),治疗低剂量组与治疗高剂量组无显著差异(P>0.05)。
2.4各组caspase-3、caspase-8、caspase-9、Bax、Bcl-2比较 与正常组相比,对照组凋亡蛋白caspase-3、caspase-8、caspase-9、Bax表达量显著高于正常组,而抗凋亡蛋白Bcl-2表达量显著低于正常组(均P<0.05);与对照组相比,治疗低、中、高剂量组,凋亡蛋白caspase-3、caspase-8、caspase-9、Bax表达量均显著低于对照组,而抗凋亡蛋白Bcl-2表达量显著高于对照组(P<0.05)。治疗高剂量组凋亡蛋白caspase-3表达量显著低于治疗低、中剂量组(P<0.05);治疗各剂量组凋亡蛋白caspase-8表达量比较:治疗低剂量组>治疗高剂量组>治疗中剂量组(均P<0.05);治疗中剂量组caspase-9、Bax表达量均显著低于治疗低、高剂量组(P<0.05),而治疗中剂量组抗凋亡蛋白Bcl-2表达量显著高于治疗低、高剂量组(P<0.05)。见表1、图3。
表1 Western 印迹检测视网膜凋亡及相关蛋白水平
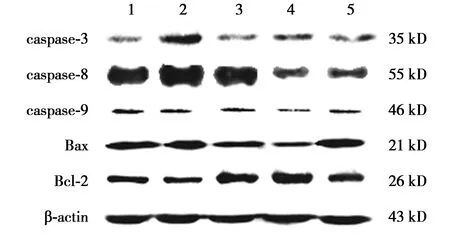
1~5:正常组,对照组,治疗低剂量组,治疗中剂量组,治疗高剂量组图3 Western印迹检测各组视网膜凋亡及相关蛋白水平
3 讨 论
视网膜是人体产生视觉的重要器官,极易受到内、外致病因素的影响。过度的异常光刺激视网膜,会引起视网膜细胞死亡,经光诱导细胞凋亡,形成视网膜光损伤。视网膜光损伤主要包括光的热损伤、机械损伤和化学损伤。光的化学损伤被认为在视网膜光损伤中有重要作用〔3〕。与年龄相关性黄斑变性、视网膜色素变性等疾病密切相关。视网膜细胞,特别是感光细胞的凋亡是最重要的发病机制〔6〕。
研究发现古日古木-13能通过转化生长因子(TGF)-β信号通路影响RGC-5的增殖和凋亡〔5,6〕;古日古木-13可通过抑制慢性高眼压青光眼模型大鼠视网膜神经节细胞的氧化应激反应和凋亡信号通路激活机制,保护视神经功能。
视网膜电图主要用于检查视网膜功能状态。根据调节不同的刺激条件和接受方式,可对视网膜各层疾病客观地提供诊断依据,是一种无痛、无创的诊断方法。ERG的a 波起源感光细胞,因此 a 波振幅减小表示感光细胞功能受到损害。b 波起源于视网膜内核层细胞,b 波下降表示视网膜内信号传导完整性受损〔7〕。
感光细胞和视网膜色素上皮(RPE)细胞凋亡是视网膜光损伤的主要机制。导致细胞凋亡的因素包括光照的性质、强度,细胞的氧化反应,视紫红质的水平,细胞基因的调控等〔8〕。而光损伤部位主要在光感受器和外核层。外核层主要由视锥细胞和视杆细胞组成,其内含长链不饱和脂肪酸,最易受脂质过氧化反应的影响。当光子被视紫红质吸收时,可激发电离,产生自由基,导致脂类过氧化,造成细胞膜的溶解、消失和视细胞的凋亡〔9〕。因此,测量视网膜外核层厚度常作为检测视网膜细胞凋亡的指标,可以比较直观地反映视细胞的损伤程度。
前期研究证实caspase-3、caspase-8、caspase-9在视网膜细胞凋亡中是重要的中心环节和执行者,可接受多种信号刺激,激活下游底物种类繁多,诱导凋亡〔10,11〕。Bax、Bcl-2 基因是目前最重要的凋亡调控基因〔12〕,在凋亡信号转导过程中发挥重要作用。其中 Bax 蛋白促进凋亡,Bcl-2 蛋白抑制凋亡。Bax、Bcl-2通过介导细胞色素C 等物质的释放,阻止下游caspase 的活化,导致细胞凋亡,发挥上游调控作用。caspase-3 还可裂解 Bcl-2 蛋白,产生类 Bax 促凋亡活性片段来激活caspase-3,进而促进细胞凋亡。维持两种蛋白的表达平衡是抑制细胞凋亡的关键〔13~15〕。

