基于网络药理学、分子对接、体外细胞实验预测珠子参保肝机制
张海潮, 周 瑞, 唐志书, 苏 洁, 刘妍如, 潘亚磊, 刘红波, 宋忠兴
[陕西中医药大学/陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西省创新药物研究中心,陕西 咸阳 712083]
珠子参为五加科植物珠子参PanaxjaponicusC. A. Mey. var.Major(Burk.)C. Y. Wu et K. M. Feng 或羽叶三七PanaxjaponicusC. A. Mey. var.Bipinnatifidus(Seem)C. Y. Wu et K. M. Feng的干燥根茎,是秦巴特色中草药资源“太白七药”之一[1],据《中国药典》记载,珠子参归肝经、胃经、肺经,早在《本草纲目拾遗》就记载其具有止血、活络、养阴等功效[2],其熟品常用于气血双亏。研究报道,珠子参中主要成分为珠子参总皂苷,其具有保肝、抗炎镇痛、抗氧化损伤和诱导人肝癌细胞SMMC-7721凋亡等药理作用[3-4]。
肝脏是维持人体新陈代谢稳定的重要器官,具有抵抗病原菌感染,产生多种凝血因子,维持血液循环以及排毒解毒等生理功能[5]。药源性损伤,辐射、环境污染等外部损伤,酗酒、饮食不规律等生活中的不良生活习惯以及糖尿病等疾病并发症均会导致肝脏损伤。肝疾病进行到终末期肝硬化等症状时,常会使肝实质细胞发生病变,结果导致肝再生能力降低,功能减弱,最终发展到肝功能衰竭。肝损伤是各种类型肝病的病理基础,因此抑制以及治疗肝损伤是防止肝病进一步发展的重要措施之一[6]。
中药是多组分的天然药物,其机制复杂,各种组学技术、高内涵技术等为分析中药作用机制提供了技术支撑[7]。有研究表明珠子参总皂苷对CCl4导致大鼠肝纤维化具有保护作用[8],但珠子参保肝的作用机制尚不清楚。近几年,网络药理学研究发展迅速,它是基于现代药理学研究药物开发设计的新方法和新策略[9],可通过构建生物分子“疾病-药物-靶点-通路”网络来对机体复杂生物系统进行分析,预测药物的作用机理,发现和优化先导化合物以及药物临床前安全性有效性评估[10]。因此,本研究采用网络药理学的研究技术构建“成分-靶点-通路”网络,探讨珠子参保肝的活性成分及作用机制,并通过分子对接和细胞实验进一步验证珠子参的保肝作用。
1 方法
1.1 珠子参活性化合物及相应靶点的获取 借助ETCM(http://www.tcmip.cn/ETCM/index.php/Home/Index/index.htm)数据库以及现有文献,以“珠子参”为关键词检索,获得其化学成分,利用中医药百科全书数据库ETCM、SwissTargetPrediction(http://www.swisstargetpred iction.ch/)、中医药证候关联数据库SymMap(https://www.symmap.org/)数据库获得候选化合物的相应靶点,并在Uniprot数据库(https://www.uniprot.org/)对靶点校正。
1.2 疾病潜在靶点的获取 在人类疾病数据库(Melacards)(https://www.genecards.org/)中,以“肝炎(hepatitis)、乙肝(hepatitis B)、酒精性及非酒精性肝炎(alcoholic /non-alcoholic hepatitis)、病毒性肝炎(viral hepatitis)、脂肪肝(fatty liver disease)、肝硬化(liver cirrhosis)以及急性肝衰竭(acute liver failure)”等为关键词检索其相关靶点,删除重复靶点后,通过Venny 2.1.0(http://bioinfogp.cnb.csic.es/tools/venny/index.html)在线作图,收集珠子参保肝的潜在靶点。
1.3 蛋白互作网络的构建 将筛选后的潜在靶点导入到蛋白互作分析平台STRING 11.0(https://string-db.org/),选择种属为“人类(Homosapiens)”,获取蛋白互作关系的PPI网络,PPI网络中线的粗细表示互相作用的强弱,靶点的度值表示节点的连接情况,度值越大,代表此节点在蛋白互作网络中越重要。
1.4 “活性化合物-疾病-靶点”网络的构建 利用Cytoscape3.7.2构建“活性化合物-疾病-靶点”可视化网络。借助“网络分析(network analyzer)”功能,获得参与互作蛋白的度值(Degree)和介数(Betweenness),筛选出珠子参中潜在的具有保肝作用的活性化合物和相应的疾病靶点。
1.5 GO和KEGG功能富集分析 将筛选后的靶点导入蛋白质互作分析平台STRING 11.0,设定物种为“Homosapiens”,经上述数据库检索和转化操作,对生物学过程(biological Process,BP)、分子功能(molecular function,MF)及细胞组成(cellular component,CC)进行GO(gene ontology)富集分析,通过京都基因与基因组百科全书(KEGG)对代谢通路进行富集分析,并应用微生信(http://www.bioinformatics.com.cn/)在线作图,将结果分别绘制成柱状图和气泡图。
1.6 “活性化合物-靶点-通路”网络的构建 通过文献挖掘,对KEGG通路进行分析,并利用Cytoscape3.7.2软件构建“活性化合物-靶点-通路”网络,获得珠子参保肝的相关通路、靶点以及有效成分。
1.7 分子对接 应用UCSF Chimera软件将上述网络中度值靠前的5个靶点分别与5个度值靠前的活性化合物进行分子对接验证。在PDB数据库(http://www.rcsb.org/)中分别下载5个靶点的蛋白结构,并导入到UCSF Chimera软件进行蛋白预处理成mol2格式。在SciFinder-Explore数据库(https://scifinder.cas.org/scifinder/view/scifinder/scifinderExplore.jsf)中下载保存活性化合物mol格式,利用ChemBioDraw Ultra 14.0软件将其转化成cdx格式,再使用Chem3D 19.0软件进行能量最小化处理并保存mol2格式。将处理成mol2格式的靶点和分子在UCSF Chimera软件中进行分子对接,得到结合能(affinity)。
1.8 珠子参总苷对L02细胞炎症损伤模型的影响
1.8.1 MTT法检测珠子参总苷对细胞炎症损伤模型的保护作用 将L02细胞以1.5×105个/mL密度接种于96孔板中,培养24 h后,吸出培养基,给药,将细胞分为空白组(基础培养基)、脂多糖(LPS)(1 μg/mL)组、(LPS)(1 μg/mL)+珠子参(50、100 μg/mL)组,放入培养箱培养2 h后加入10 μL LPS,24 h后进行MTT检测。
1.8.2 酶联免疫法(ELISA)检测细胞上清中IL-6、NO水平 按“1.8.1”项下方法培养细胞,24 h后收集细胞上清,根据IL-6 ELISA试剂盒(批号H201211-007b,欣博盛生物科技有限公司)、Griess试剂盒(批号DC15BA0731,BBI Life Science Corporation)说明书操作,分别检测L02各组细胞上清中白介素6(IL-6)和一氧化氮(NO)的水平。
1.8.3 DAPI染色观察L02细胞形态 将L02细胞以1.5×106个/mL的密度接种于6孔板中,培养24 h后给药,2 h后取出在LPS组和LPS+珠子参组加入1 μg/mL LPS。经过24 h的培养,用 DAPI染色剂染色,分别在明场和荧光成像模式下,对细胞形态进行拍照。
2 结果
2.1 珠子参活性化合物的筛选 通过ETCM数据库以及文献检索整理得到珠子参的候选活性化合物有43个,同时将其编号,并在ETCM、SwissTargetPrediction、SyMmap中获得靶点247个。珠子参中活性化合物的基本信息见表1。

表1 珠子参中活性成分
2.2 疾病潜在靶点分析 通过Melacards数据库检索与保肝相关的靶点,获得了309个。再将珠子参候选活性化合物的靶点和保肝相关靶点通过Venny 2.1.0取交集,得到共同靶点27个(图1),对应成分37个。

图1 珠子参成分和疾病的共有靶点Fig.1 Common targets of Panacis majoris Rhizoma components and diseases
2.3 珠子参成分靶点与疾病靶点蛋白互作网络的构建 通过查找资料,得到珠子参保肝的18个相关靶点,分别为AKT1、ALB、CASP3、CD81、F2、F3、IL1B、IL2、IL6、IKBKB、JAK1、JUN、NFKBIA、NR1H4、PRKAB1、STAT3、TNF、TP53,将上述靶点导入STRING 11.0 数据库中,构建PPI网络(图2)。其中,节点代表靶点,有94条边相互连接,图中越接近中心的节点即连接靶点较多的节点,在整个网络中起到重要作用,可能是蛋白互作网络中的核心靶点。

图2 PPI网络Fig.2 PPI network
2.4 “活性化合物-疾病-靶点”网络的构建 将筛选到的18个靶点与对应的35个活性化合物进行映射并生成关联表,将数据导入Cytoscape3.7.2软件中构建“活性化合物-疾病-靶点”可视化网络(图3)。其中,节点大小代表度值(Degree)大小,度值越大,该节点在网络中越重要,参与药理作用越明显。
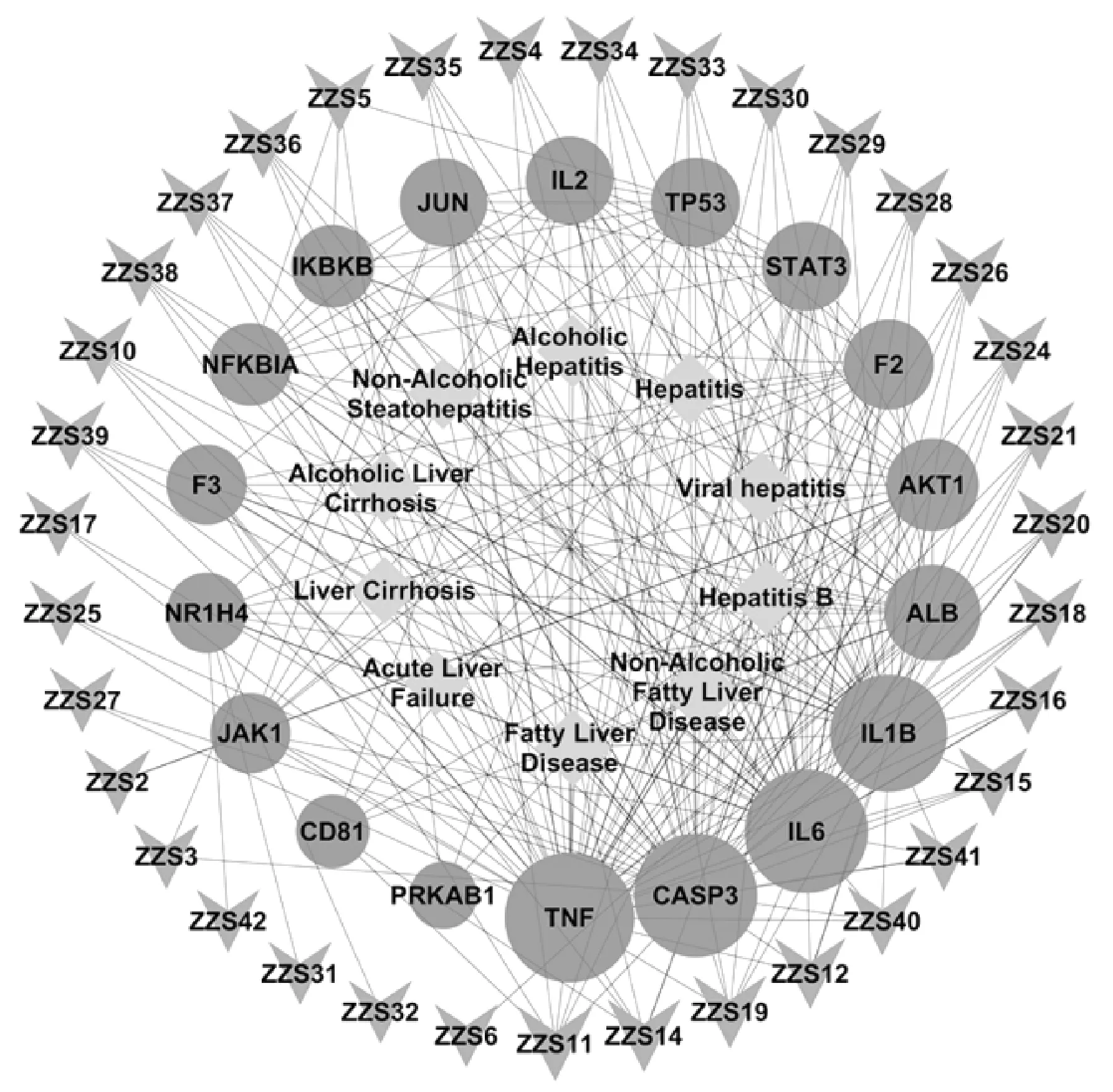
注:绿色菱形节点代表疾病,蓝色圆形节点代表靶点,橘红色倒三角节点代表活性化合物。图3 “活性化合物-疾病-靶点”网络Fig.3 Active Compound-disease-targets network
结果,竹节参皂苷Ⅳa(Chikusetsusaponin Ⅳa,ZZS11)、人参皂苷Ro(Ginsenoside Ro,ZZS14)、人参皂苷Re(Ginsenoside Re,ZZS19)、人参皂苷Rb2(Ginsenoside Rb2,ZZS12)、人参皂苷Rd2(Ginsenoside Rd2,ZZS40)度值比较大,分别为7、6、6、5、4,说明这些活性成分可能在珠子参发挥保肝作用的过程中起重要作用;排名靠前的靶点还有肿瘤坏死因子(TNF,Uniprot ID P01375)、白细胞介素6(IL6,Uniprot ID P05231)、半胱天冬酶3(CASP3,Uniprot ID P42574)、白细胞介素1B(IL1B,Uniprot ID P01584)、白蛋白(ALB,Uniprot ID P02768),分别为50、45、45、40、23,说明珠子参活性成分可能通过抗炎、调节免疫和凋亡等作用来参与保肝,并具有多成分、多靶点的特点。
2.5 GO和KEGG通路富集分析 将上述18个基因导入STRING数据库,经检索和转化操作,进行GO和KEGG富集分析,共得到GO条目616条(P<0.05),包括生物学过程(BP)550条,分子功能(MF)47条,细胞组成(CC)19条,绘制各类别前10的条目(图4),表明蛋白大部分在细胞外空间(GO 0005615,extracellular space)、细胞外泌体(GO 0070062,extracellular exosome)以及核染色质(GO 0000790,nuclear chromatin)等位置;进行细胞因子受体结合(GO 0005126,cytokine receptor binding)、蛋白质结合(GO 0005515,protein binding)以及信号受体结合(GO 0005102,signaling receptor binding)等分子功能;并参与细胞表面受体信号通路(GO 000716,cell surface receptor signaling pathway)、凋亡过程的负调控(GO 0043066,negative regulation of apoptotic process)以及调节免疫系统过程(GO 0002682,regulation of immune system process)等生物学过程。
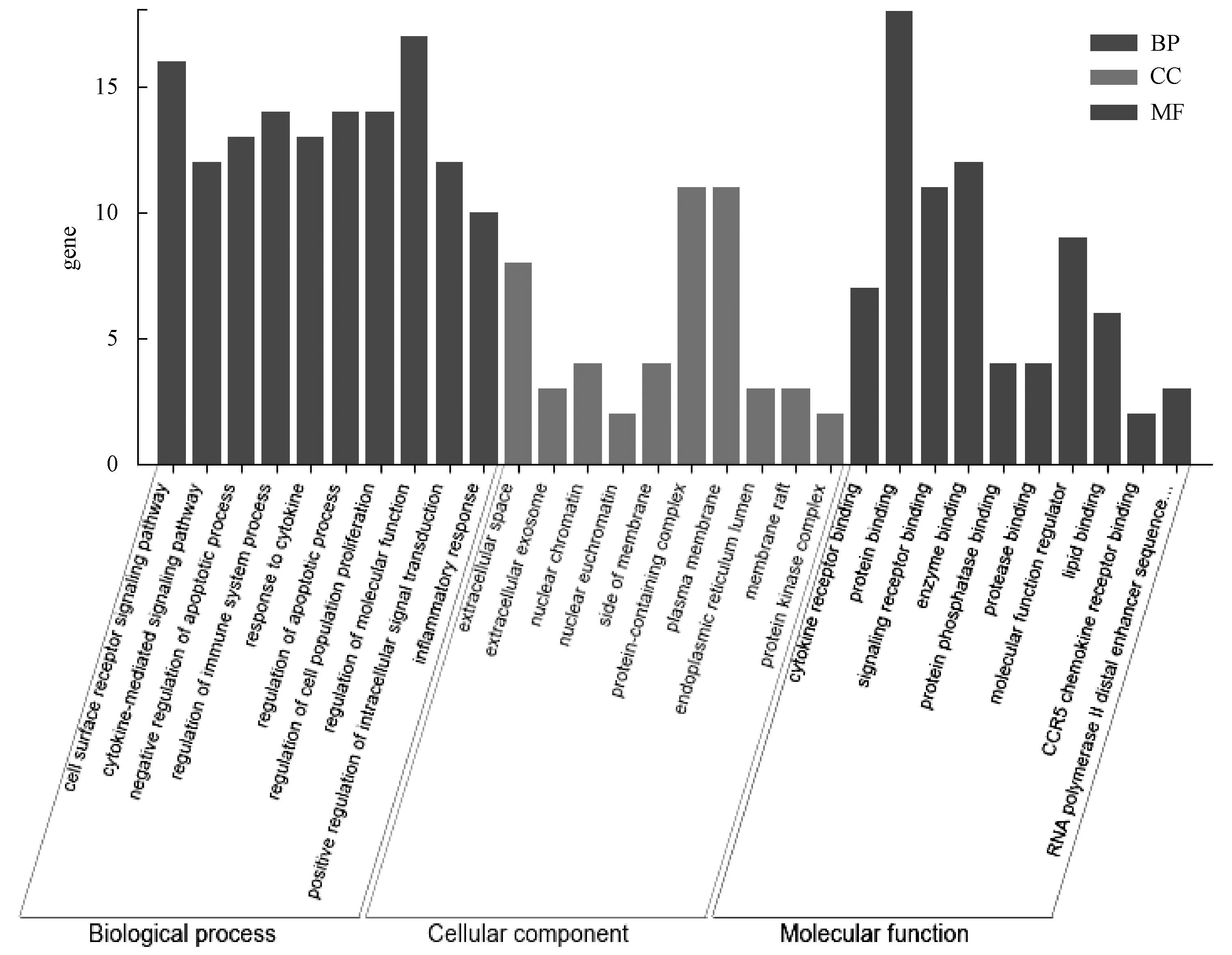
图4 珠子参保肝靶点的GO富集分析Fig.4 Gene ontology enrichment analysis of the hepatoprotective targets of Panacis majoris Rhizoma
富集共得到KEGG信号通路122条可能与珠子参保肝作用机制有关(前20 条通路气泡图见图5),其中与肝疾病相关通路3条,分别是乙型肝炎(hsa05161,hepatitis B)、丙型肝炎(hsa05160,hepatitis C)及非酒精性脂肪性肝病(hsa04932,NAFLD,non-alcoholic fatty liver disease);与炎症相关通路5条,分别是Th17细胞分化(hsa04659,Th17 cell differentiation)、TNF 信号通路(hsa04668,TNF signaling pathway)、糖尿病并发症中的AGE-RAGE信号通路(hsa04933,AGE-RAGE signaling pathway in diabetic complications)、IL17 信号通路(hsa04657,IL17 signaling pathway)及Toll样受体信号通路(hsa04620,Toll-like receptor signaling pathway);与凋亡相关通路有1条为凋亡通路(hsa04210,Apoptosis);与癌症相关通路有1条为癌症通路(hsa05200,pathways in cancer),说明这些通路可能与珠子参的保肝作用有很大关系。
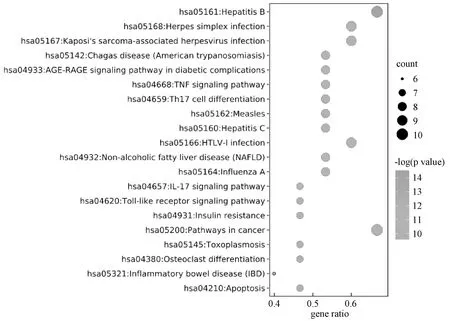
图5 珠子参保肝靶点的KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis of the hepatoprotective targets of Panacis majoris Rhizoma
2.6 “活性化合物-靶点-通路”网络的构建 将上述通路及其基因整理得到15个基因以及对应活性成分31个,利用Cytoscape3.7.2构建“活性化合物-靶点-通路”网络(图6),得到珠子参保肝的主要活性成分有竹节参皂苷Ⅳa、人参皂苷Re、人参皂苷Ro、越南皂苷R4(Vina-ginsenosides R4,ZZS35)、三七皂苷R1(notoginsenoside R1,ZZS36)等,核心靶点主要包括TNF、CASP3、IL6、IL1B、原癌基因蛋白(JUN,Uniprot ID:P05412)等,通过乙型肝炎通路、Th17细胞分化通路、TNF 信号通路、AGE-RAGE信号通路、非酒精性脂肪性肝病通路、IL17 信号通路等来发挥作用。

注:绿色圆形节点代表靶点,紫色菱形节点代表通路,蓝色三角形节点代表活性化合物。图6 “活性化合物-靶点-通路”网络Fig.6 Active Compound-targets-pathways network
2.7 分子对接 将“2.6”项下度值前5个重要靶点蛋白TNF(PDB ID 2AZ5)、CASP3(PDB ID 5KFA)、IL6(PDB ID 1ALU)、IL1B(PDB ID 3LTQ)、JUN(PDB ID 2P33),以及排名靠前的5个活性化合物竹节参皂苷Ⅳa、人参皂苷Re、人参皂苷Ro、越南皂苷R4、三七皂苷R1进行分子对接验证。由表2可知,珠子参中重要化合物、靶点的结合能均<-5.0 kcal/mol,即结合性较好,主要为皂苷类化合物。由图7可知,这些化合物主要与蛋白受体结合位点发生氢键作用。

表2 珠子参重要成分、靶点分子对接结果
2.8 珠子参总苷对L02细胞炎症损伤模型的保护作用 由表3可见,珠子参总苷对LPS损伤的L02细胞有一定的保护作用,LPS组细胞活性较空白组下降;而LPS+珠子参组较LPS组细胞活性升高,损伤细胞恢复了25%~29%,并且对细胞没有明显损伤。由表4可见,与空白组比较,LPS组IL-6、NO水平升高(P<0.01);与模型组比较,LPS+珠子参100 μg/mL组两者水平降低(P<0.01)。如图8所示,空白组、LPS+珠子参50 μg/mL组、LPS+珠子参100 μg/mL组中细胞核几乎没有弥散现象及细胞表面损伤现象,但在LPS组中细胞数目少,细胞核有弥散现象。

注:粉色球棍模型为候选化合物分子,红色为氧原子,蓝色为氮原子。图7 珠子参重要化合物与关键靶点相互作用图Fig.7 Interaction diagrams of core Panacis majoris Rhizoma compounds and key targets
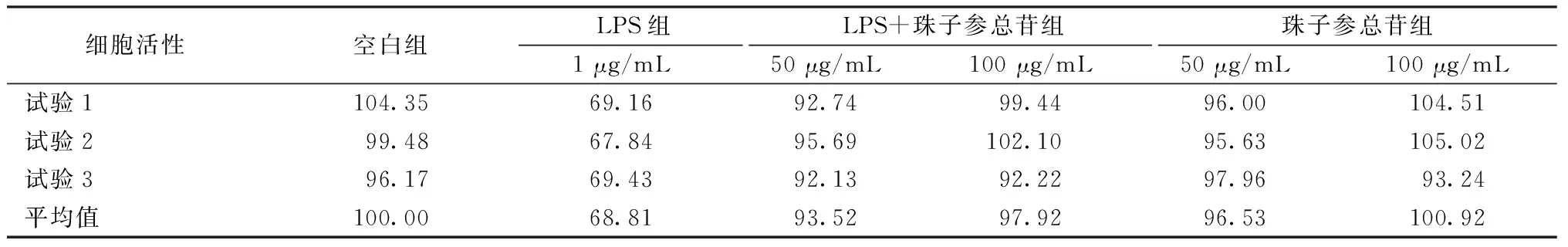
表3 珠子参总苷对LPS损伤L02细胞的保护作用(%,n=3)

表4 珠子参总苷对L02细胞中IL-6、NO水平的影响
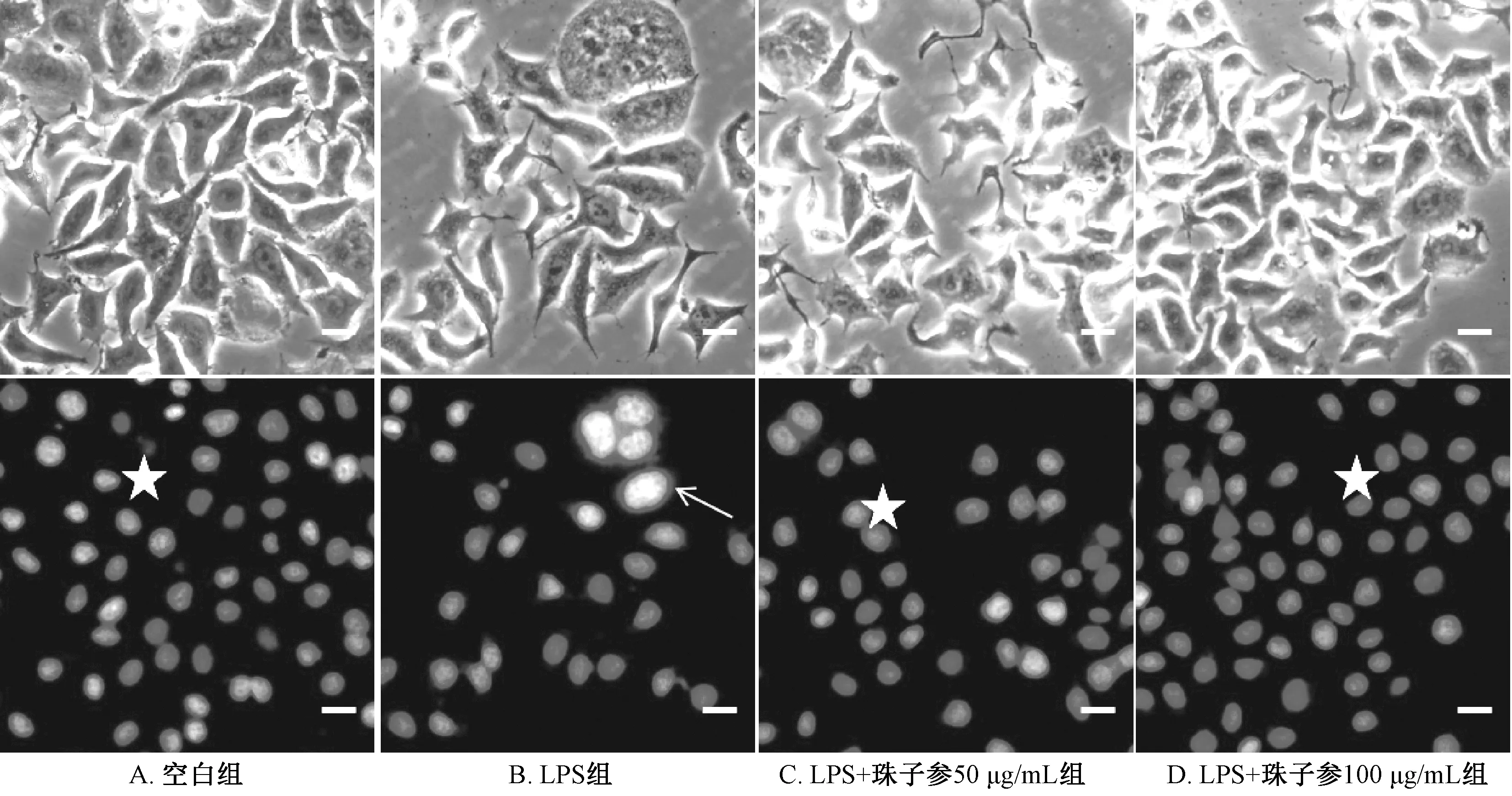
注:星号表示细胞正常生长,箭头指示细胞受到LPS损伤后的细胞核。图8 DAPI染色后各组细胞形态(×200)Fig.8 Cell morphologies in various groups after DAPI staining (×200)
3 讨论
藏象学说认为,肝的生理功能主要有“肝主疏泄”和“肝主藏血”两方面[11],它可促进人体的消化和气、血、水的正常运行[12]。本研究基于网络药理学方法,建立成分-疾病-靶点的关联研究网络,从微观的分子角度系统预测分析珠子参保肝的作用机制,为其进一步研究提供理论参考。
据报道[13],珠子参总皂苷是珠子参保肝的有效部位,其中竹节参皂苷Ⅳa和人参皂苷Ro是其主要有效成分,已有研究表明竹节参皂苷Ⅳa在原代培养大鼠肝细胞体外免疫性肝损伤的保护模型中显示出肝保护活性[14]。李聪等[15]研究发现竹节参皂苷Ⅳa通过miR-17-5p/mitofusin 2 信号通路抑制线粒体功能障碍,使得转化生长因子-β(TGF-β)、TNF-α、IL-1β等细胞因子的表达和合成降低,从而降低IL-6等炎性因子表达,另一方面也降低肝星状细胞的活化,改善了非酒精性脂肪性肝炎、肝细胞炎症、肝纤维化及肝细胞坏死等症状[16-18]。有研究[19]表明人参皂苷Ro对急慢性肝炎均有抑制作用。肝纤维化是肝硬化的早期阶段,其中乙型肝炎是其最主要的病因之一。在肝纤维化形成过程中,三七皂苷R1可通过降低TGF-β等的表达减少肝星状细胞的活化,降低细胞外基质积累来减轻肝纤维化[20]。本研究通过“成分-疾病-靶点”网络关联分析,发现珠子参发挥保肝作用的主要活性成分为竹节参皂苷Ⅳa、人参皂苷Re、人参皂苷Ro、越南皂苷R4和三七皂苷R1等。
TNF、IL-6、IL-1β是细胞促炎因子,目前认为,在脂肪肝的发病机制中TNF-α是主要因子,它诱导肝脏脂质合成,同时还促进脂肪细胞分解,从而加快肝细胞发生脂肪变性[21]。IL-6能够促进细胞毒性淋巴细胞(CTL)、自然杀伤细胞(NK)的分化并增强杀瘤活性,且肝细胞坏死程度与IL-6、TNF-α的高表达密切相关[22]。IL-1β在炎性反应过程中起继发作用,IL-1β增多可增加慢性炎症反应和组织破坏[23]。CASP3主要参与凋亡过程,但在炎症过程中也起着重要作用[24]。转录因子c-Jun能够参与多种细胞过程,包括细胞增殖与凋亡,且可调控凋亡基因也可调控促凋亡基因。研究表明,从正常肝组织到肝硬化再到肝发生癌变,c-fos、c-jun因子的表达水平呈上升趋势[25]。因此,TNF、CASP3、IL6、IL1B、JUN靶点对于保肝作用的研究非常重要。本研究通过KEGG通路富集发现,珠子参主要是通过TNF信号通路、AGE-RAGE信号通路、Th17细胞分化等通路中的TNF、CASP3、IL6、IL1B、JUN等靶点来进行保肝。
TNF能诱导细胞凋亡从而使机体产生炎症反应,TNF信号通路、AGE-RAGE信号通路的激活,能够激活诱导NF-κB入核,促进TNF-α、IL-6、IL-8等炎症因子的释放,从而引起和加重机体炎症反应[26-27]。Th17细胞是一种CD4+T细胞亚群,具有独立的分化和调节机制。Th17细胞主要分泌 IL-17和IL-21等标志性细胞因子[28]。乙型肝炎(HBV)主要通过自身免疫系统对已感染HBV的肝细胞进行攻击而致肝细胞损伤,此时具有强大促炎作用的Th17细胞发挥着重要作用。近年研究发现慢性乙型肝炎患者外周血Th17数目和IL-17表达水平显著升高,表明Th17与HBV感染后引起的肝细胞损伤有关[29-30]。另有研究显示,IL-17不仅参与肝纤维化过程[31],还参与了肝细胞炎症损伤过程。结合以往的研究以及本文研究结果,竹节参皂苷IVa和人参皂苷Ro和三七皂苷R1保肝作用预测分析机制图见图9。分子对接结果显示,与TNF、CASP3和IL1B结合性较好的是竹节参皂苷Ⅳa和人参皂苷Ro,与IL6结合性较好的是竹节参皂苷Ⅳa、人参皂苷Ro和人参皂苷Re,与JUN结合性较好的是人参皂苷Re和三七皂苷R1,因此,与这5种重要蛋白受体作用的主要成分是竹节参皂苷Ⅳa、人参皂苷Ro和人参皂苷Re。由此表明,竹节参皂苷Ⅳa、人参皂苷Ro、人参皂苷Re有可能是珠子参中起保肝作用的核心成分。

图9 竹节参皂苷Ⅳa、人参皂苷Ro和三七皂苷R1保肝作用预测机制图Fig.9 Diagram for the predictive mechanism of the hepatoprotective effect of Chikusetsusaponin Ⅳa, Ginsenoside Ro and Notoginsenoside R1
本研究通过采用不同浓度梯度的珠子参总苷提取液对脂多糖诱导L02细胞的炎性损伤进行细胞实验,结果表明珠子参总苷可以在一定程度上恢复L02细胞的炎性损伤,进一步验证了珠子参总苷对炎性损伤的肝细胞具有保护作用,但只是从网络药理学、分子对接和细胞实验初步证明了珠子参总苷对于炎性损伤的肝细胞有一定保护作用,对于更深层次的研究还需要更多实验去证明。综上所述,珠子参发挥保肝作用是主要通过活性成分竹节参皂苷Ⅳa、人参皂苷Re、人参皂苷Ro、越南皂苷R4以及三七皂苷R1等,与TNF、CASP3、IL6、IL1B、JUN等靶点相互作用,并调控乙型肝炎通路、Th17细胞分化、TNF信号通路和IL17信号通路等来发挥作用。通过分子对接技术和细胞实验进一步验证,珠子参可通过多成分、多靶点、多通路实现保肝作用。

