云南分心木提取物对小鼠高尿酸血症模型治疗作用研究
张 伟,陈雪洁,刘 蓉,沈 磊,田新雁,姜 北*
1大理大学药物研究所;2大理大学基础医学院,大理 671000
高尿酸血症(hyperuricemia,HUA)是一种尿酸(uric acid,UA)合成增加和(或)尿酸排泄减少所引起的代谢性疾病。高尿酸血症是引起痛风性关节炎,痛风性肾病等疾病的危险因素[1]。近年来,全球痛风的发病率持续提升[2-4]。目前对HUA治疗的西药有别嘌醇、苯溴马隆和非布司他等,虽疗效尚可,但均伴有肝肾毒性、药疹及耐药性等副作用[5]。因此,探寻有效且毒副作用小的药物具有比较重要的意义。
核桃(JuglansregiaL.)又名胡桃,为胡桃科(Juglandaceae)胡桃属(JuglansL.)植物,分心木(Diaphragma Juglandis Fructus,DJF),为核桃果实子房室的木质中隔,性平,无毒,具有健脾固肾的功效[6]。云南是我国核桃的起源地[7],拥有独具特色的漾濞泡核桃(JuglanssigillataDode),漾濞彝族自治县因此也享有“中国核桃之乡”的美誉,2020年产量达到5.7万吨,综合产值10亿元以上,成为当地经济支柱产业。本课题组作为国内最早从事相关研究的科研团队之一,曾于2009-2012年间对云南漾濞泡核桃分心木进行了初步的研究,并且从中分离鉴定包括没食子酸、大黄素、二氢槲皮素等近二十个成分,首次对核桃分心木中所含化学成分有了初步的认识[8]。现代药理研究表明,核桃分心木有补肾、抗氧化、抗菌、抗炎、调节免疫及抑制黄嘌呤氧化酶(xanthine oxidase,XOD)等功效[9-11],但核桃分心木对高尿酸血症的作用迄今却尚未见有报道。本文通过云南产核桃分心木干预HUA小鼠模型实验,探究分心木提取物对HUA的治疗作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级昆明种雄性小鼠,体重18~22 g,购自湖南斯莱克景达实验动物有限公司。实验动物生产许可证号SCXK(湘)2019-0004。动物实验完全依照大理大学医学伦理委员会及大理大学药学院实验动物管理委员会的相关规定进行(批准文号:MECDU-202010-7)。
1.1.2 药物和试剂
云南产分心木购于云南省大理市漾濞县。白介素1β、肿瘤坏死因子α(批号:20210312)购于南京建成生物工程研究所;尿酸(UA)、肌酐(Cr)、尿素氮(BUN)、黄嘌呤氧化酶(XOD)、总蛋白定量测试盒(批号:20201028)购于南京建成生物工程研究所;别嘌醇、腺嘌呤、氧嗪酸钾(批号依次为C1155486、C10984047、C11528491)购于上海麦克林〗生化科技有限公司;羧甲基纤维素钠(CMC-Na)(批号:F20080523)购于上海国药集团化学试剂有限公司。
1.1.3 实验仪器
Varisoskan LUX多功能酶标仪(赛默飞世科尔科技有限公司);MCO-18AIC CO2孵育箱(日本三洋电器公司);Tissuelyser-L多样品组织研磨仪(上海净信实业发展有限公司);BX53F正置显微镜(Olympus公司);T6新世纪紫外可见分光光度计(北京普析通用仪器有限公司);H6小鼠独立通气笼(苏州市苏杭科技器材有限公司);Master-S30UVF纯水机(上海和泰仪器有限公司)。
由于α-姜黄烯、α-姜烯和姜黄新酮等特征性共有峰对照品不易得,所以本实验选用β-石竹烯(S峰)为参照物,依据国家颁布的《中药注射剂指纹图谱研究的技术要求》,通过采用不同批次黄丝郁金药材样品,建立对照指纹图谱,根据对照指纹图谱的特征以及其参照峰(β-石竹烯),确定了22个共有峰。其中23号色谱峰虽然在每批样品中也都存在,而且含量约占黄丝郁金挥发油的50%,却并不是18批样品的共有峰,原因是23号色谱峰可能是由于芳基姜黄酮和姜黄酮未达到分离而共同形成的一个色谱峰,实验中曾考察了不同色谱柱和不同升温程序,但最终仍然未使之分离,如何优化实验条件使之完全分离有待进一步研究。
1.2 方法
1.2.1 供试样品的制备
取干燥供试品,粉碎后过120目筛,得分心木干粉。取干粉200 g置于蒸馏瓶中,加入500 mL蒸馏水,85 ℃回流提取3次,冷却后过滤,合并滤液,浓缩冻干(每1 g冻干粉折合生药12.5 g)得分心木水提物样品DJF-W。将DJF-W样品分别用强酸型阳离子交换树脂(FPC14Na)和强酸型苯乙烯系阳离子交换树脂(732型)处理,得去离子样品DJF-S1和样品DJF-S2。取分心木干粉按1∶3(m/V)比例加入75%乙醇,冷浸提取24 h,以相同条件提取5次,过滤,浓缩冻干(每1 g冻干粉折合生药7.8 g)得分心木醇提取物样品DJF-E。
1.2.2 高尿酸血症小鼠模型的建立
依据文献[12,13],对昆明种雄性小鼠连续灌胃造模诱导剂氧嗪酸钾(oxygen oxazine acid potassium,OXO)及腺嘌呤(adenine,Ade)可构建小鼠高尿酸血症模型。结合文献[14,15]并通过预实验对诱导剂剂量及诱导时间进行了探索,结果显示以OXO-250 mg/kg + Ade-100 mg/kg的CMC-Na混悬液连续诱导21天,模型组小鼠肾脏出现明显病变(见图1),表面出现褶皱、体积变小、颜色明显变浅,从第8天开始,给予诱导剂之后灌胃别嘌醇(10 mg/kg)治疗,连续14天,别嘌醇组小鼠肾脏病变明显减轻(见图1)。小鼠体内存在尿酸酶,影响高血尿酸的维持状态,结合文献[15,16]中给予诱导剂后血尿酸含量随时间变化的趋势和对给予诱导剂后适合的给药时间的考察结果,结果表明:控制诱导剂和治疗药时间间隔1 h,末次给药后1 h取血检测血尿酸含量时,模型组血尿酸含量显著高于正常组。运用此方案研究分心木提取物降尿酸活性。
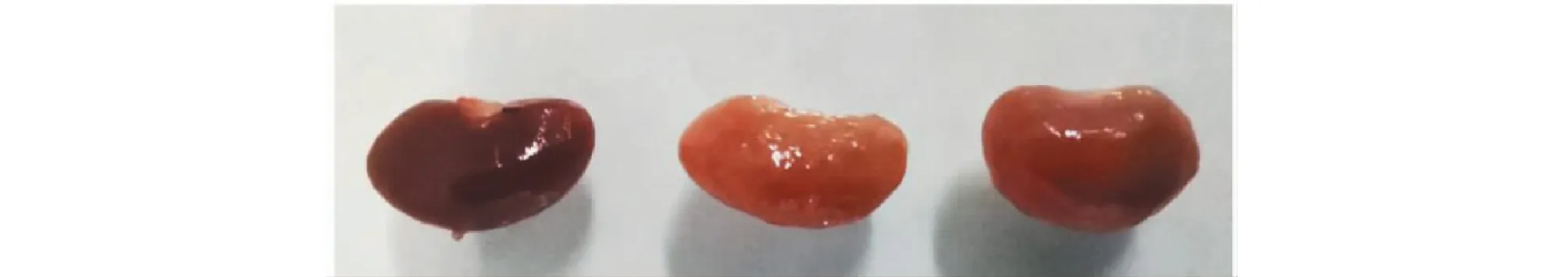
图1 肾脏变化情况Fig.1 The pathological condition of the renal注:从左到右依次为正常组、模型组、别嘌醇组。Note:From left to right,they are normal group,model group and allopurinol group.
1.2.3 分心木提取物对高尿酸血症小鼠的影响
1.2.3.1 动物分组、给药和处理
取110只昆明种雄性小鼠,分为11组(每组10只),分别为正常组(normal group)、模型组(model group)、别嘌醇组(allopurinol group,10 mg/kg);DJF-W高(H)、低(L)剂量组(2、1 g/kg);DJF-E高、低剂量组(2、1 g/kg);DJF-S1高、低剂量组(2、1 g/kg);DJF-S2高、低剂量组(2、1 g/kg)(均为冻干粉剂量)。除正常组外,其余各组小鼠分别灌胃诱导剂,正常组给予等体积的CMC-Na,连续21天。前7天在给予造模诱导剂后1 h,各组灌胃蒸馏水;第8天,在给予诱导剂后1 h,正常组继续灌胃蒸馏水、样品组给予相应样品溶液、别嘌醇组给予别嘌醇10 mg/kg,连续14天[17]。
1.2.3.2 取材及生化指标测定
末次给药治疗后1 h,各组小鼠眼球后静脉丛取血,室温静置30 min后,3 500 rpm离心15 min,收集上层血清,置于-20 ℃备用,按照试剂盒说明书测定尿酸(UA)、肌酐(Cr)和尿素氮(BUN)的含量;取肝脏,按照试剂盒说明书测定黄嘌呤氧化酶(XOD)的活性;取肾组织用4 ℃生理盐水清洗,滤纸吸干后称重,每只小鼠取50 mg左右组织,按1∶9的比例加入0.9%生理盐水,机械匀浆。3 500 rpm,4 ℃离心10 min后取上清液得10%的肾脏组织匀浆。按试剂盒说明书应用ELISA法测定肿瘤坏死因子α(TNF-α)和白介素1β(IL-1β)的水平。
1.2.3.3 肾组织形态学病变检测
取相同部位肾组织,经生理盐水冲洗后,常规取材、脱水、包埋、制片、HE染色后,在光学显微镜下观察并描述。
1.2.4 数据处理
数据采用mean ± SD在图像上表示,SPSS 20.0软件进行统计学分析,进行单因素方差分析(One-Way ANOVE)比较组间差异,P< 0.05认为差异有统计学意义。
2 实验结果
2.1 水提物样品元素差异分析
通过检测去离子样品和水提物样品中无机元素的含量,对比得出两种去离子样品无机元素去除率见表1,水提物、S1样品、S2样品三者之间无机元素含量存在差异。与S2样品相比,S1样本Zn、Ca、Mn、Cu、Mg元素的去除率较高,Fe和Cr较低。

表1 两种去离子样品无机元素的去除率Table 1 Removal rate of inorganic elements in two deionized samples
2.2 分心木提取物对高尿酸血症小鼠的降尿酸作用
分心木提取物对小鼠血清中UA水平以及肝脏中XOD活性的影响情况见图2。与正常组比较,模型组小鼠血清UA水平及肝脏XOD活性明显升高(n= 10,P< 0.01);与模型组比较,阳性药别嘌醇显著降低小鼠血清UA水平及肝脏XOD活性(n= 10,P< 0.01),分心木各提取物各剂量均能不同程度的降低UA的水平和XOD的活性,其中分心木水提物高剂量及醇提物高剂量的效果最为显著(n= 10,P< 0.01),但均弱于别嘌醇;去离子样品的效果相对较弱;各样本组的效应基本呈现一定的量效关系。
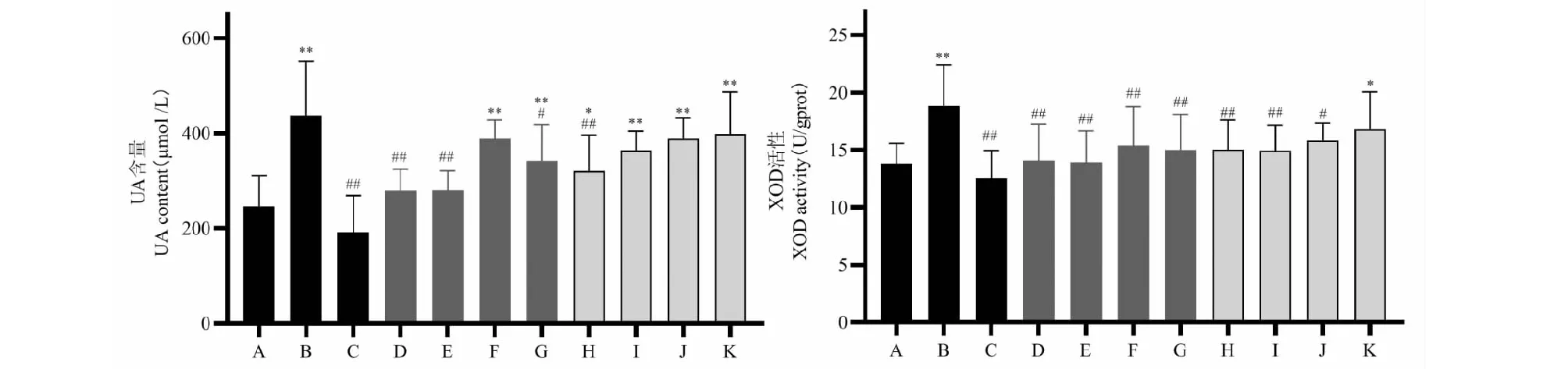
图2 分心木提取物对HUA小鼠模型血清UA和肝脏XOD的影响Fig.2 Effect of the extracts of DJF on the serum UA and XOD activity of the liver in HUA mice注:A:正常组;B:模型组;C:别嘌醇组;D:DJF-W(H)组;E:DJF-E(H)组,F:DJF-S1(H)组;G:DJF-S2(H)组;H:DJF-W(L)组;I:DJF-E(L)组;J:DJF-S1(L)组;K:DJF-S2(L)组;别嘌醇剂量为10 mg/kg,分心木提取物高、低剂量为2、1 mg/kg;与正常组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;下同。Note:A:Normal group;B:Model group;C:Allopurinol group;D:DJF-W(H) group;E:DJF-E(H) group;F:DJF-S1(H) group;G:DJF-S2(H) group;H:DJF-W(L) group;I:DJF-E(L) group;J:DJF-S1(L) group;K:DJF-S2(L) group.The dose of allopurinol was 10 mg/kg;the high dose and low dose of DJF extracts were 2 and 1 mg/kg.Compared with the normal group, *P < 0.05,**P < 0.01;Compared with the model group,*P < 0.05,**P < 0.01;the same below.
2.3 分心木提取物对高尿酸血症小鼠肾组织及炎症因子的影响
2.3.1 肾脏功能指标
分心木提取物对小鼠血清中Cr和BUN水平的影响情况见图3。与正常组相比较,模型组小鼠血清Cr及BUN水平明显升高(n= 10,P< 0.01);与模型组比较,阳性药别嘌醇显著降低小鼠血清Cr及BUN水平(n= 10,P< 0.01),分心木各提取物各剂量组均能不同程度的降低这两个指标,其中分心木醇提物高、低剂量的效果最为显著(n= 10,P< 0.01),但弱于别嘌醇;水提物的降低效果次之,去离子样品效应最弱,各样本组的效应基本呈现一定的量效关系。
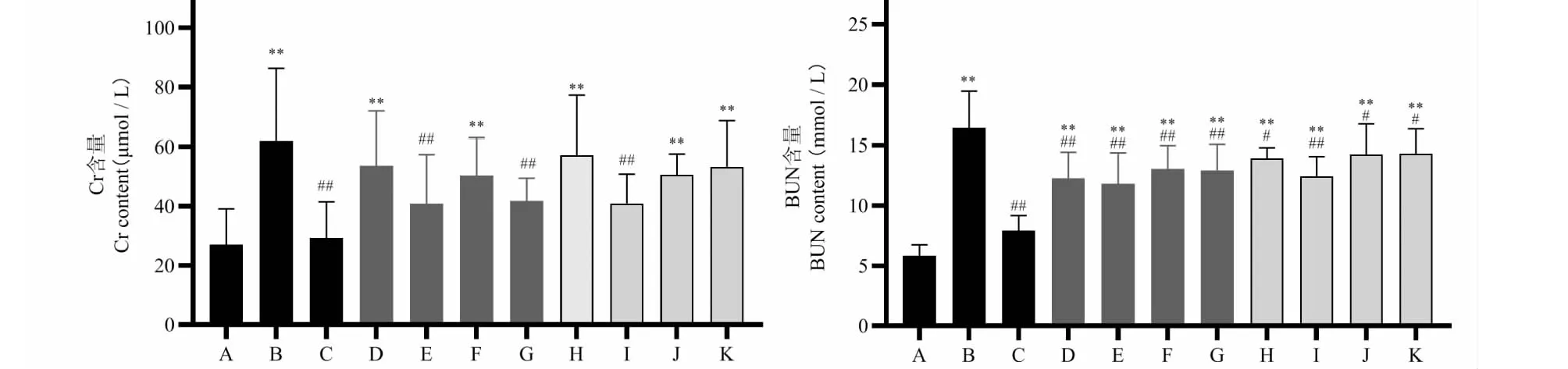
图3 分心木提取物对HUA小鼠模型Cr和BUN水平的影响 Fig.3 Effect of the extracts of DJF on the level of Cr and BUN in HUA mice
2.3.2 肾组织炎症因子的测定
分心木提取物对小鼠肾脏组织中IL-1β和TNF-α水平的影响情况见图4。与正常组相比较,模型组小鼠肾脏组织中IL-1β和TNF-α水平明显升高(n= 10,P< 0.01);与模型组比较,阳性药别嘌醇显著降低小鼠肾脏组织中IL-1β和TNF-α水平(n= 10,P< 0.01),分心木各提取物各剂量组均能不同程度的降低这两个指标,其中云南分心木醇提物高、低剂量的效果最为显著(n= 10,P< 0.01),且强于别嘌醇;水提物效应的效果次之,去离子样品最弱,各样本组的效应基本呈现一定的量效关系。

图4 分心木提取物对HUA小鼠模型IL-1β和TNF-α水平的影响 Fig.4 Effect of the extracts of DJF on the level of IL-1β and TNF-α in HUA mice
2.3.3 肾组织形态学病变检测
分心木提取物对小鼠肾脏形态学的影响如图5。将肾组织切片用HE染色,于400倍数不同视野下对各组进行图片采集,镜下显示正常组(n=5)肾小管边界清晰,小管上皮细胞排列整齐,紧密。模型组(n=5)有炎症细胞浸润,较多细胞出现肿胀,肾小管扩张明显且细胞边界不明显,较多的肾小管坏死,肾小球严重损伤,表明氧嗪酸钾和腺嘌呤可对肾脏结构造成严重的破坏。与模型组相比,阳性药组(n=5)炎症细胞浸润明显减少,肾小管扩张程度减轻,细胞形态正常,表明别嘌醇的治疗效果明显;分心木各提取物组(n=5)表现不同程度的病理变化,其中图E病变程度最轻,图D次之,余下各组具有明显的结构破坏,表明分心木高剂量的水提取物及醇提物可有效减轻肾脏结构的损伤,其余剂量样品治疗效果相对较差。

图5 小鼠肾脏病理切片(×400,标尺:50 μm)Fig.5 Pathological section of mouse renal (×400,scale:50 μm)注:黑色箭头指肾小管坏死;白色箭头指肾小管扩张;黑色圆圈指炎症细胞浸润;黑色方框指肾小球损伤。Note:The black arrows indicate renal tubular necrosis;The white arrows indicate renal tubules dilate;The black circles indicate inflammatory cell infiltration;The black box indicates glomerular injury.
3 讨论与结论
尿酸(UA)是嘌呤类化合物代谢的终产物,黄嘌呤氧化酶是其代谢过程中的关键酶,因此其活力可以作为评价机体生成尿酸能力的关键性指标[18]。肾脏是人类代谢UA的主要器官,UA易形成尿酸结晶在肾脏中沉积,可引发尿酸性肾损伤(uric acid nephropathy,UAN)[19];并且可刺激强烈的炎症反应,使得肾脏结构和功能异常[20]。
人类在不断进化的过程中尿酸酶的基因突变导致尿酸酶失活,使得尿酸成为了嘌呤类化合物代谢的最终产物。与人类不同,啮齿类动物可将尿酸通过尿酸酶进一步分解,更易排出体外[21]。本研究给予昆明种小鼠氧嗪酸钾和腺嘌呤,通过增加来源和抑制去路的方式联合干预血尿酸水平,严格控制给予诱导剂后的取血时间,复制出既血尿酸水平显著升高且有肾损伤的动物模型,接近人类患有高尿酸血症的状态。
传统民族民间医药记载,分心木有固涩收敛、健脾固肾等功效[6]。近年来,分心木用途日趋广泛,研究也越来越多。Jing等[11]对分心木中的成分进行了体外抑制XOD活性的探究,结果表明部分其成分具有良好的抑制活性。结合抑制XOD活性和炎症反应是治疗HUA引发肾损伤的有效靶点以及分心木的药用记载和现代研究,本课题组进行了分心木对高尿酸血症小鼠治疗作用的探究。结果表明,与模型组相比,分心木醇提物2 g/kg组的小鼠肝脏中XOD的活性水平明显下调;血清中的UA含量也明显下降。XOD是生成UA的关键控速酶,直接决定UA的生成量,表明云南分心木醇提物可以通过抑制XOD的活性,起到降低血UA含量的作用。尿酸结晶及游离态的尿酸可协同影响炎症因子的表达,直接影响促炎症细胞因子白介素1β(interleukin 1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)等其他炎症因子的生成,IL-1β生成过量时可诱导肾小球硬化及系膜细胞发生增殖[22],大量的TNF-α也会加剧炎症反应。云南分心木醇提物组的小鼠肾脏组织的炎症因子TNF-α、IL-1β和血清中Cr、BUN的含量明显低于模型组,表明分心木醇提物有清除炎症因子的功效且优于别嘌醇,也可下调间接表现肾功能的指标Cr、BUN[23],改善肾脏的功能。
微量元素生理生化功能非常广泛,是机体正常活动的基础[24]。例如,锌元素是机体必需的营养素和必要的还原剂[25],也可在生殖和泌尿系统中发挥重要作用[26]。课题组前期研究结果显示,云南分心木含有Cu、Zn、Fe、Mn、Mg等多种微量元素,为了验证云南分心木中的微量元素对治疗HUA是否有作用,本研究将分心木水提物去除无机元素后的样品同水提物进行了药效学对比,结果显示,强酸型阳离子交换树脂(FPC14Na)处理的去离子提取物DJF-S1中锌元素的去除效果明显高于强酸型苯乙烯系阳离子交换树脂(732型)处理的去离子提取物DJF-S2,同剂量下DJF-S1样品对HUA小鼠的治疗效果弱于DJF-S2样本,且两种去离子样本对HUA小鼠的治疗效果均弱于DJF-W样本,表明分心木中富含的锌元素可能是治疗高尿酸血症的重要成分,本研究为深入研究微量元素作用于高尿酸血症的机制提供方向。
综上所述,分心木醇提物具有改善肾功能、抑制XOD活性的作用以及抗炎的功效,一定程度上可降低高尿酸血症小鼠的尿酸水平。目前西药治疗HUA有一定的优势,但不可忽视它的不良反应,而植物药在安全性高、多靶点协同治疗方面有明显优势,本文研究结果为后续的机制研究提供了重要的线索,明确了研究方向,对后期寻找高效低毒的有效成分提供了依据,同时也为分心木的开发利用提供了新的思路。

