雷公藤多苷片中雷公藤甲素与体外肝毒性相关性研究△
王曼虹,王雪,颜玉静,黄芝瑛,汪祺*,文海若*
1.中国食品药品检定研究院,北京 100050;2.中山大学 药学院,广东 广州 510006
雷公藤多苷片(TripterygiumGlycoside Tablets,TPT)由卫矛科雷公藤属植物雷公藤去皮制备而成,具有较强的抗炎、免疫抑制、抗肿瘤等药理作用[1],对类风湿性关节炎、肾病综合征、自身免疫肝炎和皮肤病等均具有良好的治疗效果[2]。但自TPT应用于临床以来,其不良反应和器官毒性时有报道[3-4],以肝脏毒性报道最为多见。如李红刚等[5]发现,683 例服用TPT 的病例中110 例出现肝损伤,发生率约为16%,具体临床表现为肝脏压痛感、皮肤和尿液黄染、血清谷丙转氨酶和谷草转氨酶(AST)水平升高等。研究提示,其毒性作用机制可能与脂质过氧化、肝细胞过度凋亡、免疫损伤、肝药酶活性改变、糖和脂肪代谢异常等因素有关[6]。
TPT 所含成分复杂,主要成分包括生物碱、雷公藤甲素(triptolide,TP)、雷公藤内酯甲(wilforlide A,WA)和雷公藤红素等[7]。研究提示,TPT 中TP 活性最强,但因该成分同时具有较强的毒性作用[8-9],《中华人民共和国药典》2020年版中TPT将TP列为检查项,规定其上限。前期采用国家药品监督管理局局颁标准(WS3-B-3350-98-2011)[10]对10个企业171批雷公藤多苷片进行标准检验发现,市场上TPT 中TP 含量多寡各异,部分企业生产的TPT中甚至不含有TP。因此,TPT的毒性是否仅与TP有关成为亟待解决的问题。
本研究采用人源肝细胞系HepaRG 研究不同生产企业生产的TPT 的肝毒性差异,同时明确TPT 中主要成分TP与肝毒性的相关性,本研究结果将为完善TPT的质量标准、临床合理用药提供参考。
1 材料
1.1 仪器
VICTOR X5 型多功能酶标仪(PerkinElmer 公司);BD FACSCalibur 型流式细胞仪(美国BD 公司);H500FR 型台式高速冷冻离心机(Kokusan 公司);7180 型全自动生化分析仪(日立公司);PB203-N 型电子天平(Mettler-Toledo 公司);CKX31 型显微镜(Olympus 公司);SI-T246 Vortex-Ge 型涡旋振荡仪(海门市其林贝尔仪器制造有限公司);ND-2000 型分光光度计(Thermo Fisher Scientific 公司);iBright 1500 型凝胶成像系统(上海天能科技有限公司);Quantstudio DX 型荧光定量PCR仪(Applied Biosystems公司)。
1.2 试药
人源肝细胞系HepaRG 购自Thermo Fisher Scientific 公司,本研究所用细胞为第12~13 代。TP对照品(中国食品药品检定研究院,批号:111567-201404,纯度:99.8%);TPT(涉及生产企业:A~G,此处以字母代表;H 为在G 企业产品中人为在66.67 mg·mL-1TPT 中添加TP 100 μg·mL-1,作为TP 毒性评价对照);cell counting kit-8(cck-8,日本同仁化学研究所);Annexin V-FITC/PI 细胞凋亡检测试剂盒(美国BD 公司);TRNzol 总RNA 提取试剂(天根生化科技有限公司);PrimeScript™RT reagent Kit with gDNA Eraser、SYBR® Premix ExTaq™Ⅱ(Tli RNaseH Plus)、ROX plus、DL2000 DNA Marker(宝生物工程有限公司);引物合成(北京Invitrogen公司)。
2 方法
2.1 细胞毒性考察
将处于对数生长期的HepaRG 细胞消化后,调整至5×104个/mL,在96 孔板中每孔接种约5000 个细胞,孵育18~24 h 后给药。分设空白对照组(不含HepaRG 细胞)、溶媒对照组[0.5%二甲基亚砜(DMSO)]及不同浓度的给药组[TP 及WA 浓度:5~320 nmol·L-1;TPT质量浓度:根据各TPT给药后细胞存活率,取半数抑制浓度(IC50)为中间浓度,并上下各设1 个浓度组],于37 ℃、5% CO2的条件下孵育24 h 后,每孔加入CCK-8 检测试剂10 μL,37 ℃避光孵育2 h 后用酶标仪检测各孔450 nm 波长处的吸光度值(A),按公式(1)计算细胞存活率。在进一步毒性研究中,不同受试物的给药浓度以IC50为中间浓度(高浓度时细胞存活率约为20%,低浓度时则约为70%)。

2.2 HepaRG细胞凋亡率考察
将处于对数生长期的HepaRG细胞消化后接种于6孔板中,待细胞贴壁生长覆盖皿底80%~90%时给药。分设溶媒对照组(0.5%DMSO)及不同浓度的给药组(详见2.1项),于37 ℃、5%CO2的条件下孵育24 h 后,收集上清液,并用不含乙二胺四乙酸(EDTA)的胰酶消化细胞,合并收集于离心管中离心[4 ℃,3000 r·min-1,离心10 min(离心半径为13.5 cm)]。细胞经预冷的磷酸盐缓冲液(PBS)洗涤2 遍后,每管加1×binding buffer 100 μL 重悬细胞,在避光条件下每管加Annexin V-FITC 10 μL 并孵育15 min。之后,每管加碘化丙啶(PI)5 μL,孵育5 min。孵育完成后每管加入1×Binding Buffer 400 μL稀释,吹打混匀后转移至流式管中,1 h内上机检测。
2.3 HepaRG细胞生化指标测定
细胞培养和给药与2.2 项下方法相同。给药处理结束后,样本经离心[4 ℃,3000 r·min-1,离心10 min(离心半径为13.5 cm)]分离出上清液。使用全自动生化分析仪检测上清液中AST、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、肌酸激酶(CK)和谷氨酰转肽酶(GGT)的水平。
2.4 HepaRG细胞因子水平测定
细胞培养、给药及消化收集与2.2 项下方法相同。用TRNzol 总RNA 提取试剂提取细胞样本的总RNA,以NanoDrop®ND-2000 测定总RNA 的浓度和纯度。使用含gDNA Eraser 的PrimeScript ™RT reagent Kit 进行cDNA 反转录后,经SYBR GreenⅠReal time PCR(内参为18S rRNA 基因),检测细胞样本中白细胞介素-6(IL-6)、IL-10、肿瘤坏死因子-α(TNF-α)和γ-干扰素(IFN-γ)表达量的变化,引物序列设计见表1。

表1 实时定量PCR法细胞因子测定引物序列
2.5 统计学方法
细胞存活率、细胞凋亡率、生化指标水平、细胞因子水平等数据用()表示。采用单因素方差分析对组间数据进行检验,P<0.05 表示差异有统计学意义。数据图与统计结果经GraphPad Prism 7软件处理生成。
3 结果
前期采用国家药品监督管理局局颁标准(WS3-B-3350-98-2011)对10个企业171批雷公藤多苷片进行标准检验,在此基础上选取其中7家生产企业的TPT进行进一步研究。这7家生产企业TPT中,TP含量差异较大(表2~3)。以66.67 mg·mL-1TPT计,不同企业TPT中含有的TP质量浓度在0~77.78 μg·mL-1,其中企业G的产品中TP质量浓度为0 μg·mL-1[11]。
表2 不同生产企业TPT中TP含量()μg/片
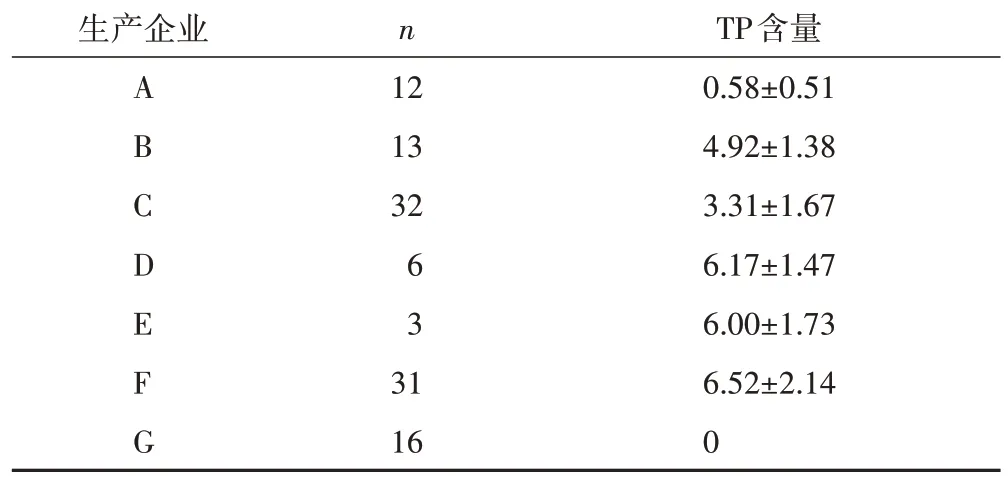
表2 不同生产企业TPT中TP含量()μg/片
表3 不同生产企业每66.67 mg·mL-1 TPT中TP质量浓度()
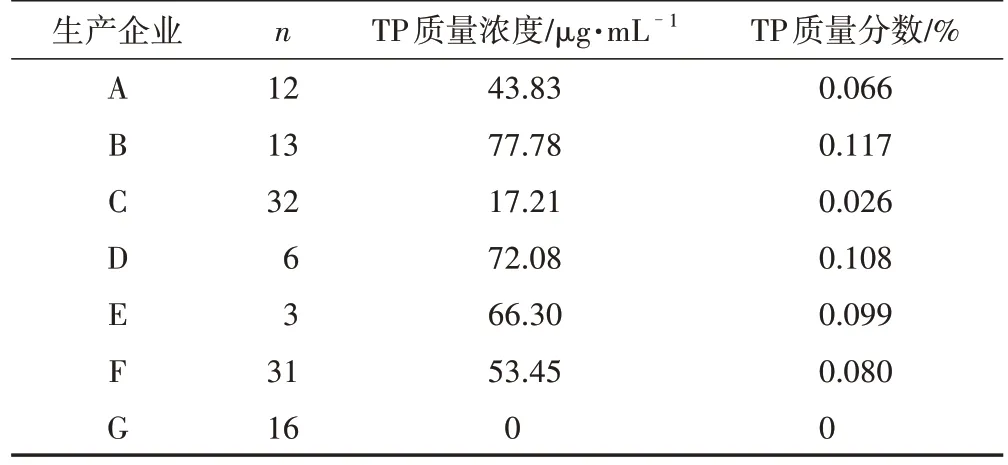
表3 不同生产企业每66.67 mg·mL-1 TPT中TP质量浓度()
3.1 TP及TPT的细胞毒性
使用CCK-8 法测定HepaRG 细胞经不同浓度(5~320 nmol·L-1)TP 处理24 h 后的相对细胞存活率。结果发现,TP 的IC50约为15.14 nmol·L-1。以下研究重点考察不同生产企业TP含量与毒性差异之间的关联。
实验发现,所有企业的TPT 均可显著降低HepaRG 细胞的存活率,且随着TP 浓度增加,细胞存活率逐渐降低且存在浓度效应相关性,见图1。
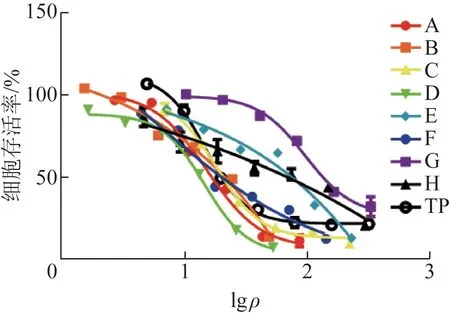
图1 TP及不同企业TPT对HepaRG存活率的影响
H为G企业样品添加100 μg·mL-1TP的对照组,前者IC50低于后者(表4),提示TP 的加入可明显增加TPT制剂的细胞毒性。
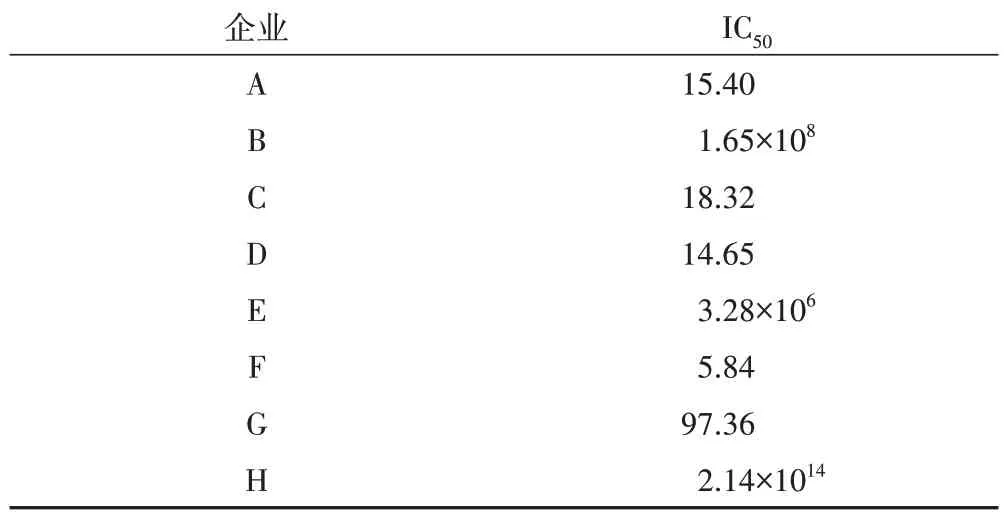
表4 不同企业TPT对HepaRG细胞IC50 μg·mL-1
3.2 TP及TPT对HepaRG细胞凋亡率的影响
细胞凋亡是药源性肝损伤的重要作用机制之一,前期研究提示,诱导细胞凋亡是TP 的药效学及毒理作用机制之一[12]。本研究使用流式细胞计数法研究TP 对HepaRG 细胞凋亡率的影响,发现TP 浓度>20 nmol·L-1(约为7.20 ng·mL-1)时可显著升高HepaRG 细胞凋亡率(P<0.001),且呈一定浓度效应相关性(图2)。
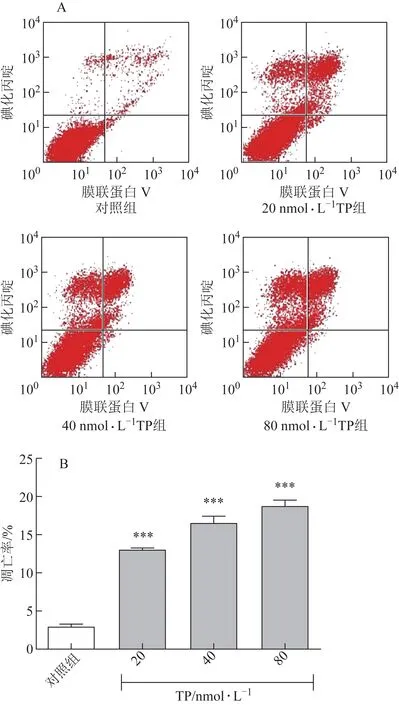
图2 TP对HepaRG细胞凋亡率的影响(,n=3)
7 家生产企业TPT 的测定结果发现,除D 企业TPT中的低质量浓度6.66 μg·mL-1(相应TP质量浓度为7.20 ng·mL-1,与TP 单独给药导致凋亡起始浓度一致)仅引起HepaRG 细胞凋亡率微弱上升外(D毒性最弱,TP 含量也最低),其他企业TPT 均自低浓度起即可引起HepaRG 的凋亡率显著上升,且存在浓度效应相关性(P<0.05,P<0.001,图3)。结合不同TPT 中TP 浓度对HepaRG 细胞凋亡率的影响,TP 含量与HepaRG 细胞凋亡率有一定关联,其中H 为G 的TP 添加对照,添加TP 后凋亡率相比G略有升高。然而C 企业样品导致凋亡的起始浓度中含有的TP 经折算约为10 nmol·L-1,低于TP 单独给药导致凋亡的起始浓度。此外,在不含TP 的情况下,G仍可导致HepaRG细胞的凋亡率显著上升,提示TP并非TPT导致细胞凋亡的唯一决定因素。
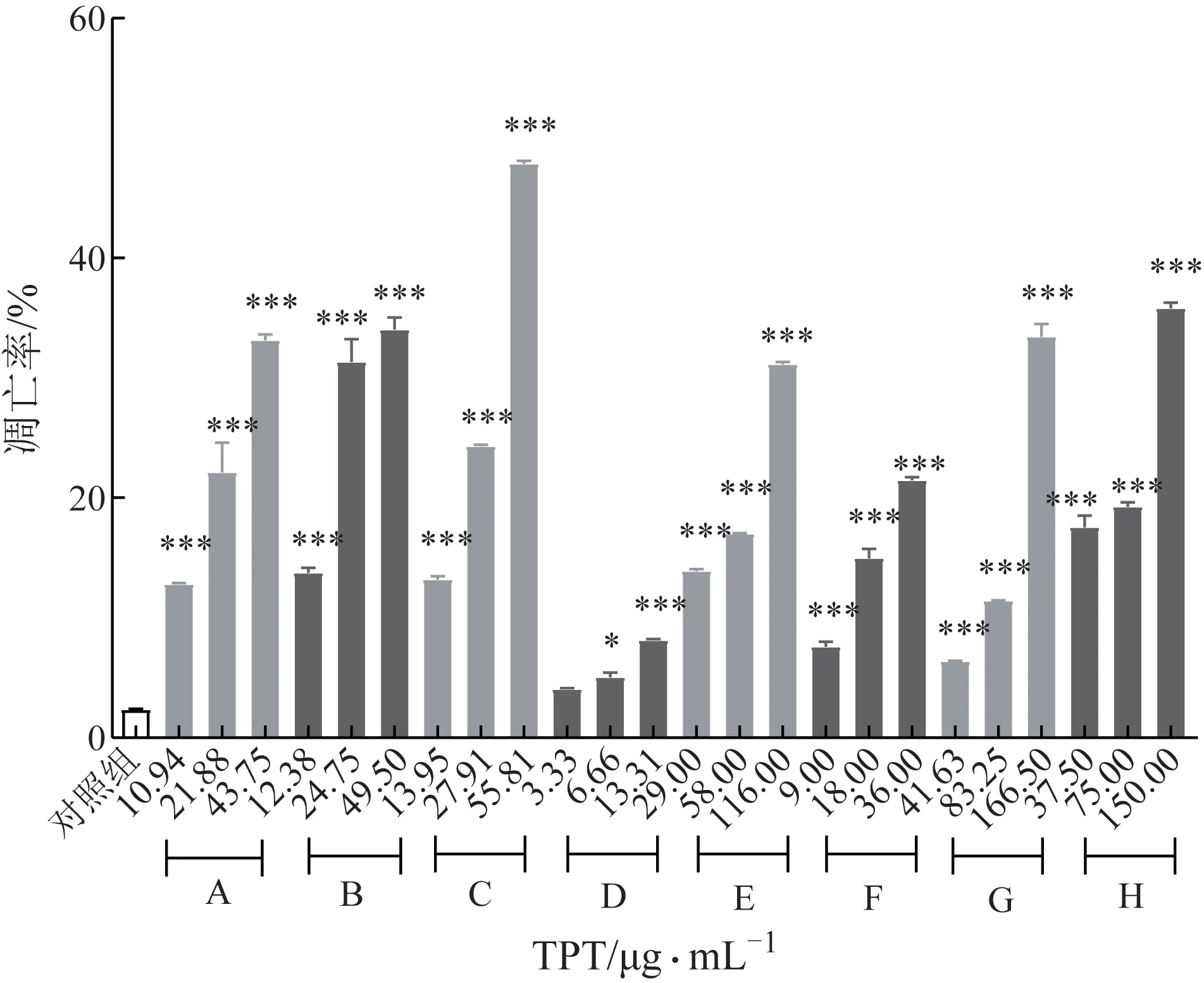
图3 不同生产企业TPT(A~H)对HepaRG细胞凋亡率的影响
3.3 TP及TPT对HepaRG细胞生化指标的影响
血清生化指标中,AST、ALP、LDH、GGT 及CK 升高均与肝毒性有关[13]。研究结果发现(图4),TP 浓度>20 nmol·L-1时可导致LDH 升高(P<0.05,P<0.01,P<0.001),质量浓度>40 nmol·L-1时可引起AST、ALP 升高(P<0.05,P<0.01,P<0.001);TP 在40 nmol·L-1时还可引起CK 的显著升高(P<0.05),在80 nmol·L-1时 可引起GGT 的显著升高(P<0.01),提示TP在不同浓度可导致不同程度的肝细胞功能异常。
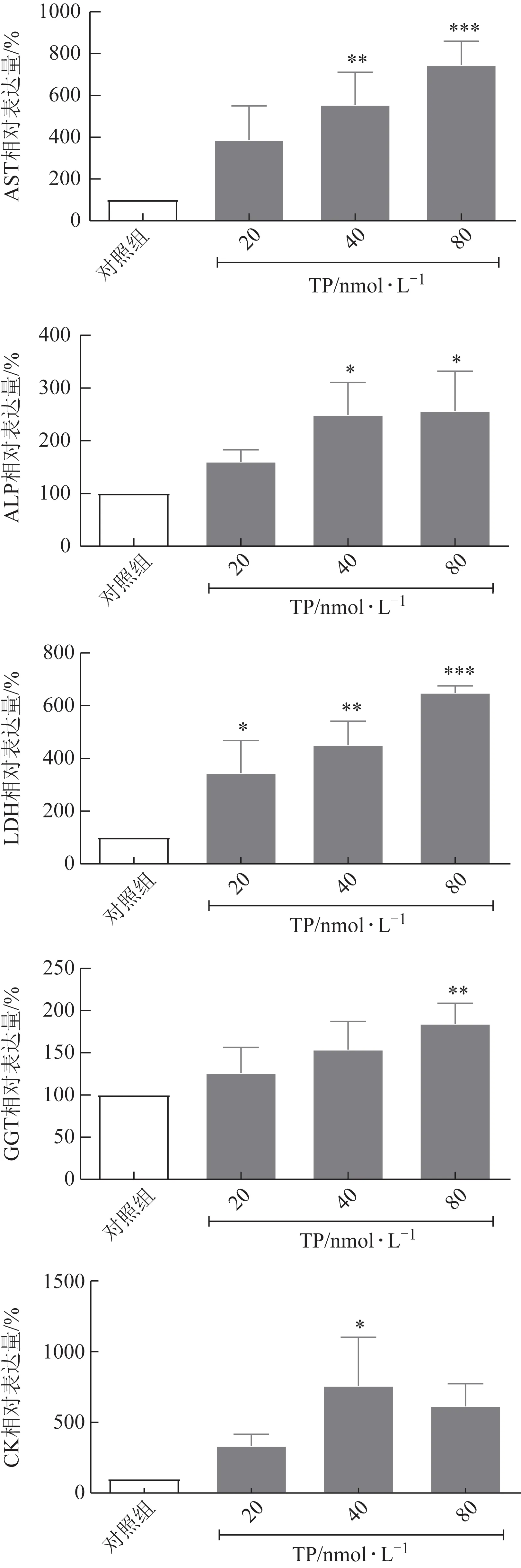
图4 TP对HepaRG生化指标的影响(,n=3)
不同企业样品的测定结果发现(图5),来自B、E、F 和H 企业的TPT 均可不同程度引起AST、ALP、LDH、CK、GGT等指标的升高,升高程度为H>E>B>F;A 和C 企业的TPT 可引起AST、ALP、LDH、CK 的升高;G 企业的TPT 仅可引起AST、LDH 的升高,而D 企业TPT 对各个指标差异均无统计学意义(D 中TP 浓度最低);结合各TPT 的药物浓度及TP 浓度,提示肝损伤的发生与TPT 中的TP浓度相关。实验为考察TP 的毒性作用,对比G 及人为添加TP 的对照H 样本,添加TP 可导致AST 和LDH进一步升高,提示TP是引起肝细胞损伤的重要因素;且TP 进一步升高ALP 及CK 水平[13]从而对胆汁淤积与细胞能量代谢产生影响,但除此以外,TPT 中其他成分也存在一定肝毒性风险。本研究结果提示,各企业的TPT 均有一定的肝损伤作用,且TP 含量与细胞毒性、细胞凋亡、ALP、CK、TNF-α和IFN-γ变化直接相关,AST、LDH、TNF-α和IFN-γ是检测TP导致的肝细胞毒性的较为灵敏指标,且变化趋势与文献中体内研究报道大致相符[14-16]。
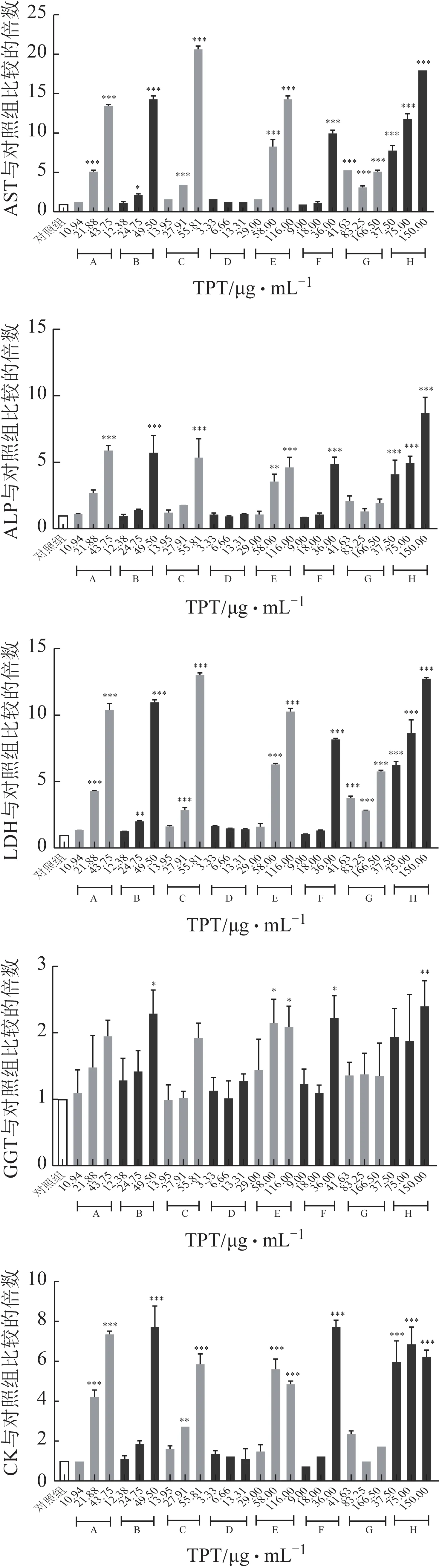
图5 不同生产企业TPT对HepaRG细胞生化指标的影响(,n=3)
3.4 TP及TPT对HepaRG细胞因子水平的影响
细胞因子是由免疫细胞和某些非免疫细胞经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质,具有调节固有免疫和适应性免疫、血细胞生成、细胞生长及损伤组织修复等多种功能[13]。结果发现IL-6 和TNF-α为对TP 毒性最为灵敏的指标。TP浓度>20 nmol·L-1时可显著降低IL-6和TNF-α的水平(P<0.001),浓度为20~40 nmol·L-1时可显著升高IL-10及IFN-γ的水平(P<0.05,P<0.01,P<0.001,见图6)。TP 可影响多种细胞因子分泌水平,从而介导抗炎和免疫抑制作用,上述结果与文献报道基本相符[17-18]。
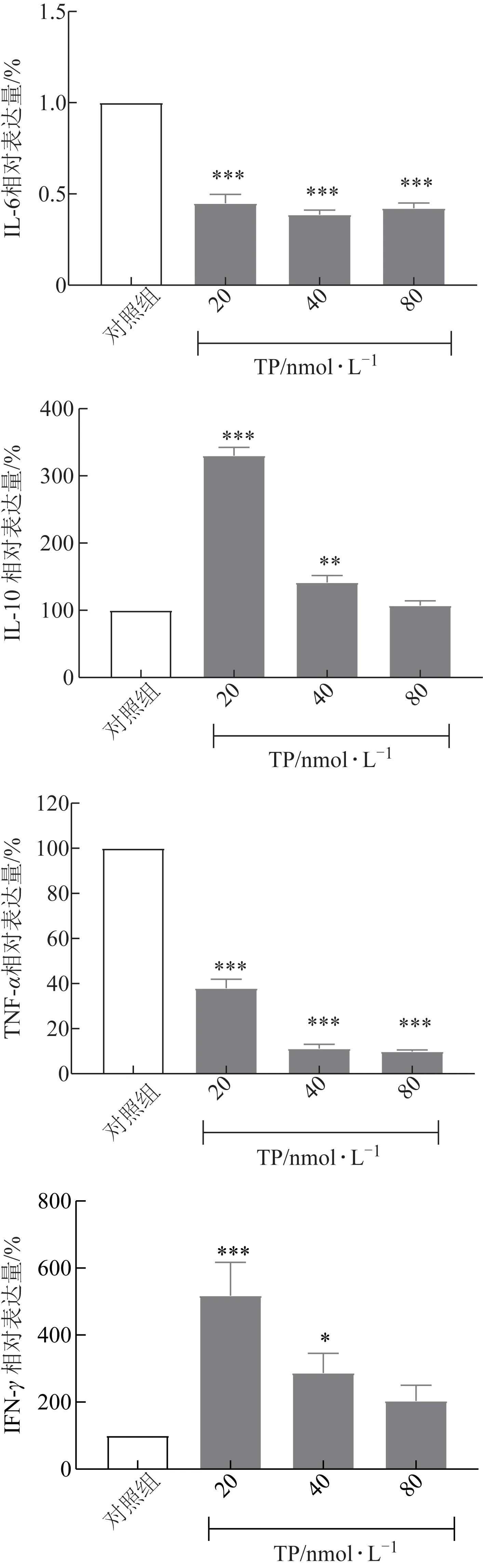
图6 TP对HepaRG细胞因子水平的影响(,n=3)
如图7 所示,来自7 个企业的TPT 均可降低HepaRG 细胞TNF-α的水平,且呈一定剂量效应相关性;此外,部分企业的TPT(如A、B、C、E 和F)可升高IL-10水平。上述变化趋势与TP的作用基本相符,提示TPT的抗炎与免疫抑制作用与TP含量有关。然而,部分企业的TPT(如A、B、D、G 和H)则诱导IL-6 的水平升高;部分企业的TPT(如A、B、C、E 和F)可显著降低IFN-γ水平,但B、E、F 和H 企业的TPT 作用浓度较高时(细胞存活率低于50%)导致IFN-γ水平升高,提示其虽有一定的抗炎作用,但也有一定的肝损伤作用。上述变化与TP 单独作用的结果不符,故推断TPT 中其他成分,尤其是在其存在一定细胞毒性的浓度下,可能对TP的抗炎作用产生一定影响。
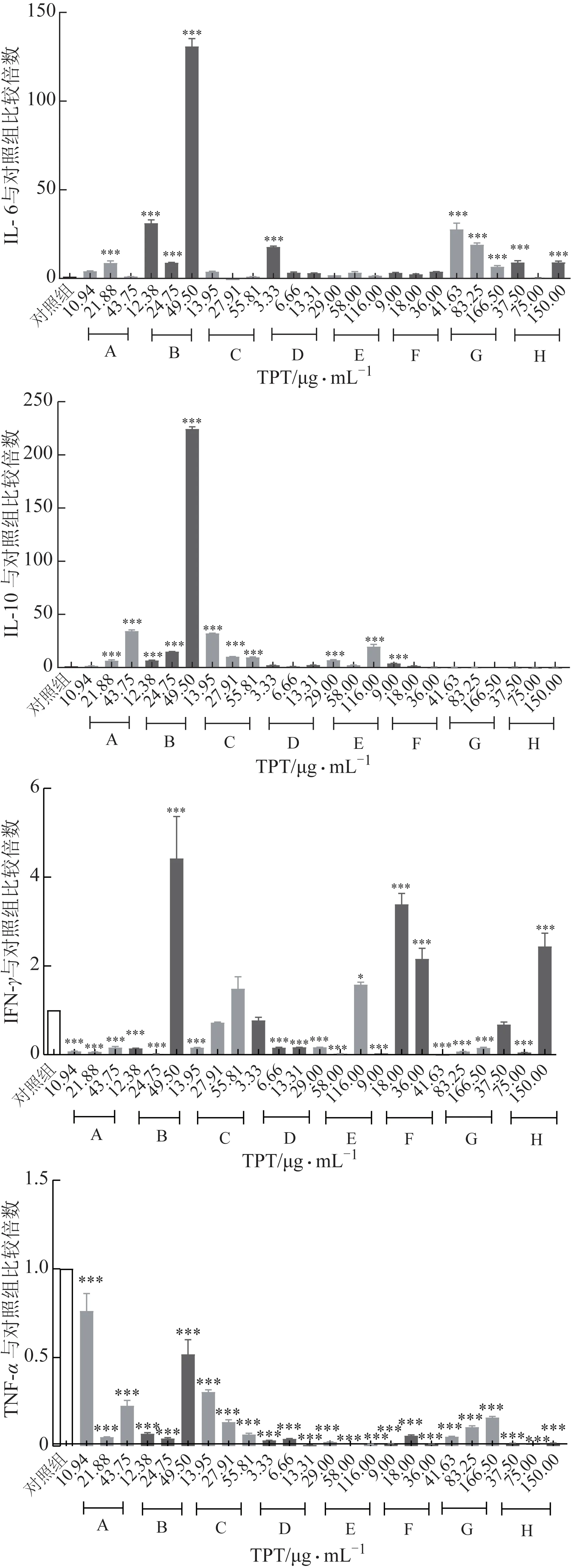
图7 不同生产企业TPT对HepaRG细胞因子水平的影响(,n=3)
4 结论
TPT 是目前临床广泛使用的非甾体类免疫制剂[19],其疗效显著,但临床不良反应不容忽视。据报道,TPT 的不良反应发生率可达58.1%,主要表现为药物性肝炎、肝功能异常等[20]。TPT 的不良反应极大地限制了其临床应用。研究提示,TPT 所含有的二萜、三萜类化合物及苷类物质均有一定的毒性[7]。现行标准将TP 列为检查项,控制其上限。然而,不同生产企业的TPT 中TP 质量浓度差异显著(0~77.78 μg·mL-1)[11]。尽管TP 药效显著,其毒性作用也不容忽视[21-22]。故将TP 含量控制在合理范围内是保障TPT 临床有效性、安全性的重要基础,本研究针对TP在TPT整体毒性中扮演的角色进行了有益的探索。
综上,本研究以HepaRG 细胞为实验模型,发现TP 含量与TPT 的肝细胞毒性存在正相关,当TP细胞给药浓度低于20 nmol·L-1时,其细胞毒性不明显,可作为其在药物中含量限设定的参考。然而TP的含量并非TPT诱发肝细胞毒性的唯一决定性因素。如A 企业和C 企业的TPT 也表现出较高的细胞毒性且AST等肝损伤指标呈显著性升高。然而两者TP含量较低,其肝毒性与TP含量无必然关联。因此,后续可针对TPT 中更多成分的肝损伤风险展开研究。本研究结果将为完善TPT 质量控制指标、临床合理应用提供参考。

