基于1H-NMR代谢组学探讨柴胡-白芍药对“疏肝解郁”的代谢调控途径△
李添,李肖,田俊生,高晓霞,秦雪梅,周玉枝
山西大学 中医药现代研究中心/化学生物学与分子工程教育部重点实验室,山西 太原 030006
抑郁症是一类情感性精神障碍,近年来,由于工作、生活压力增大,加之各种社会因素的产生,使得抑郁症越来越频发[1],近10 年,抑郁症成为了精神残疾的主要原因[2]。目前,关于抑郁症的研究多数集中在海马、额叶皮质和纹状体等中枢神经系统[3-4],而肝脏作为机体物质代谢和能量代谢的中心,在抑郁症研究中也有不可或缺的作用。根据中医理论,抑郁是由“肝气郁结”引起的,因此,缓解“肝气郁结”被认为是治疗抑郁的有效疗法[5]。Jia 等[6-7]采用液相色谱-质谱法(LC-MS)代谢组学筛选出大鼠肝脏中18 种慢性不可预知温和应激(CUMS)诱导产生的差异代谢物,通过分子生物学手段验证了肝脏组织中与抑郁最相关的磷脂和胆汁酸代谢通路中关键酶(包括溶血磷脂酶I、溶血磷脂水解酶、氨基酸N-酰基转移酶和谷氨酸脱氢酶)的表达水平。结果表明,CUMS 会导致肝组织代谢轮廓和基因表达发生一系列改变,明确了柴胡疏肝散对其有明显的改善作用,因此阐明了CUMS 诱发的抑郁症与肝损伤之间的关系。Chen 等[8]利用核磁共振氢谱(1H-NMR)和LC-MS代谢组学技术发现,逍遥散可以改善CUMS 诱导的肝损伤,调节了该模型诱导的35 个肝脏生物标志物中的23 个;肝脏中谷氨酰胺和谷氨酸水平及谷氨酰胺合成酶(GS)和谷氨酰胺酶(GLS)活性的测定结果表明,谷氨酰胺和谷氨酸代谢通路可能是逍遥散抗抑郁和保肝作用的潜在靶标。因此,将肝脏作为研究对象来深入探索疏肝解郁方对抑郁症的作用机制具有一定意义。
柴胡-白芍药对作为疏肝解郁方的基础药对,两者配伍最早见于汉代的《伤寒论》中。柴胡辛散,疏肝泄热,其有效成分具有解热、抗炎、抗肝损伤及促进免疫系统功能等药理作用。白芍收敛,止痛柔肝,临床研究表明,白芍可用于平抑肝阳导致的头痛、眩晕、烦躁易怒等。二药配伍使用,一散一敛[9],符合中医理论中肝脏用药特性,故对于肝气不舒引发的抑郁,恰当地使用此药对,将有助于临床疗效的提高。
代谢组学是可以在特定时间和条件下对生物系统中的小分子代谢物进行全面分析的一种组学技术[10],通过考察生物机体受到疾病干扰后内源性代谢产物的整体变化,研究疾病及药物的作用机制。抑郁症与代谢紊乱密切相关,代谢组学研究为抑郁症代谢靶标的寻找提供了新的思路,包括潜在诊断指标[11-12]、疾病可能的生物标志物[13]和药物作用机制[14]研究等多个方面。本研究利用1H-NMR 代谢组学技术,考察柴胡-白芍药对对CUMS诱导的抑郁模型大鼠肝脏中紊乱的内源性代谢物的调节作用,分析柴胡-白芍药对配伍后抗抑郁的代谢途径,从而揭示该药对的抗抑郁作用机制。
1 材料
1.1 试药
柴胡(产地河北,批号:1708255131)、白芍(产地安徽,批号:1710436111)饮片购于山西省和仁堂中药饮片有限公司,经山西大学秦雪梅教授鉴定为伞形科植物柴胡Bupleurum chinenseDC.干燥根和毛莨科植物芍药Paeonia lactifloraPall.的干燥根。盐酸文拉法辛胶囊(批号:200101,成都倍特药业股份有限公司);蔗糖(天津市大茂化学试剂厂);重水(美国Norell公司)。
1.2 仪器
AR2140型分析天平(上海奥豪斯国际贸易有限公司);DHFSTPRP-24 型高通量组织研磨仪(宁波洛尚智能科技有限公司);SCIENTZ-12N 型真空冷冻干燥机(宁波新芝生物科技股份有限公司);TGL-16型离心机(湖南湘仪离心机仪器有限公司);600 MHz AVANCE Ⅲ型超导核磁共振波谱仪(瑞士Bruker公司)。
1.3 实验动物
SPF 级健康雄性SD 大鼠购于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006,体质量(190±10)g,饲养于室内温度为20~24 ℃、相对湿度为45%~55%、明暗交替周期12 h 环境中。动物实验获得山西大学伦理委员会的批准(批准号:SXULL2016036)。
2 方法
2.1 柴胡白芍合并液制备
参考前期实验提取过程[15],称取柴胡-白芍(1∶1)饮片,用8倍量70%乙醇浸泡1 h,加热回流2 h,提取2 次,合并提取液,静置滤过并进行浓缩,冷冻干燥成细粉,-20 ℃冰箱保存备用,给药前用蒸馏水超声溶解。
2.2 动物分组与给药
选择体质量及行为学指标结果相近的大鼠45只,随机分为5 组,每组9 只,分别为对照组、模型组、阳性药文拉法辛(0.035 g·kg-1)组及柴胡-白芍药对低、高剂量(CBL、CBH,以生药量计分别为15、30 g·kg-1)组,给药组按照10 mL·kg-1进行灌胃,从造模开始,每天给药1 次,给药28 d,对照组、模型组给予相同体积的蒸馏水。
2.3 CUMS抑郁模型的复制
大鼠适应7 d后,对照组大鼠正常饲养,不接受任何刺激,其余各组大鼠装入单笼喂养,并按照前期实验室建立的程序制备CUMS 模型(造模4 周,共28 d)。为了确保刺激因素的不可预测性,随机安排了每日刺激,且每个刺激因素都不应连续出现,发生的总数不应超过4次,该过程持续28 d[16],包括禁水、禁食(各24 h),热刺激10 min,超声刺激(60 W,3 h),足底电击(持续2 s,间隔10 s,共10次),冰水游泳(4 ℃,高50 cm、半径10 cm 玻璃容器),昼夜颠倒,束缚(3 h)[15]。
2.4 行为学测试
2.4.1 体质量检测 在开始造模前1 周及造模后的4周均进行大鼠体质量称量,共5次。
2.4.2 旷场实验 测试时间与称量大鼠体质量时间一致。实验装置由面积为100 cm2的黑色区域组成,四周是高40 cm 的黑色壁板。将大鼠置于区域中心,适应环境60 s,探索4 min,观察测试期间每只大鼠的穿越格数及直立次数(前肢离开地面10 mm,后肢保持不动为准)。每次测试后,用10%乙醇清洗旷场设备,以消除残留的气味[17]。
2.4.3 糖水偏爱实验 在造模开始前一天和造模的最后一天实行。在实验前二天,将大鼠单独饲养,提供2 瓶1%的蔗糖水使大鼠适应蔗糖溶液,第一天内保持原状,第二天用纯净水替换其中1 瓶蔗糖水。经过上述蔗糖偏爱率训练后,所有大鼠被剥夺食物和水12 h,然后自由选择饮用蔗糖水或水12 h。根据消耗量,按照公式(1)计算结果[17]。

2.4.4 强迫游泳实验 大鼠末次给药后,进行强迫游泳实验,测试前一天,将大鼠放入水深30 cm(25 ℃)的玻璃圆筒(直径20 cm、高50 cm)中,进行15 min 的预测试以消除水引起的急性压力。预测试24 h后,进行5 min的正式实验。不动时间从大鼠仅进行幅度较小动作且其头部保持水上时开始计算[17]。
2.5 肝组织样本的收集
末次给药结束后,麻醉大鼠,进行腹主动脉取血,快速收集肝组织暂存于液氮中,之后转移至-80 ℃冰箱保存。
2.6 代谢组学样品制备及测定
从每只大鼠的外侧叶收集肝组织约200 mg,加入甲醇600 μL、超纯水300 μL,在冰水浴中匀浆;15 000×g、4 ℃离心20 min,收集上清液,真空冷冻浓缩仪中吹干,复溶于D2O 磷酸盐缓冲液600 μL[0.2 mol·L-1Na2HPO4/NaH2PO4,pH=7.4,含0.010%三甲基硅烷丙酸钠盐(TSP)],涡旋混匀,15 000×g、4 ℃离心20 min后吸取上清液用于分析。
2.7 1H-NMR谱图数据处理与分析
所有NMR 光谱在Bruker 600-MHz AVANCE ⅢNMR 光谱仪上记录。1H-NMR 谱图采用CarrPurcell-Meiboom-Gill 脉冲序列,由64 次扫描组成;采样时间:2.654 2 s;弛豫延迟时间:1.0 s;采样间隔:41.5 s;频谱宽度:12 345.7 Hz;光谱数据点:65 536。
使用MestReNova 6.1.1 软件进行1H-NMR 图谱处理。对每张图谱进行相位和基线手动校正,并以TSP 的化学位移δ0.00 为标准,切除δ4.62~5.17的水峰,对δ0.75~8.56 的核磁图谱以0.01 为单位进行积分和总峰面积归一化,导出数据用于多元统计分析。
2.8 数据统计分析
采用SIMCA-P 13.0 进行主成分分析(PCA),观察样本整体分布,采用偏最小二乘法-判别分析(PLS-DA)和正交偏最小二乘法-判别分析(OPLSDA)进行各组样本趋势的比较,并对建立的模型进行排列检验,排列检验是对模型拟合度(R2)和预测能力(Q2)的计算。利用V-S-plot[变量重要性投影(VIP)>1]及t检验(P<0.05)筛选差异代谢物。HMDB 数据库(http://www.hmdb.ca)、BMRB 数据库(https://bmrb.io)等用于代谢物的鉴定,并使用MetaboAnalyst(https://www.metaboanalyst.ca)进行代谢通路分析。采用SPSS 25.0 软件进行统计分析,t检验比较两组之间的统计学差异,one-way ANOVA 和Bonferroni 事后检验比较更多组之间的显著差异。
3 结果
3.1 行为学测试
3.1.1 体质量 与对照组比较,模型组大鼠体质量明显降低(P<0.001),表明CUMS 抑郁模型造模成功;与模型组比较,文拉法辛组、CBL 组、CBH 组大鼠体质量均显著升高(P<0.01,P<0.001,图1)。结果显示,柴胡-白芍药对能有效逆转CUMS引起的大鼠体质量减轻。
3.1.2 旷场实验 与对照组比较,模型组大鼠穿越格数和直立次数都显著减少(P<0.001);与模型组比较,文拉法辛组、CBL 组、CBH 组大鼠穿越格数均显著增加(P<0.001,图1);文拉法辛组、CBL组、CBH组大鼠直立次数均显著增加(P<0.01,P<0.001,图1)。结果表明,柴胡-白芍药对能够显著改善抑郁大鼠的自主活动和探索能力。
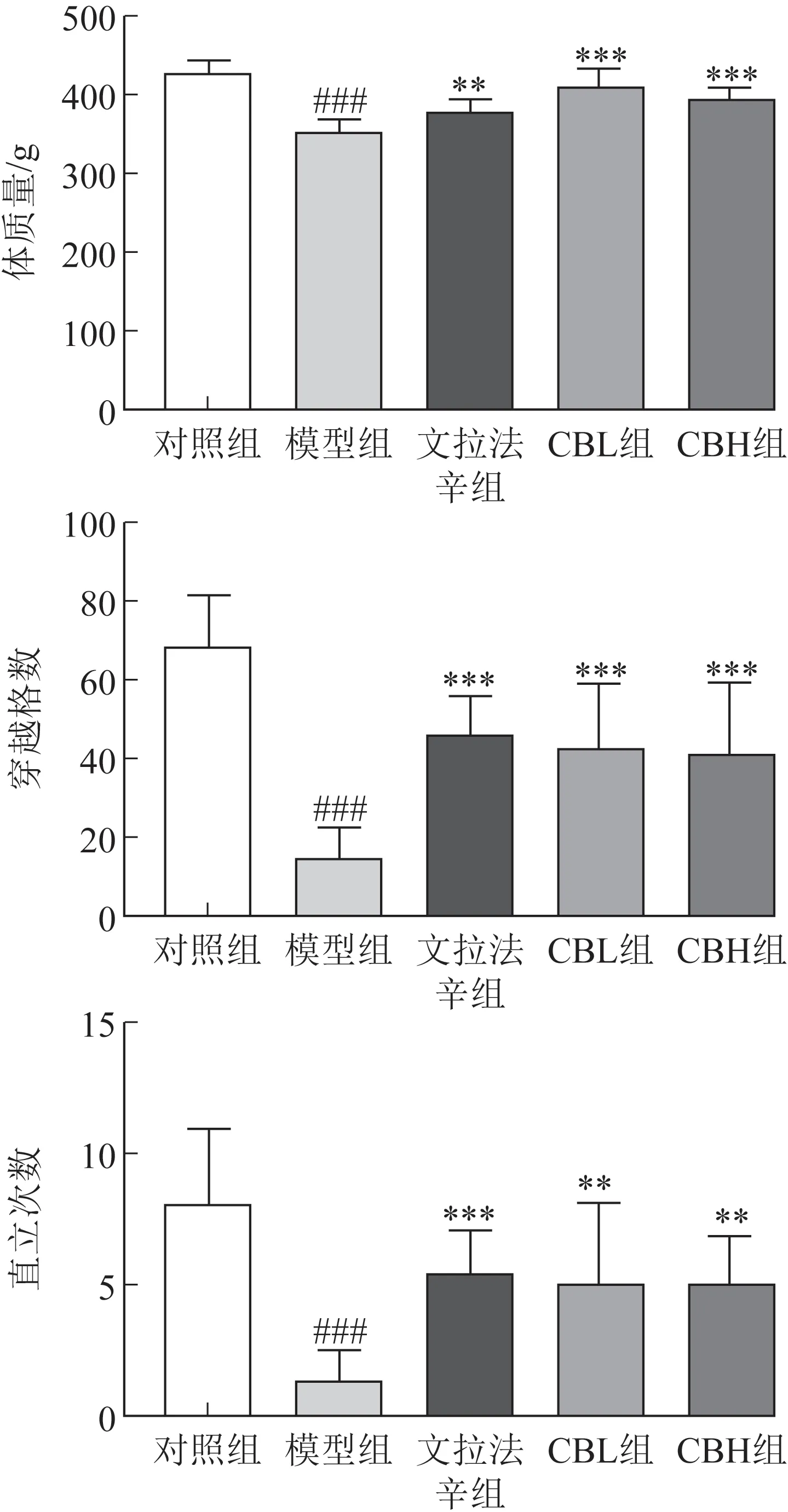
图1 柴胡-白芍药对CUMS诱导的抑郁大鼠行为学的影响(,n=9)
3.1.3 糖水偏爱实验 与对照组比较,模型组大鼠糖水偏爱率显著降低(P<0.001)。与模型组比较,文拉法辛组、CBL 组、CBH 组大鼠的糖水偏爱率均显著升高(P<0.001,图2)。结果表明,柴胡-白芍药对对于抑郁大鼠快感缺失的情况有显著的改善作用。
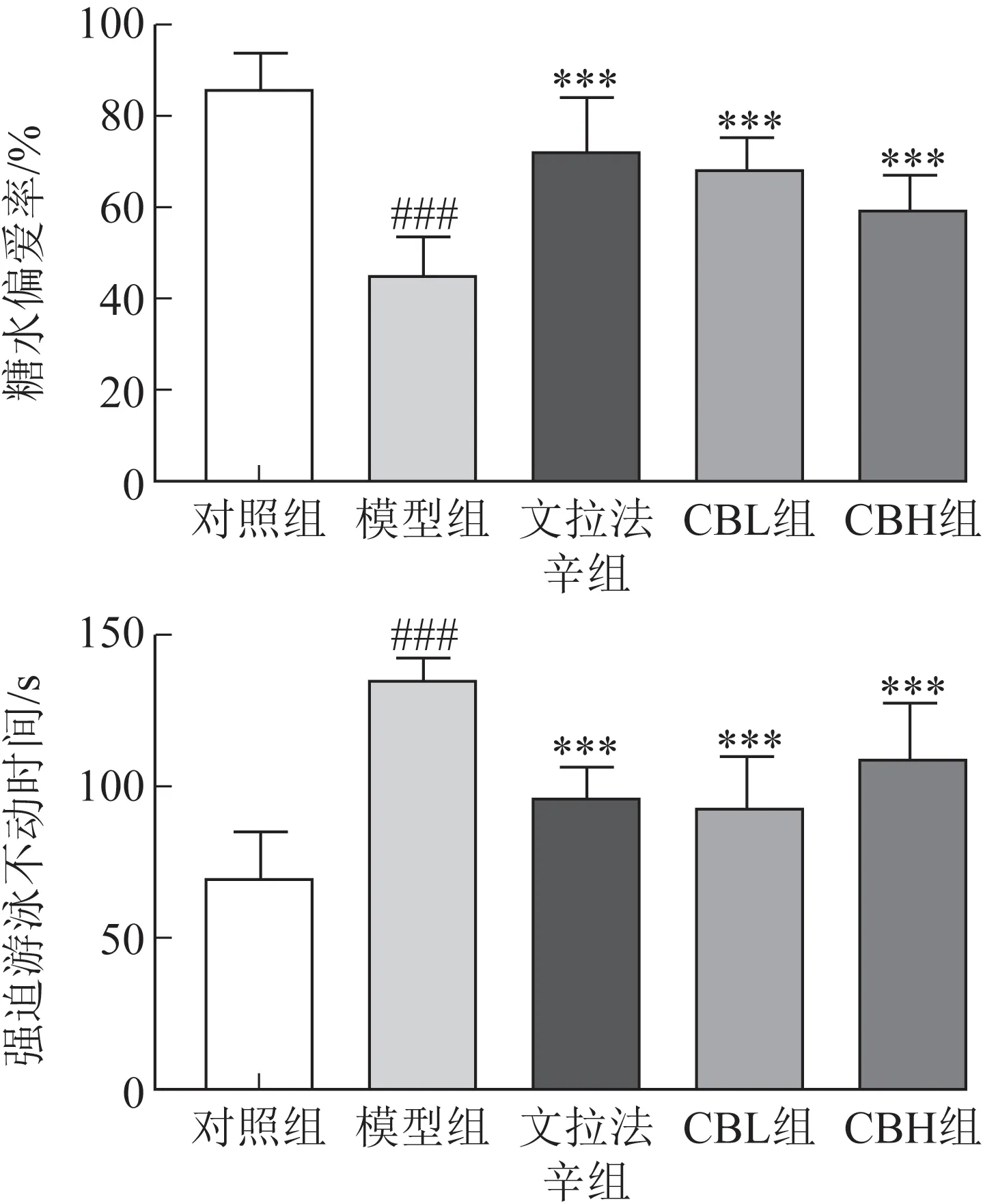
图2 柴胡-白芍药对CUMS诱导的抑郁大鼠糖水偏爱率和强迫游泳不动时间的影响(,n=9)
3.1.4 强迫游泳实验 与对照组比较,模型组大鼠强迫游泳不动时间显著增加(P<0.001)。与模型组比较,文拉法辛组、CBL 组、CBH 组大鼠的不动时间均显著减少(P<0.001,图2)。结果表明,柴胡-白芍药对能明显缓解抑郁模型大鼠的行为绝望。
3.2 1H-NMR代谢组学分析
3.2.1 代谢物鉴定 参照文献[15]报道和HMDB、BMRB 数据库对核磁图谱(图3)进行分析,共指认出42种内源性代谢物,结果见表1。
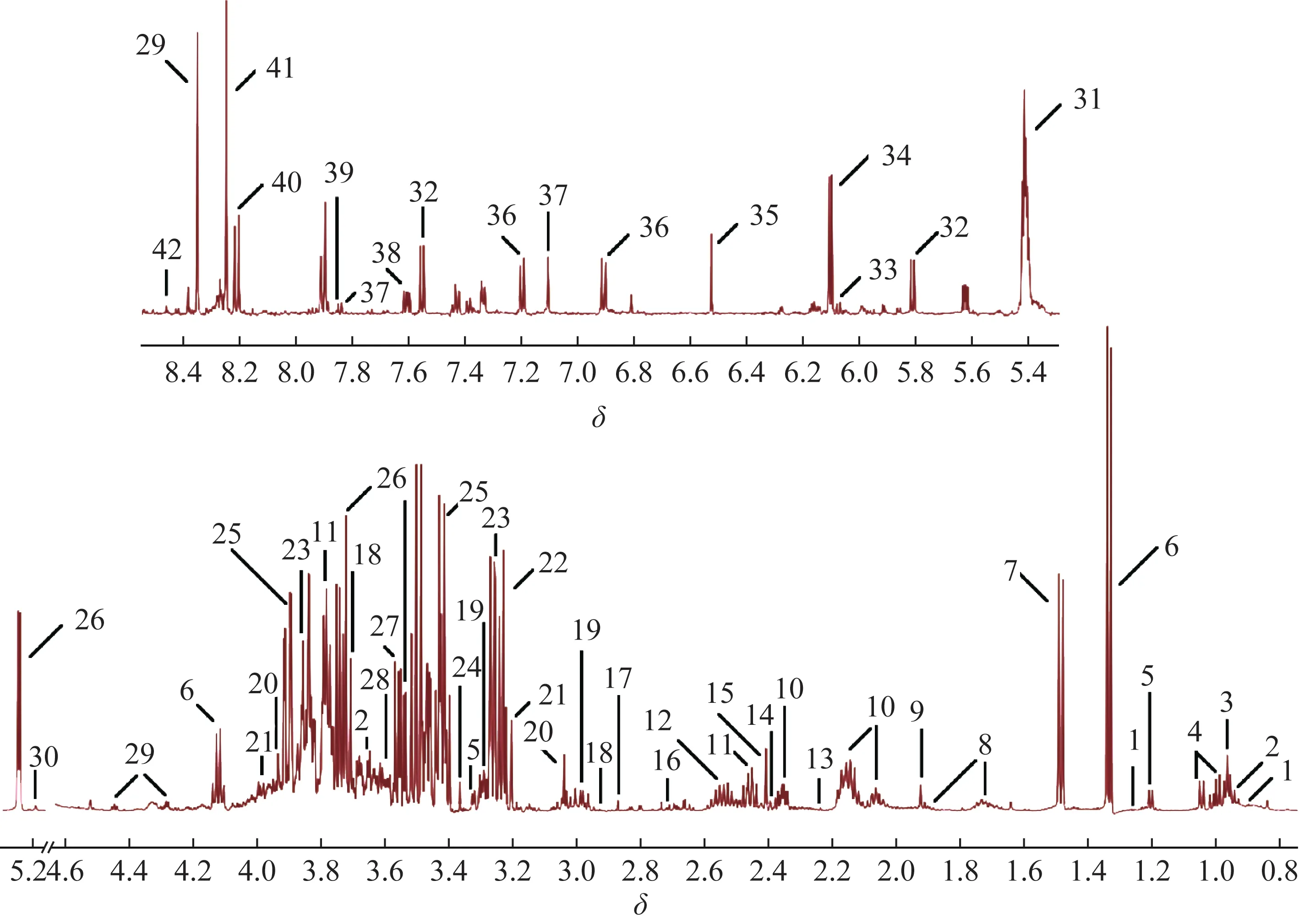
图3 对照组大鼠肝脏样本1H-NMR图谱

表1 大鼠肝脏样本1H-NMR数据归属

续表1
3.2.2 多元统计分析 无监督的PCA 结果显示,对照组和模型组能区分开(图4A);运用PLS-DA(图4B)验证CUMS 模型的可靠性,所有左侧数据点均低于右侧且相交于Y轴负半轴(R2X=0.741,R2Y=0.987,Q2=0.947),表明CUMS模型制备成功、可靠,不存在过度拟合现象。有监督的OPLS-DA 结果显示,对照组和模型组可明显分开(图4C),结合V-S-plot 图中VIP 值>1、P(corr)≥0.58 或≤-0.58及t检验(P<0.05)筛选对照组与模型组显著的差异变量。V-S-plot 图(图4D)中变量的重要程度由VIP 值的大小来衡量,变量离原点越远则VIP 值越大,变量的重要性也越大[15]。对对照组、模型组、文拉法辛组、CBL、CBH组进行OPLS-DA后也可以看出,各组间能清楚地分离(图4E),提示各给药组对筛选出的肝脏差异代谢物的调节程度不同。
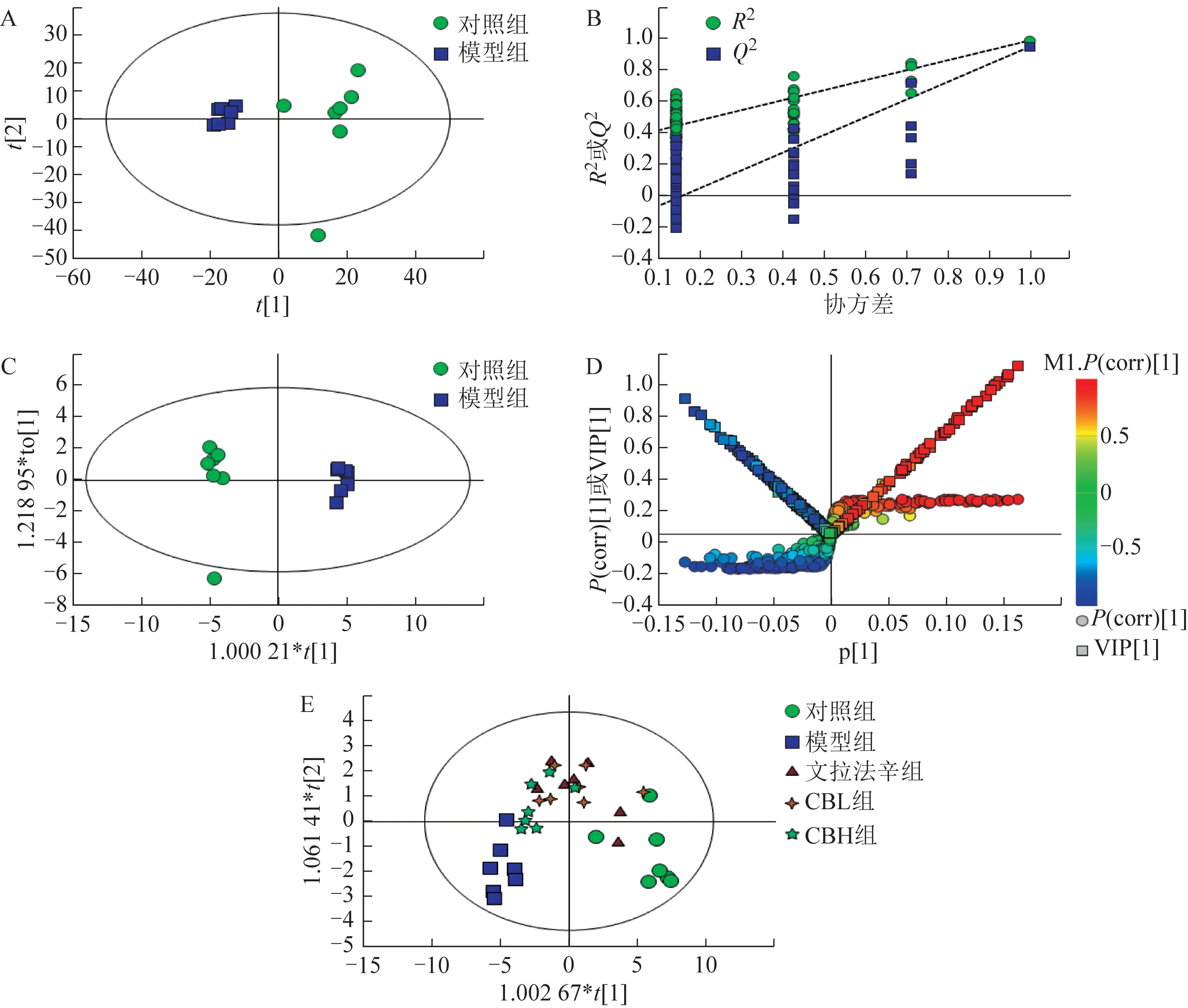
图4 各组大鼠肝脏样本代谢物多元统计分析
3.2.3 差异代谢物分析 OPLS-DA 筛选出对照组、模型组的24 个差异代谢物(图5~6)。与对照组比较,模型组大鼠肝脏中尿囊素、α-葡萄糖、β-葡萄糖、胆碱、甜菜碱、二甲基甘氨酸、甘油和氧化型谷胱甘肽8 个代谢物水平升高;醋酸盐、丙氨酸、肌酸、二甲胺、谷氨酸、谷氨酰胺、甘氨酸、次黄嘌呤、异亮氨酸、亮氨酸、低密度脂蛋白、赖氨酸、丙酮酸、酪氨酸、邻磷酸胆碱和缬氨酸16 个代谢物水平降低。与模型组比较,CBL 能显著回调其中除谷氨酰胺、甘氨酸和邻磷酸胆碱外的21个差异代谢物,而CBH能显著回调9个代谢物,包括尿囊素、甜菜碱、胆碱、二甲基甘氨酸、甘油、氧化型谷胱甘肽、亮氨酸、赖氨酸和酪氨酸。
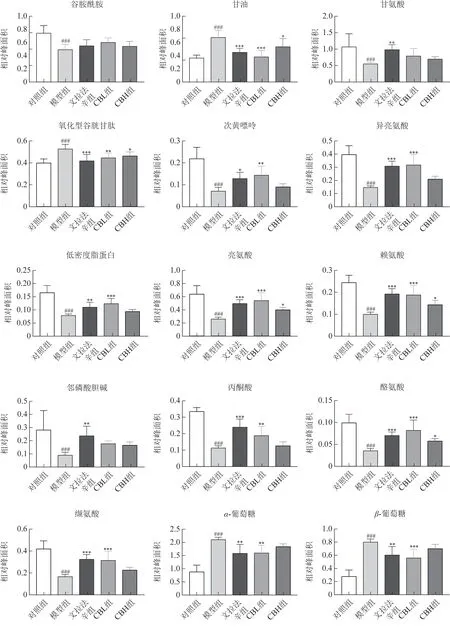
图5 柴胡-白芍药对对CUMS诱导的抑郁大鼠肝组织中代谢物的影响(,n=7)
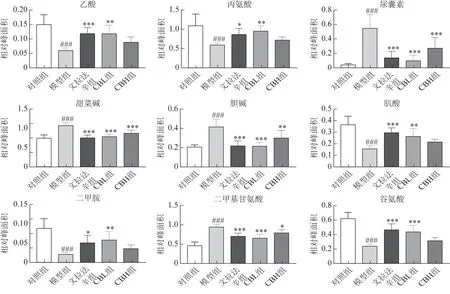
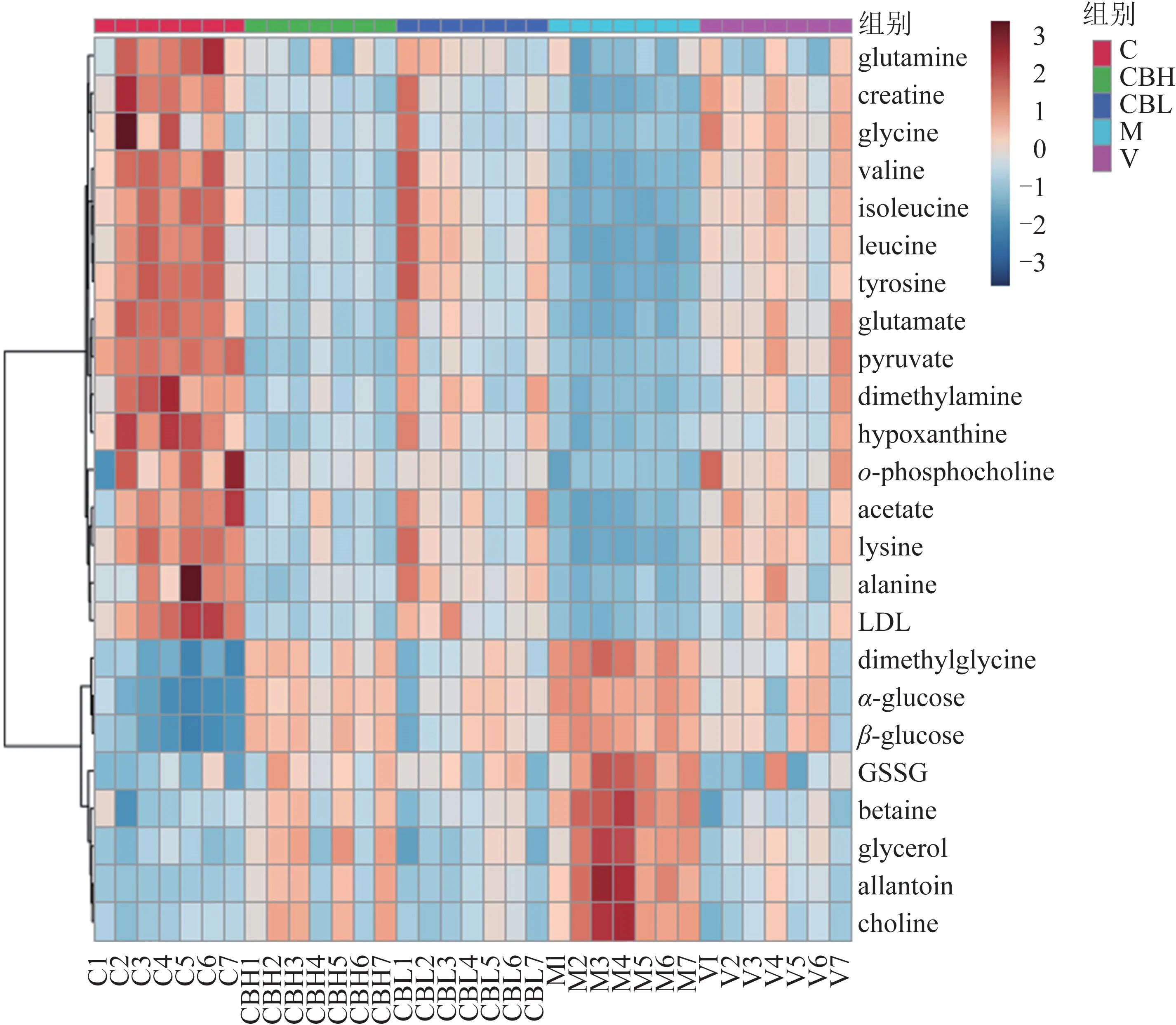
图6 各组大鼠肝组织差异代谢物聚类及热图分析
3.2.4 代谢通路分析 将1H-NMR 找到的与抑郁症相关的24个差异代谢物及柴胡-白芍配伍药对显著回调的21 个差异代谢物输入Metaboanalyst(https://www.metaboanalyst.ca)中进行代谢通路分析。根据代谢通路重要值(impact value)>0.1 及代谢通路富集水平-lgP>2 作为选择标准,共筛选出10 条代谢通路(图7A),在与抑郁相关的10条代谢通路中,柴胡-白芍药对能影响其中的7 条(图7B)。利用京都基因与基因组百科全书(KEGG)通路关联分析(图8)探讨生物标志物之间的相关性,可以更系统地体现柴胡-白芍药对对代谢物的调节情况。
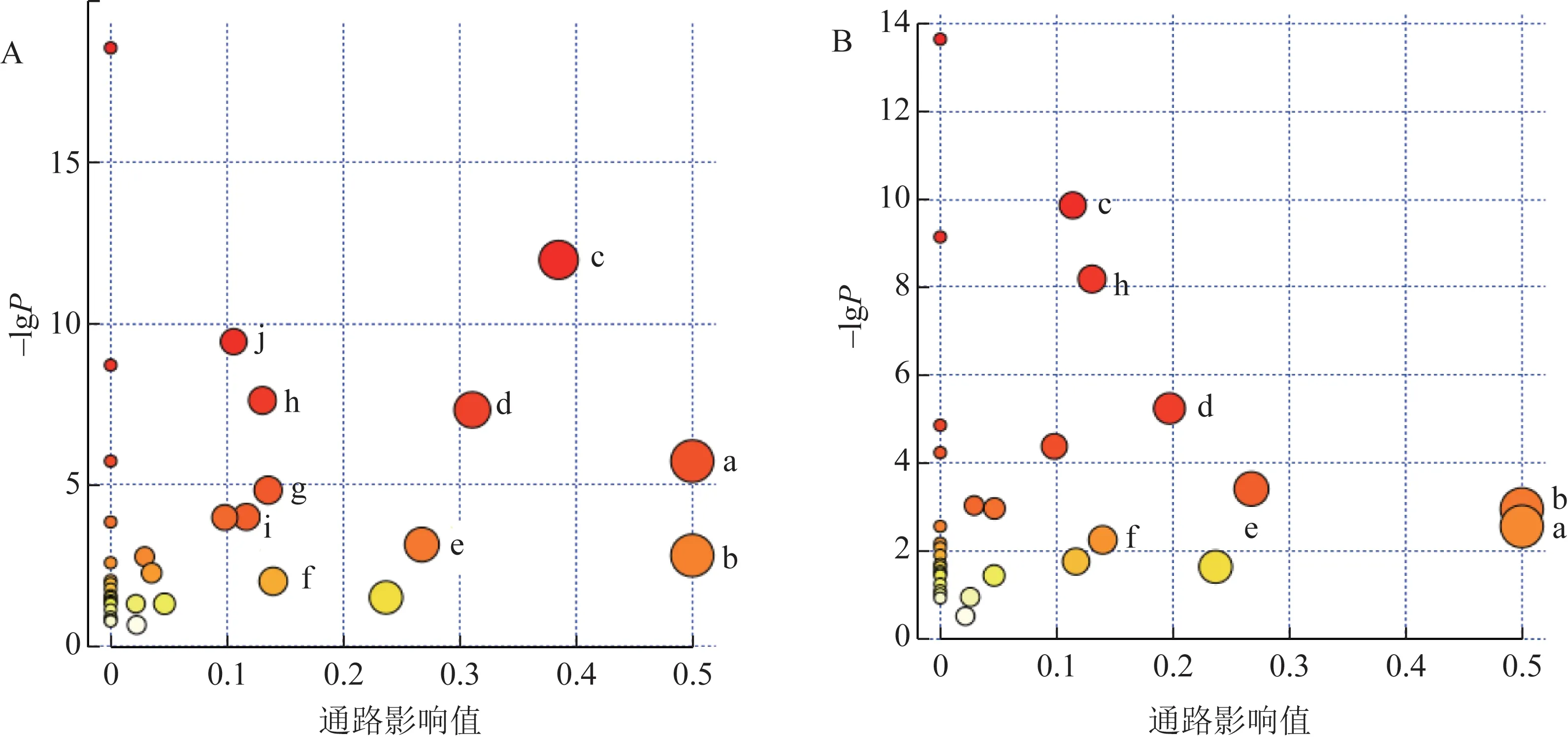
图7 柴胡-白芍药对对CUMS诱导的抑郁大鼠肝组织中代谢通路的影响
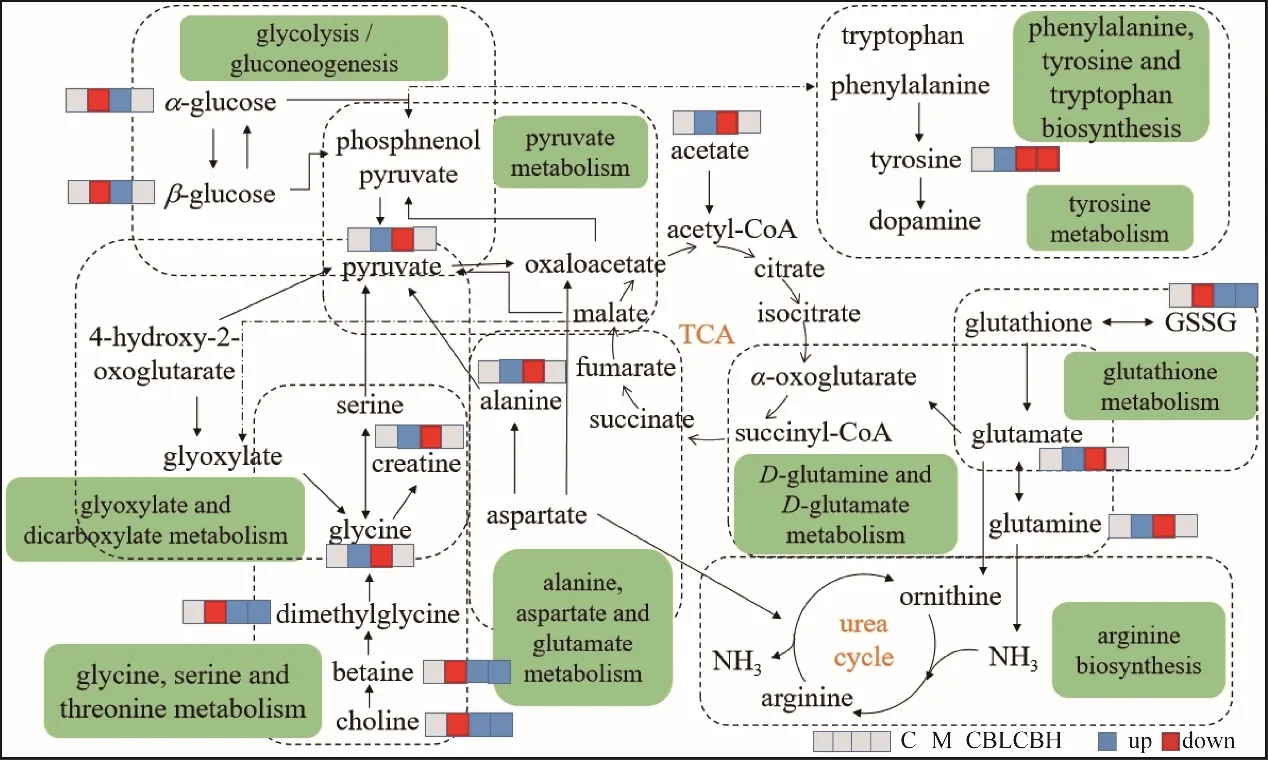
图8 抑郁症相关的10条代谢通路网络
4 讨论
柴胡-白芍药对应用于多个抗抑郁经典方剂中,最早可以追溯到东汉张仲景所著《伤寒论》中“四逆散”一方,方中以柴胡入肝胆经、升发阳气疏肝解郁为君药,又以白芍敛阴养血柔肝为臣药。二药配伍具有调节肝郁的作用,在中医临床史上应用悠久。二药前者功为解表退热、疏肝解郁、升举阳气,后者长于养血敛阴、柔肝止痛、平抑肝阳[18]。
本研究通过CUMS 建立抑郁大鼠模型,探讨柴胡-白芍药对“疏肝解郁”的代谢调控途径。利用大鼠体质量变化及其余4 种行为学指标评估柴胡-白芍药对的药效,同时通过核磁代谢组学找到抑郁模型大鼠体内发生紊乱的代谢物,分析药对对代谢轮廓的改善作用,阐述柴胡-白芍药对发挥抗抑郁的机制。运用代谢组学技术筛选出对照组与模型组大鼠肝脏中24 个差异代谢物。多元统计分析结果表明,CBL 干预后对差异代谢物的回调效果更好,能显著回调21个抑郁相关代谢物,因此,最终将CBL可回调的21 个代谢物用于进一步的通路分析。通过代谢通路富集分析,发现柴胡-白芍药对主要通过改善7条代谢通路发挥抗抑郁作用,分别是D-谷氨酰胺和D-谷氨酸代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成,丙酮酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,酪氨酸代谢,糖酵解或糖异生,甘氨酸、丝氨酸和苏氨酸的代谢[19]。
研究表明,谷氨酸与很多精神类疾病的发生有一定关系,炎症因子会促进神经胶质细胞大量合成谷氨酸并向突触间隙释放,谷氨酸激活N-甲基-D-天冬氨酸受体(NMDA),破坏神经突触完整性,造成神经细胞凋亡,最终导致抑郁[20]。本研究发现,CUMS 会引起大鼠肝组织中谷氨酸含量降低,造成与其相关的2 条代谢通路紊乱,而此现象在柴胡-白芍药对配伍给药后都有所改善,表明柴胡-白芍药对发挥抗抑郁作用可能与谷氨酸及其介导的通路有关。
芳香族氨基酸苯丙氨酸主要通过苯丙氨酸羟化酶转化为酪氨酸。酪氨酸可以由酪氨酸羟化酶代谢为二羟苯丙氨酸,然后代谢为多巴胺(DA)等儿茶酚胺类神经递质的前体。DA与抑郁症的发病机制密切相关,并且对认知过程具有调节作用[21]。因此,作为DA 的主要前体,酪氨酸和苯丙氨酸的中枢和外周浓度的变化也被认为与抑郁症的发病有关。本研究发现,CUMS 抑郁模型大鼠肝组织中酪氨酸水平降低,可能影响神经递质DA 的合成,进而影响抑郁症的发生。
糖酵解是将葡萄糖转化为丙酮酸的代谢过程,糖异生主要发生在肝脏中,本质上是糖酵解的逆向代谢。糖原是动物体内葡萄糖和主要碳水化合物储存形式的聚合物,提供了葡萄糖的替代来源。与对照组比较,模型组大鼠肝脏中葡萄糖水平升高,表明糖异生使糖原持续降解为葡萄糖[22]。差异代谢物的回调效果及通路分析结果表明,柴胡-白芍药对配伍后可改善CUMS 抑郁模型大鼠的丙酮酸代谢和糖酵解/糖异生。
综上所述,柴胡-白芍药对配伍后对CUMS 诱导的抑郁症大鼠肝脏代谢紊乱有明显的改善作用,其发挥抗抑郁作用的潜在机制涉及多条氨基酸代谢途径和能量代谢。

