浒苔光照和盐度胁迫响应基因UpMYB44 的克隆与表达分析*
何 渊 杨娟娟 沈颂东
(苏州大学基础医学与生物科学学院 苏州 215000)
非生物胁迫严重影响了植物的生长和发育, 面对不利的环境, 植物可以通过引发一系列的生理生化反应去适应这种不良影响(Huanget al, 2012)。MYB转录因子可以作为植物响应非生物胁迫的重要调控因子,已被广泛研究(Ambawatet al, 2013),MYB(V-myb avian myeloblastosis viral oncogene homolog)转录因子是植物中最大的转录因子家族之一, 存在于真核生物中, 广泛参与植物细胞分化、信号转导和次级代谢调控等多种生命活动, 特别在植物的转录调节中发挥着重要的作用(Mikamiet al, 2013)。根据MYB 蛋白含有的不同数量的结构域,MYB基因可以分为1R、R2R3、3R、4R 这四种类型(杜静静等, 2019)。尤其是R2R3-MYB类转录因子, 该类转录因子含有2 个MYB结构域, 参与调节植物在面对环境胁迫时的初级和次级代谢活动(Chenet al, 2019)。植物中最早发现MYB基因的是玉米体内的C-MYB, 该基因参与玉米的花青素合成过程(Maroccoet al, 1989), 在后续的研究中又陆续在多种植物中发现了MYB基因, 在棉花中发现了219 个基因(Baldoniet al, 2015), 在水稻中鉴定出183个MYB基因(Chenet al, 2006),GmMYB010参与了大豆抗虫的过程(陆捡花等, 2017)。
在环境胁迫响应方面, 对MYB基因也进行了相应的研究。比如在刚毛柽柳(Tamarix hispida)中对MYB基因家族在环境胁迫下的表达进行了差异分析(Zhanget al, 2018),TaMYB参与了拟南芥(Arabidopsis thaliana)对干旱环境胁迫的响应过程(Zhaoet al,2018), 植物中大部分的R2R3-MYB能够响应植物的盐胁迫从而提高其耐盐能力(张遵强等, 1998)。在诸多的环境因素中, 光照和盐度是影响藻类生命活动的重要环境因子(Heet al, 2017)。在光照方面, 高光照条件下会影响杜氏盐藻和雨生红球藻类胡萝卜素合成途径中关键基因的表达水平(Picket al, 2019), 光照强度同样对浒苔的生长状态有关键的影响(Liet al, 2012); 在盐度方面, 高盐度的培养会促进杜氏盐藻类胡萝卜素的合成(Shanget al, 2018), 盐度同样会影响浒苔的氮元素富集从而影响其增殖(Zhenget al, 2019)。
浒苔(Ulva prolifera)是一种常见的大型海洋绿藻,具有单层细胞围绕成的管状结构, 广泛分布于低潮区的滩涂、礁石和底泥之中(Fanet al, 2014)。浒苔具有细丝状易于漂浮的外观, 多样的繁殖方式以及能够抵御多种环境因子胁迫等生物学特征可以帮助浒苔承受多种环境压力, 例如高盐、干旱和强光照条件,且可以在较广的温度范围内存活, 是一种生命力很强的海藻(Xiaoet al, 2016)。从2007 年起, 我国的黄海海域每年都会暴发以浒苔为主的“绿潮”灾害, 据统计每年“绿潮”灾害所引发的生物量达到了数百万吨(Liuet al, 2015), 给沿海地区造成了巨大的经济损失和严重社会影响(Zhanget al, 2017; 王宗灵等, 2018;Zhaoet al, 2019a)。相对于MYB家族在高等植物中的生长发育、生理代谢、生物胁迫与非生物胁迫功能研究的大量研究成果, 人们对MYB家族转录因子在浒苔中的结构和功能研究较少。浒苔能够引发“绿潮”灾害和浒苔具有抵御夏季海面的极端环境的能力密切相关, 研究表明MYB家族的转录因子具有应答外界环境胁迫的能力(Duboset al, 2010), 因此我们推测MYB类转录因子在浒苔夏季抵御海面严酷的环境胁迫大量增殖的过程中起到了一定的作用。
本研究依据前期已经完成的浒苔光照和盐度胁迫下的转录组测序结果, 筛选出具有表达水平显著变化的MYB类基因MYB44, 将其命名为UpMYB44,进一步对其进行序列扩增、生物信息学分析、实时荧光定量PCR 分析等实验初步探究了该基因的表达模式和分子功能, 证明其在非生物胁迫例如盐度和光照的响应过程中发挥了重要的调控作用, 为今后深入研究UpMYB44 基因的功能奠定了坚实的基础。
1 材料与方法
1.1 实验材料
于2020 年7 月在山东省青岛市市南区栈桥潮间带(37.46°N, 121.71°E)采集浒苔配子体样品, 放入容器中带回苏州大学藻类实验室。用无菌水清洗藻体,除去表面的泥沙和其他杂物, 放置于光照培养箱培养。培养条件为f/2 培养基, 温度为20 °C, 光照强度为 90 μmol photons/(m2·s), 盐度为 24, 光周期为:L:D=12 h : 12 h。每3 d 换一次过滤海水, 预培养7 d。
1.2 光照和盐度胁迫处理
用三种不同光照培养浒苔 5 d, 18 μmol photons/(m2·s) 设 置 为 低 光 照 组(l), 90 μmol photons/(m2·s) 设 置 为 中 光 照 组(m), 216 μmol photons/(m2·s)设置为高光照组(h); 用三种不同盐度海水培养浒苔5 d, 低盐度组(L)设置为12, 中盐度组(M)设置为24, 高盐度组(H)设置为40, 培养密度为20 g/L, 温度为20 °C, 光周期为: L:D=12 h : 12 h, 1 d换一次过滤海水, 以上处理的每种样品均设置3 个生物学重复。
1.3 RNA 提取和cDNA 合成
参照(Heet al, 2018)的方法使用Takara 的总RNA提取试剂盒对三种不同光照和盐度处理的浒苔进行总RNA 的提取, 同时通过Thermo Fisher NanoDrop 2000 和琼脂糖凝胶电泳对所提取的RNA 的浓度和纯度进行检测, 使用Takara Reverse Transcription kit 将2 μg 检测合格的RNA 合成为cDNA 第1 链。
1.4 UpMYB44 基因的cDNA 全长克隆
根据实验室获得的浒苔光照和盐度胁迫下的转录组数据(GenBank: SRX4552126, SRX5502767)设计一对特异性引物UpMYB44F/R,UpMYB44F: ATGAC TTCCGAGGGGATGGAG,UpMYB44R: GACGAGCT GCTCGCGGTTAAA。以之前获得的cDNA 为模板,使用 2×HieffTMPCR Master Mix (Yeasen) 扩增UpMYB44的ORF 全长序列, 50 μL PCR 反应体系如下:2×HieffTMPCR Master Mix 25 μL, 上游引物和下游引物(10 μmol/L)各2 μL, cDNA 模板2 μL, 加19 μL 的ddH2O 补至50 μL。PCR 反应程序如下: 94 °C 预变性5 min, 94 °C 变性30 s, 55 °C 退火30 s, 72 °C 延伸1 min, 30 个循环, 72 °C 延伸10 min。取上述PCR 产物 10 μL 进行 1%琼脂糖凝胶电泳, 使用 Gel Extraction Kit (康为世纪)切取符合目的基因片段大小的条带进行回收。使用 Hieff Clone®Zero TOPOBlunt Cloning Kit (Yeasen)进行目的片段平末端扩增,将构建好的质粒接种于LB 固体培养基上过夜培养,第二天挑取阳性克隆测序, 获得UpMYB44基因ORF区全长序列。
1.5 UpMYB44 生物信息学分析
使用DNAMAN 软件对UpMYB44 进行氨基酸保守序列分析; 利用 Expays (https://web.Expasy.Org/protparam/)在线软件分析编码蛋白的大小、氨基酸数量和等电点; 使用 NCBI 的 CDD 数据库
(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)
对蛋白结构域进行预测; 利用 ProtScale 工具(http://web.Expasy.org/protscale/)对 UpMYB44 蛋白进行亲水性/疏水性分析; 采用 ExPaSy-SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线软件预测蛋白质的二级结构;利用 SWISS-MODEL (https://swissmodel.expasy.org/interactive) 对UpMYB44 蛋白3D 结构进行分析。
1.6 表达载体的构建及转化
参照Al-Muhanna 等(2018)的方法采用T4 连接酶将UpMYB44 目的片段与pET-32a 载体(反应体系包含0.1 pmol 目的片段, 0.03 pmol 载体片段, 3 U T4 DNA 连接酶, 1×T4 DNA 连接酶缓冲液)在16 °C 反应 12 h。采用热激法将连接产物转入大肠杆菌Trans-T1 感受态细胞。用双酶切进行(Nde I, Xba I)鉴定, 将阳性质粒送去苏州金唯智公司进行测序鉴定。
1.7 UpMYB44 的蛋白表达
参照 B a n e y x(1 9 9 9)的方法将 p E T-3 2 a+UpMYB44(+)1 μL 加入100 μL BL21(DE3)感受态细菌中, 置冰上20 min, 37 °C, 220 r/min 振摇1 h, 离心后全部涂布于含50 μg/mL Amp 的LB 平板, 37 °C 倒置培养过夜。挑取转化平板上的单克隆接种在含50 μg/mL Amp 的3 mL LB 液体培养基的培养管中,在220 r/min, 37 °C, 4 h 摇床里进行培养, 当分光光度计测量值显示其OD600(600 nm处的吸光值)≈ 0.6—0.8时, 滴入浓度为1.0 mmol/L IPTG, 37 °C 220 r/min 经过振摇4 h 诱导蛋白表达后取2 mL, 然后14 000 r/min离心, 弃去上清液, 采用PBS 来重悬沉淀, 加2×十二烷基硫酸钠(sodium dodecyl sulfate loading buffer,SDS)上样缓冲液混合均匀之后, 沸水煮沸10 min。然后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDSPAGE)超声破碎后收集上清, 用0.45 μm 滤膜过滤,用3 倍体积的平衡液[ 25 mmol /L Tris( pH 值 8.0),300 mmol/L NaCl, 10 mmol/L 咪唑] 平衡 His 纯化基质, 将过滤后的上清与His 纯化基质于50 mL 离心管中4 °C 混匀1 h。用洗涤缓冲液[25 mmol /L Tris ( pH值 8.0), 300 mmol/L NaCl, 30 mmol/L 咪唑] 冲洗4 次,用洗脱缓冲液[25 mmol/L Tris ( pH 值 8.0),300 mmol/L NaCl, 250 mmol/L 咪唑]洗脱3 次, SDSPAGE 电泳检测融合蛋白纯化效果。
1.8 UpMYB44 亚细胞定位
参照Xiong 等(2019)的方法设计亚细胞定位引物YFP-UpMYB44F/R, YFP-UpMYB44F: AAGAGA CAGGATCCGAATTCATGACTTCCGAGGGGATGGA G, YFP-UpMYB44R: ACCTCCGACCGGTGCACTA GTGACGAGCTGCTCGCGGTTAAA。将酶切位点BamH I 和Sac I 加入目的基因ORF 两端, 将测序成功的阳性质粒T-blunt-UpMYB44 为模板进行扩增和切胶回收。使用BamH I 和Sac I 对质粒pC131-YFP 进行双酶切, 产物纯化。将目的基因片段和载体pC131-YFP 进行连接转入大肠杆菌DH5α 感受态细胞,获得重组质粒 pC131-UpMYB44-YFP。将空载质粒pC131-YFP 和重组质粒pC131-UpMYB44-YFP 分别转入农杆菌GV3101 菌株中, 将阳性克隆放入含有50 μg/mL 卡那霉素和35 μg/mL 利福平的LB 培养基中进行培养, 放置于28 °C 摇床中以250 r/min 速度培养过夜, 收集并重悬菌体, 当菌体浓度的OD600值在0.5—1.0 之间, 静置3 h 后注射入烟草叶片中, 注射后的烟草放置于28 °C 培养箱中培养2 d。用激光共聚焦显微镜观察侵染的烟草叶片, 进行UpMYB44蛋白亚细胞观察。
1.9 实时荧光定量PCR
参照He 等(2019)的方法设计实时荧光定量PCR并以不同光照和盐度处理的浒苔cDNA 为模板进行实时荧光定量PCR 实验, 荧光定量PCR 采用 Hieff®qRT-PCR SYBR Green Master Mix (Yeasen)试剂, 使用ASA-4800 Real-Time PCR 仪器(百源基因)进行反应, 以18S rDNA为内参基因, 具体引物序列如表1所示, 上述实验重复3 次。结果分析采用 2-ΔΔCT法进行相对定量, 采用软件Origin 8.0 对表达结果进行单因素方差统计(ANOVA)。数据使用 SPSS 21.0 进行统计分析,P< 0.05 设定为显著性差异,P< 0.01 设定为极显著性差异。

表1 实时荧光定量PCR 所用引物Tab.1 Primers used for quantitative real-time PCR
1.10 UpMYB44 和UpCPP5 互作验证
参照Cai 等(2016)的方法制备Y2H Gold 酵母感受态细胞, 将UpCPP5 作为诱饵构建PGBKT7-CPP5重组质粒进行毒性检测和自激活检测: 于100 °C 沸水煮carrier DNA 5 min, 立即置于冰上2 min, 如此重复一次, 取1.5 mL 无菌EP 管, 配制转化体系, 50 μL感受态细胞+5 μL carrier DNA+100 ηg 诱饵质粒+100 ηg 猎物空载, 加入500 μL PEG/LiAc (8 mL 50%PEG+1 mL LiAc+1 mL TE), 30 °C 水浴30 min, 加入20 μL DMSO, 42 °C 水浴15 min, 800 ×g离心1 min,去上清, 加入800 μL YPDA 重悬, 30 °C, 150 r/min,振荡培养1.5 h, 800 ×g离心5 min, 弃上清, 加入1 mL 0.9% NaCl 重悬, 取150 μL 涂平板, 30 °C 倒置培养 4 d, 观察菌落直径及颜色; 构建 PGADT7-MYB44 重组质粒作为猎物进行诱饵和猎物的共转化,依次从自激活、共转化实验组和共转化阴阳性对照组涂布的平板 DDO 上挑单菌落, 分别接种于 5 mL DDO 液体培养基, 30 °C 250 r/min 培养16 h, 取300 μL 菌液于50 mL DDO 中, 30 °C 250 r/min 培养8—12 h 至OD600值为0.4—0.6; 各取10 μL 菌液点种到平板DDO、TDO/3AT (15 mmol/L)、QDO 上, 30 °C培养箱培养3 d, 观察菌斑生长情况, 若涂布在平板DDO 上长菌则共转化成功, 在平板 TDO/3AT(15 mmol/L)上长菌而在QDO 上不长菌为阳性结果,在平板TDO/3AT (15mmol/L)上不长菌为阴性结果。
2 结果
2.1 UpMYB44 ORF 区全长序列的克隆与序列分析
利用RT-PCR 以浒苔cDNA 为模板, PCR 扩增相应片段, 测序得到UpMYB44的ORF 区全长序列, 序列全长为1 437 bp, 共编码478 个氨基酸。序列上传至Genbank 数据库, 登录号为MW174238。
2.2 UpMYB44 生物信息学分析结果
通过 NCBI 与其他物种的 MYB 蛋白进行BLASTn 比对, 结果显示UpMYB44 蛋白与另一种绿藻小球藻的MYB44 蛋白有较高的同源性, 氨基酸的一致性为50.00%, 与高等植物番木瓜、荷花、木槿、牵牛花、柿树和向日葵的氨基酸相似率也在45.00%—50.00%之间, 用DNAMAN 将UpMYB44 氨基酸序列与上述物种进行比对, 发现了较为保守的序列区域(图1), 推测与这些MYB 类转录因子有相似的生物学功能。利用Expays 在线网站预测结果显示UpMYB44 蛋白含有 478 个氨基酸, 分子量为52.49 kDa, 等电点为6.15; 利用CDD 数据库分析显示 UpMYB44 含有两个 SANT 结构域, 是典型的R2R3-MYB(图2); 利用ProtScale 工具对UpMYB44蛋白进行亲水性/疏水性分析, 结果显示UpMYB44为亲水性蛋白; 在SOPMA 在线网站预测蛋白二级结构, UpMYB44 蛋白二级结构中含有42.68%的α-螺旋结构、8.16%的延伸连结构、9.62%的β-转角结构、39.54%的无规则卷曲结构(图3)。利用Swiss-model网站对UpMYB44 蛋白进行3D 结构预测, 发现与其蛋白二级结构结果类似, 具有较多的α-螺旋结构和无规则卷曲结构(图4)。
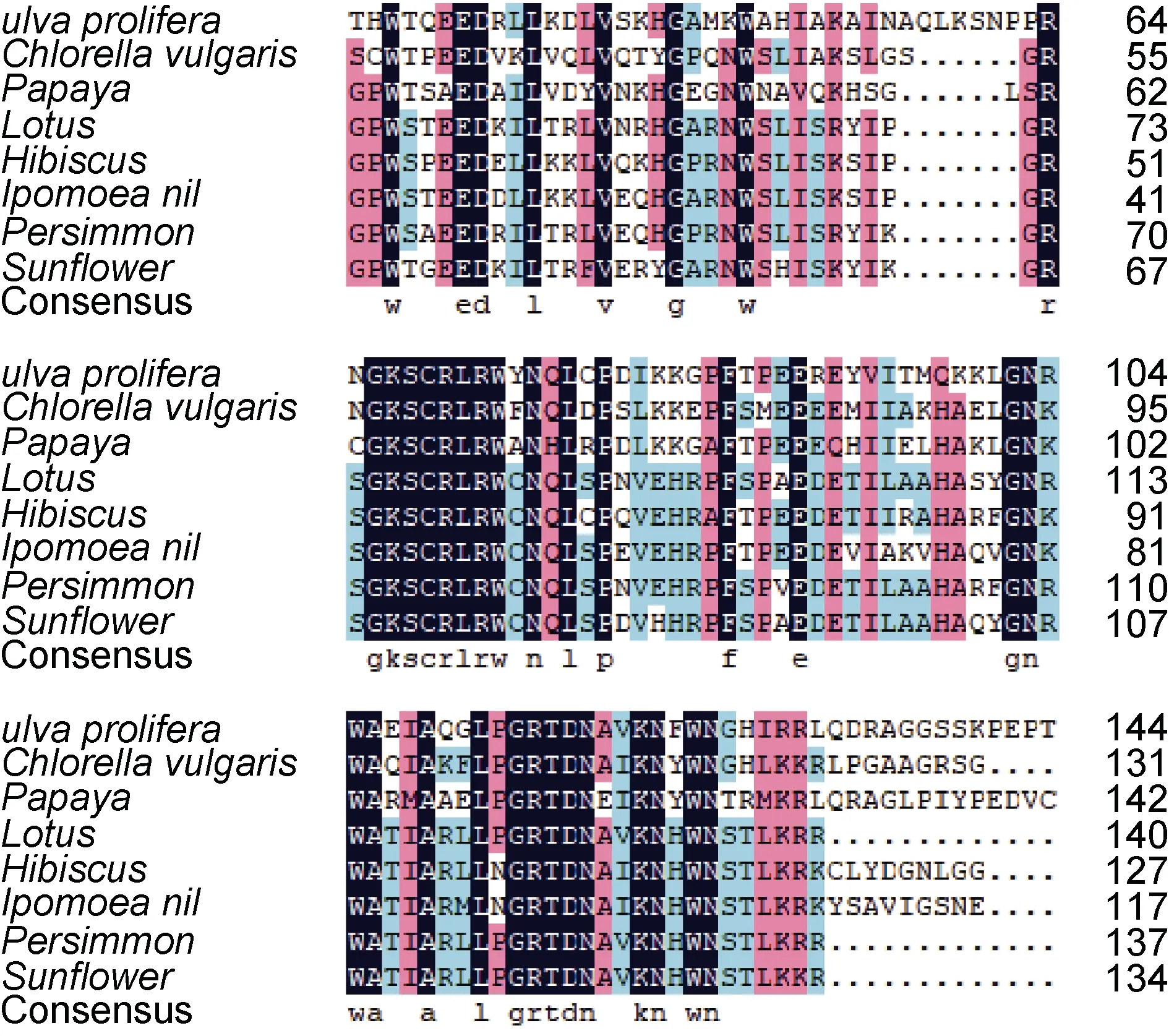
图1 UpMYB44 与其他物种MYB 类转录因子氨基酸序列的多重比对Fig.1 Multiple alignment of the amino acid sequence of UpMYB44 and MYB transcription factors from other species

图2 UpMYB44 蛋白保守结构域预测Fig.2 Prediction of conservative domain of UpMYB44 protein

图3 UpMYB44 二级结构预测Fig.3 Prediction of secondary structure of UpMYB44
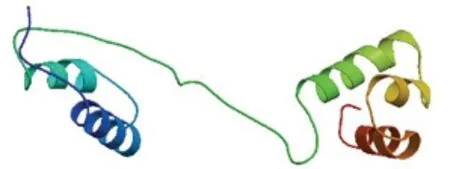
图4 UpMYB44 蛋白三维结构预测模型Fig.4 Predicted 3D structure model of UpMYB44 protein
2.3 pET-32a+UpMYB44 融合蛋白的可溶性分析和纯化
结果表明, UpMYB44 融合蛋白主要以可溶性蛋白的形式存在于上清中, 但是在包涵体沉淀中也有一定量的表达(图5)。选择上清中可溶性蛋白进行后续蛋白纯化实验, 通过4 次洗涤和3 次洗脱, 获得了大小约为65 kD (含标签)的纯度较好的UpMYB44 融合蛋白(图6)。
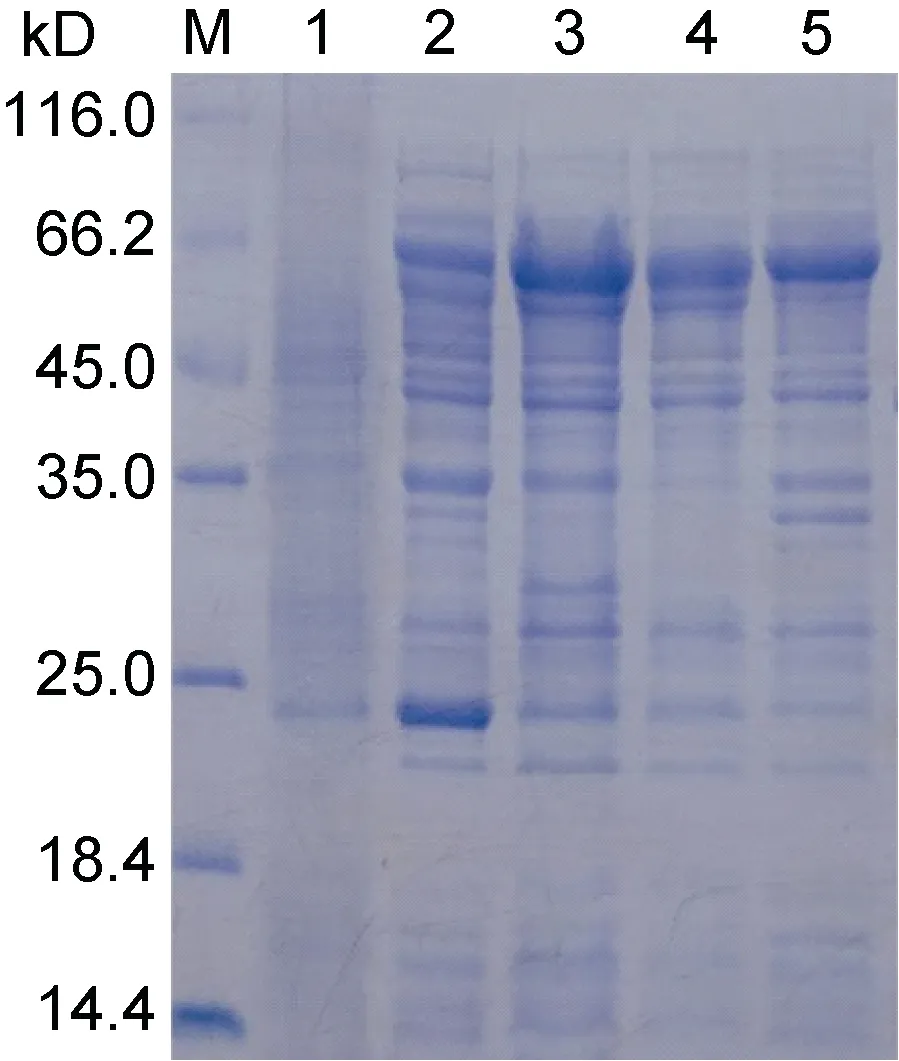
图5 UpMYB44 蛋白表达鉴定SDS-PAGE 分析Fig.5 Identification of UpMYB44 protein expression by SDS-PAGE analysis
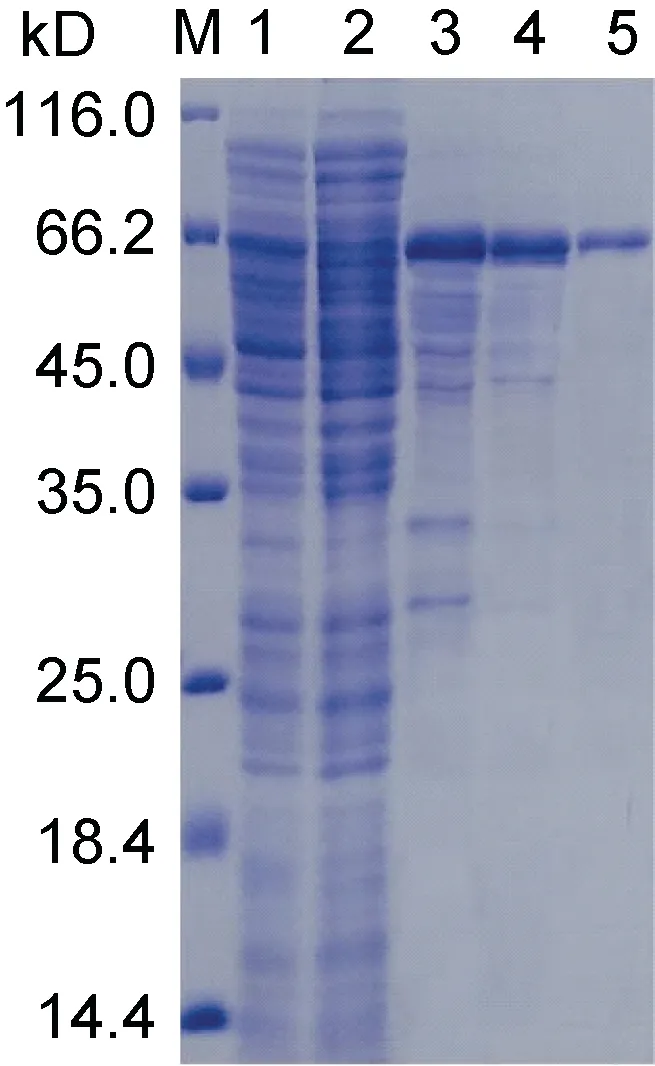
图6 UpMYB44 蛋白纯化SDS-PAGE 分析Fig.6 Purification of UpMYB44 protein by SDS-PAGE analysis
2.4 UpMYB44 蛋白的定位
在对照组空载pC131-YFP 中, 黄色荧光在细胞膜、细胞核和细胞质中都有分布, 而融合表达载体pC131-UpMYB44-YFP 的细胞中, 黄色荧光仅在细胞核中被发现, 而在细胞膜和细胞质中都没有荧光发现, 并且黄色荧光和核定位的marker 蛋白的红色荧光发生重合。结果显示UpMYB44 蛋白仅定位在细胞核上, 这一点符合MYB 类转录因子的特点(图7)。

图7 UpMYB44 蛋白的亚细胞定位Fig.7 Subcellular localization of the UpMYB44 protein
2.5 UpMYB44 在不同光照和盐度处理下的表达模式分析
UpMYB44在三种不同光照和盐度处理下的表达量发生了显著变化, 在光照组中, 18 μmol photons/(m2·s)处理的低光组中UpMYB44的表达量最高, 随着光照强度的增加,UpMYB44的表达量逐渐降低( 图 8),UpMYB44的 表 达 量 在 216 μmol photons/(m2·s)处理的高光组中最低; 在盐度组中, 随着盐度的增加,UpMYB44的表达量逐渐升高,UpMYB44的表达量在盐度40 处理的高盐组中最高,在盐度12 处理的低盐组中最低(图9)。
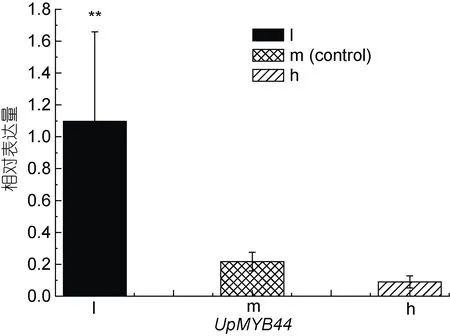
图8 UpMYB44 在三种光照强度条件下的表达分析Fig.8 Expression analysis of UpMYB44 under three lights stresses

图9 UpMYB44 在三种盐度强度条件下的表达分析Fig.9 Expression analysis of UpMYB44 under three salinities stresses
2.6 UpMYB44 和UpCPP5 蛋白存在互作关系
MYB 类转录因子通常需要与其他蛋白互作进行发挥其功能。利用STRING 在线网站预测UpMYB44的互作蛋白, 根据生物信息学预测结果发现UpMYB44 和另一种调控植物生长发育和响应非生物胁迫中起重要作用的转录因子UpCPP 存在互作关系,以缺失蛋白UpCPP5 为诱饵, 通过酵母双杂交点对点验证, 结果表明重组诱饵质粒PGBKT7-CPP5 对酵母细胞无毒性且3-氨基-1,2,4 三唑(3AT, 15mmol/L)能抑制激活Y2H Gold 酵母报告基因, 酵母双杂交的结果显示, 将猎物质粒 PGADT7-MYB44 与诱饵质粒PGBKT7-CPP5 共转化酵母细胞: 对照结果符合预期,说明该系统可用于双杂交验证; 实验组涂布DDO 平板能生长说明诱饵和猎物共转化成功, 涂布TDO/3AT (15mmol/L)板能生长, QDO 平板不长, 说明激活报告基因HIS3 的表达, 说明UpMYB44 蛋白和UpCPP5 蛋白之间存在相互作用(图10)。

图10 UpMYB44 与UpCPP5 互作蛋白验证Fig.10 Verification of UpMYB44 interacting with UpCPP5
3 讨论
研究发现在植物中MYB类转录因子参与了多种生物和非生物胁迫的响应过程(Leaet al, 2007)。超表达玉米中的ZmMYB3R可以增加其对干旱和盐度的耐受性(Yinet al, 2017), 过量表达烟草的NtMYB15可以促进其适应低温胁迫(Wuet al, 2019), 在模式生物拟南芥中超表达AtMYB74同样具有增强其盐耐受性的功能(Xuet al, 2015), 而且MYB 类转录因子常常需要与其他蛋白互作来发挥功能(Kasparet al, 1999)。
本研究以受关注度较高的引发“绿潮”灾害的浒苔为研究对象, 初步分析了MYB类家族成员UpMYB44的生物学功能。结果表明UpMYB44有两个MYB结构域, 属于典型的R2R3-MYB 转录因子, 研究表明该类转录因子参与了棉花和月季对高盐胁迫的响应(Zhaoet al, 2019b, 包颖等, 2020)。盐度和光照是影响藻类正常生长和生理生化指标的重要的两个环境因子(Araiet al, 1991), 特别是对浒苔而言, 盐度和光照的改变会引起其氧化应激反应(Luoet al,2011), 以及影响其体内的总类胡萝卜素含量(Heet al,2020)。在本研究中,UpMYB44在高盐条件下的表达量发生了显著提高, 说明该转录因子参与了浒苔的对高盐胁迫的响应过程, 可能对提高浒苔适应恶劣的外界环境的能力有一定帮助, 最终有利于其快速增殖。R2R3-MYB转录因子也会对光照的改变作出响应, 在早期的研究中发现红色紫苏中存在一种光诱导的Myb-p1基因, 其在花青素的形成过程中起到了决定性作用(Gonget al, 1999), 在马铃薯中发现的StR2R3-MYB1就是一种光响应MYB类转录因子, 基于对光处理后基因表达特性分析的结果表明该转录因子可能受到光信号和环境胁迫的诱导(秦玉芝等,2015)。在浒苔中UpMYB44的表达量同样受到了不同光照强度的影响, 且随着光照的逐渐增强其表达量呈下降趋势, 这和一般应激反应的表现有差异, 推测夏季浒苔在漂浮状态下的高光照强度胁迫会影响其正常的生长状态, 导致部分基因的表达出现下调, 说明过高的光强对其增殖反而不利。UpMYB44基因在浒苔受到光照和盐度胁迫时会发生响应, 对夏季抵御海面严酷的环境胁迫起到一定作用。对MYB类转录因子互作模式的研究也已经开展, 比如在苹果中MdMYB23 蛋白通过结合MdBT2 蛋白来抑制原花色素的积累(Anet al, 2018), 通过鉴定与AtMAPK3P 相互作用的MYB 转录因子成员, 增强了我们对拟南芥中MAPK 相互作用蛋白网络的认识, 也证实了蛋白质与蛋白质的相互作用对于生物过程至关重要(Giriet al, 2014)。
在本研究中, 通过酵母双杂交系统证明了UpMYB44 蛋白和一种CPP 蛋白具有互作, 通过和Genbank 中的序列进行比对, 我们将其命名为UpCPP5。CPP 蛋白又称为tesmin/TSO1-like 蛋白, 在植物中广泛分布, 该家族在植物生长发育和细胞分裂控制中起重要作用(Yanget al, 2008), TSO1 参与了拟南芥花发育的细胞分裂过程(Liuet al, 1997), 如果该基因轻度的突变会影响拟南芥胚珠发育, 而强突变对所有花卉组织都有影响(Andersenet al, 2007),因此, 猜测这两类转录因子的相互作用影响了浒苔的细胞分裂过程, 这个研究方向正好和目前浒苔如何引发“绿潮”灾害的研究热点相互关联。本实验的研究材料浒苔是一种能够快速生长的灾害绿藻, 只要外界条件合适, 其生长速率相当惊人(Hiraokaet al,2008), 每年夏季由于其暴发性生长对我国沿海城市造成了巨大的环境污染(Yuet al, 2017; Heet al, 2019),对近海的生态系统也造成了严重的破坏(Quet al,2020)。根据之前浒苔基因组的研究, 我们推测浒苔的快速生长和细胞的快速分裂密切相关, 但是浒苔增殖最终重要的是营养增殖, 因此后续可以通过深入研究浒苔中MYB 家族和CPP 家族的互作是否会影响浒苔的生长发育和细胞分裂, 并结合浒苔营养增殖方面的研究为进一步了解环境胁迫调控网络提供依据, 更重要的是为研究浒苔的快速繁殖机制提供了全新的思路。
4 结论
本研究在本实验室已有的研究基础上, 克隆了1个R2R3-MYB转录因子基因——UpMYB44的ORF 区全长序列, 其氨基酸序列与GenBank 中已有的小球藻MYB 蛋白具有相似性, 我们对其进行了生物学功能验证, 在异于浒苔最适环境的光照和盐度的培养条件下,UpMYB44的表达量会发生显著变化, 证明其参与了浒苔响应光照和盐度压力的过程, 可能在盐度和光照压力应答中具有关键作用。实验证明UpMYB44 与CPP 类转录因子UpCPP5 存在较强的互作, 推测二者的结合可能参与了浒苔的生长发育和细胞分裂过程, 但其具体的作用机制还需要进一步研究。
——一道江苏高考题的奥秘解读和拓展

