烟芽夜蛾囊泡病毒3h株3h-38基因原核表达及转录、表达时相分析
曹生凯,何 磊,黎 妮,王 星*,于 欢*
(1.湖南农业大学植物保护学院,长沙 410128;2.湖南农业大学植物病虫害生物学与防治湖南省重点实验室,长沙 410128)
囊泡病毒是一种环状双链DNA昆虫病毒,因其在感毒感染的昆虫血淋巴内形成包裹着许多病毒粒子的大型囊泡而得名(Federici & Govindarajan, 1990; Asgarietal., 2007)。囊泡病毒的病毒粒子呈棒状、囊状或卵圆形,长度约为200~400 nm,直径约为130 nm(Federicietal., 1990; Asgraietal., 2017)。它们在鳞翅目宿主之间传播的方式主要通过膜翅目寄生蜂的产卵行为机械传播(Govindarajanetal., 1990)。宿主感病之后表现出明显的急致病性、慢致死性的症状,被感染后的幼虫食量急剧减少,生长发育缓慢,且无明显的暴食期(Carneretal., 1983; Lietal., 2013; Huetal., 2016; 刘航等, 2020)。囊泡病毒感染所致的最为典型的症状为宿主幼虫的血淋巴颜色会由澄清变为浑浊的奶白色(Govindarajanetal., 1990; Bideshietal., 2006; Huangetal., 2012a)。根据国际病毒分类委员会(International Committee on Taxonomy of Viruses, ICTV)的报道,囊泡病毒包含两个属:分别是囊泡病毒属Ascovirus和图尔病毒属Toursvirus;其中囊泡病毒属包括草地贪夜蛾囊泡病毒1(Spodopterafrugiperdaascovirus1, SfAV-1)、粉纹夜蛾囊泡病毒6(Trichoplusianiascovirus6, TnAV-6)和烟芽夜蛾囊泡病毒3(Heliothisvirescensascovirus3, HvAV-3);图尔病毒属主要包括双美缘姬蜂图尔病毒1(Diadromuspuchellustoursvirus1, DpTV-1)和枣瘿蚊图尔病毒2(Dasineurajujubifoliatoursvirus2, DjTV-2)(Asgraietal., 2017; Wangetal., 2020)。
烟芽夜蛾囊泡病毒3h株(Heliothisvirescensascovirus3h, HvAV-3h)于2012年由本实验室分离获得,并在2017年完成了全基因组测序,基因组全长190 519 bp,G+C含量为45.5%,预测编码185个开放阅读框(Open Reading Frame, ORF),主要对斜纹夜蛾Spodopteralitura(Fabricius)、棉铃虫Helicoverpaarmigera(Hübner)、甜菜夜蛾Spodopteraexigua(Hübner)等具有高致病性(Huangetal., 2012; Huangetal., 2017)。在细胞水平上,囊泡病毒的感染过程是类似细胞凋亡(Apotopsis-like)的病理反应,即宿主细胞会随着囊泡病毒的感染和复制,出现类似细胞凋亡的形态特征,当细胞进入感染后期,大量含有病毒粒子的囊泡会随着类凋亡小体的形成被释放到血淋巴中(Bideshietal., 2005; Bideshietal., 2006)。这种在细胞水平上囊泡病毒所展现出来的特殊的致病现象提示囊泡病毒具有特殊的致病机制,同时也敦促着我们对囊泡病毒基因功能进行更深入的研究,从而为囊泡病毒特殊致病性和致病历程的探明奠定基础。
本研究针对HvAV-3h的一个基因(3h-38)进行了初步的功能分析,通过制备的特异性多克隆抗体对其在HvAV-3h感染甜菜夜蛾后的转录和表达时相进行了检测。获得的结果为进一步深入研究3H-38在病毒侵染中的具体功能奠定了基础。
1 材料和方法
1.1 昆虫饲养和HvAV-3h扩繁
甜菜夜蛾幼虫由本实验室采用人工饲料饲喂,人工饲料具体配置方法及饲养条件参考Li等(2013)和Hu等(2016)报道的方法(Lietal., 2013; Huetal., 2016)。
HvAV-3h株按照本实验室Li等(2013)报道的方法扩繁和保存。幼虫生长至3龄时(蜕皮12~24 h内),用微型针平行针刺健康的3龄甜菜夜蛾幼虫的腹足,收集感染幼虫的血淋巴作为含毒血淋巴,同时收集未被病毒感染的幼虫血淋巴即无毒血淋巴作对照,于-20±1℃保存备用(Lietal., 2013)。
1.2 3h-38的序列分析
通过NCBI ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)把DNA序列翻译成氨基酸序列,使用Expert Protein Analysis System工具(http://expasy.org/tools/)推导3h-38基因编码蛋白质的相对分子量等理化性质。根据Zhao等(2019)报道的方法使用BLAST软件(http://www.ncbi.nlm.nih.gov/blast)将3H-38序列与GenBank数据库中蛋白序列(http://www.ncbi.nlm.nih.gov/)进行比较分析;Geneious 4.8.4版本(Biomatters Ltd)、DNAMAN(Lynnon corporation)软件进行序列比对,应用在线分析工具Signal P(http://www.cbs.dtu.dk/services/SignalP/)对蛋白信号肽序列、TMP-red在线分析软件(http://www.cbs.dtu.dk/services/TMHMM/)对跨膜区、使用Pfam在线工具(http://pfam.xfam.org/search)对蛋白保守结构域进行预测分析(Zhaoetal., 2019)。
1.3 3h-38基因的克隆
取感染HvAV-3h后72 h的幼虫,以TRI Reagent® RNA/DNA/Protein Isolation Reagent(Molecular Research Center, USA)提取虫体的总RNA,再根据GoScriptTMReverse Transcription Mix,Oligo(dT)反转录试剂盒(Promega, USA)的使用说明进行反转录PCR(Reverse Transcription-Polymerase Chain Reaction, RT-PCR),将制备好的cDNA样品储存于-20℃±1℃。根据Huang等报道的HvAV-3h基因组序列(GenBank登录号:KU170628.1)及其对HvAV-3h各开放阅读框的预测,设计3h-38的基因的编码区特异性引物3h-38-F(5′-GAATTCATGCAGTCGACTGATTTATTT-3′,下划线部分为EcoRI酶切位点)和3h-38-R(5′-CTCGAGTTATGAGTGATTTATTGCATTAT-3′,下划线部分为XhoI酶切位点)。以制备的cDNA为模板,使用3h-38-F/3h-38-R进行PCR扩增,反应程序为94℃初始变性5 min,94℃变性30 s,53℃退火30 s,72℃延伸2 min,进行40个扩增循环。扩增后的产物经琼脂糖凝胶凝胶电泳检测后利用V-ELUTE Gel Mini purification Kit(北京庄盟国际生物基因科技有限公司)回收目的基因的DNA片段。回收后根据pGEM-T Easy Vector System I试剂盒使用说明(普洛麦格(北京)生物技术有限公司)和克隆载体相连,并将连接产物转化入EscherichiacoliTG1感受态细胞中,通过蓝白斑筛选和氨苄青霉素抗性筛选获得含重组质粒(pGEM-T-38)的阳性克隆菌株。克隆片段序列的准确性进一步通过测序确认(擎科生物技术有限公司)。
1.4 原核表达载体的构建
采用限制性核酸内切酶EcoRI和XhoI(TaKaRa)对构建好的pGEM-T-38和pET-28a(+)载体分别进行双酶切,用凝胶回收试剂盒分别回收目的基因片段和载体片段;回收产物采用T4DNA连接酶(目的基因片段和载体片段体积比为5∶3)在4℃反应过夜;通过热激转化法将连接产物转入E.coliTG1感受态细胞中,向菌液中加入1 mL的S.O.C.培养基于37℃,200 rpm震荡培养45 min~1 h;LB固体培养基平板上经卡那霉素抗性筛选后挑取阳性克隆于3 mL LB液体培养基(含卡那霉素50 μg/mL)中,在37℃,200 rpm震荡培养10~12 h后收集菌液,利用Fast Plasmid Minprep Kit(北京庄盟国际生物基因科技有限公司)提取质粒;再以EcoRI和XhoI对筛选获得的重组载体质粒进行双酶切鉴定,获得3h-38的原核表达载体(pET-28a-38)。
1.5 重组质粒的表达及蛋白纯化
将pET-28a-38转入E.coliBL21(DE3)感受态细胞,经卡那霉素抗性筛选,在LB固体培养基挑取阳性单菌落,37℃,200 rpm培养过夜后提取质粒DNA,进行双酶切鉴定,检测表达载体是否构建成功。取100 μL培养物接种到具有相同组成的3 mL LB液体培养基中,并在37℃,200 rpm下生长约2~3 h(直到OD600达到0.6~0.8)。通过加入3 μL 1 mM异丙基-β-D-硫代吡喃半乳糖苷(Isopropyl β-D-1-Thiogalactopyranoside, IPTG)诱导目的基因的表达,然后在37℃,200 rpm条件下培养12 h。取1.5 mL菌液,利用SDS-PAGE凝胶电泳和考马斯亮蓝染色检测菌体中目的蛋白的表达情况。当目的蛋白表达成功后,利用超声波破碎细胞,最后利用镍螯合亲和层析柱(Ni2+-NTA SefinoseTMResin Settled Resin)纯化回收目的蛋白,最后将纯化的目的蛋白送至中国武汉病毒研究所,制备多克隆抗体。
1.6 转录分析
根据1.1所述的方法,分别将含有HvAV-3h的血淋巴(处理组)和健康幼虫的血淋巴(对照组)接种至甜菜夜蛾3龄幼虫(蜕皮后12~24 h)血腔内;在HvAV-3h接种后的3、6、12、24、48、72、96、120和168 h收取试虫;对照组仅收取健康血淋巴接种后24 h的虫体(模拟接种,mock);根据TRI Reagent® RNA/DNA/Protein Isolation Reagent International Patents试剂盒(molecular research center, USA)说明,提取各处理幼虫的总RNA,根据GoScriptTMReverse Transcription Mix,Oligo(dT)反转录试剂盒(Promega, USA)的使用说明制备各样品的cDNA,使用3h-38-F/3h-38-R特异性引物以及本实验保存的甘油醛-3-磷酸脱氢酶编码基因(GAPDH)特异性引物进行40个循环(95℃预变性5 min,94℃变性30 s,53℃退火30 s,72℃延伸1 min)的PCR,然后在1%琼脂糖凝胶上分析聚合酶链反应产物。
1.7 表达分析
在1.5的基础之上,继续用提取总RNA的有机相按照操作说明书,提取各样品的总蛋白;向制备好的蛋白样品以1/6体积的比例加入5×Protein Loading Buffer(北京索莱宝),沸水浴13 min后,将制备好的蛋白样品上样于12% SDS-PAGE胶上,以80 v至120 v的电泳分离蛋白样品中的各蛋白条带;电泳结束后,根据预染maker(PageRulerTMPrestained Protein Ladder, Thermo Scinetific, USA)的指示,割取目的蛋白大小附近的胶块,转印于醋酸纤维膜(nitrocellulose membrane, Millipore, USA)上;经过封闭液(5%脱脂奶粉溶于TBST buffer)室温孵育1.5 h,分别以His-Tag 3H-38兔多抗(Proteintech, CHN, 1∶4 000)和甜菜夜蛾甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)的多克隆抗体(1∶4 000)进行一抗孵育(4℃过夜);以TBST漂洗杂交膜3次,每次5 min,随后以辣根过氧化酶标记的山羊抗兔(horseradish peroxidase(HRP)conjunct goat-anti-rabbit IgG)(购自陕西先锋生物技术有限公司)作为二抗(1∶5 000),进行二抗杂交(室温孵育2 h);以TBST漂洗杂交膜3次,每次5 min,利用Immobilon Western HRP Substrate Luminol Reagent(Millipore, Cat#WBKLS0500)对杂交膜进行显色反应,并在ChemiDocTMXRS+成像仪(BIO-RAD, USA)下拍摄免疫印迹反应条带的图像。针刺模拟感染的幼虫用作对照,GAPDH用作内参蛋白(Yuetal., 2018)。
2 结果与分析
2.1 3h-38的序列分析
3h-38由1 080个碱基对(base pair, bp)组成,预测其编码一条由360个氨基酸残基组成的蛋白(3H-38),相对分子量约为40.357 kDa,等电点(protein isoelectric point, pI)为7.63。根据Net-Phos预测出N端23~121氨基酸位置有一个BRO家族结构域,应用Signal P、TMP red等工具分析推测的氨基酸序列未发现信号肽,从131~150氨基酸位置有一段由胞外向胞内的跨膜区序列(score:568),在228~316位置有一个未知功能的保守结构域(DUF3627)(图1)。同源蛋白氨基酸序列比对结果表明:3H-38与HvAV-3j-43(ORF43)、HvAV-3i-40(ORF40)相似性达到了85%以上,和HvAV-3e-39(ORF39)、TnAV-6b-149(ORF149)的相似性达到了75%以上,和HvAV-3g-45(ORF45)、SfAv-1a-79(ORF79)的相似性达到了60%以上,此外和TnAv-6a-137(ORF137)的相似性为29.53%,和DpAv-4a-110(ORF110)的相似性最低,为19.09%(图1)。

图1 3H-38与其同源蛋白的多重序列对比
2.2 3h-38的克隆和重组表达载体的鉴定
通过特异性引物扩增后,得到了1 080 bp的目的片段(图2-A)。将重组的pGEM-T-38质粒通过对应的限制性内切酶EcoRⅠ、XhoI进行双酶切检测后,泳道2除了一条约3 015 bp的载体片段外,还有与目的基因大小一致的条带,其大小为1 080 bp(图2-B)。将目的条带回收纯化后用于后续实验。
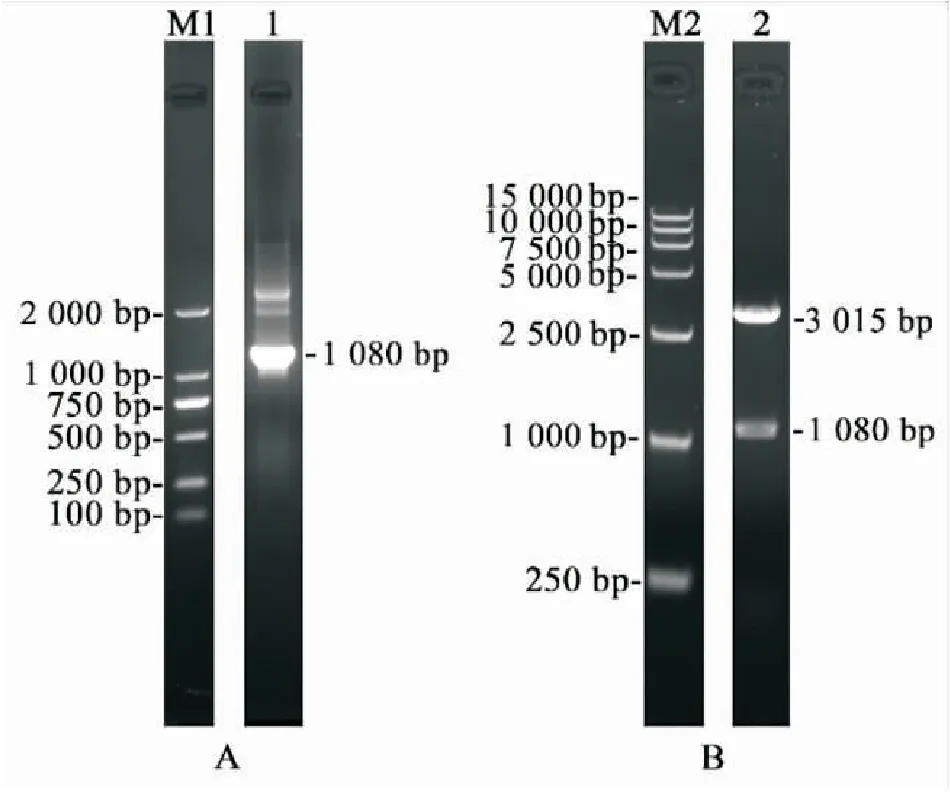
图2 目的基因的PCR扩增及pGEM-T-38酶切鉴定
2.3 3H-38原核表达和蛋白纯化
对获得的原核表达载体pET-28a-38双酶切检测后,3泳道除了5 369 bp的载体片段外,还有和目的基因大小一致的条带(图3),这表明重组表达载体构建成功,可以进行后续的诱导纯化。

图3 pET-28a-38双酶切鉴定
通过IPTG诱导后,3h-38自身可以表达40.35 kDa的蛋白,而由于pET-28a载体自身可以表达出大约3.7 kDa的标签蛋白,故预测3h-38可表达44 kDa的蛋白。结果表明含有pET-28a-38的BL21(DE3)全菌裂解产物有可溶性的蛋白(泳道2),超声破碎后的上清中不存在3H-38的可溶性蛋白(泳道3),超声破碎后被8 M脲溶液溶解的包涵体中存在可溶性的蛋白(泳道4),这说明重组蛋白都变成包涵体溶解于8 M的脲溶液中。用不同pH的8 M脲溶液对目的蛋白进行洗脱(泳道5~14),3H-38蛋白首先从pH 5.9的脲溶液被洗脱出来(泳道9),在10~14泳道都检测到被洗脱的可溶性蛋白。最终选取从Buffer D(pH 5.9)(泳道10,黑色箭头标注)洗脱出的蛋白,将其浓度调到1 μg/mL用于制备多克隆抗体(图4)。
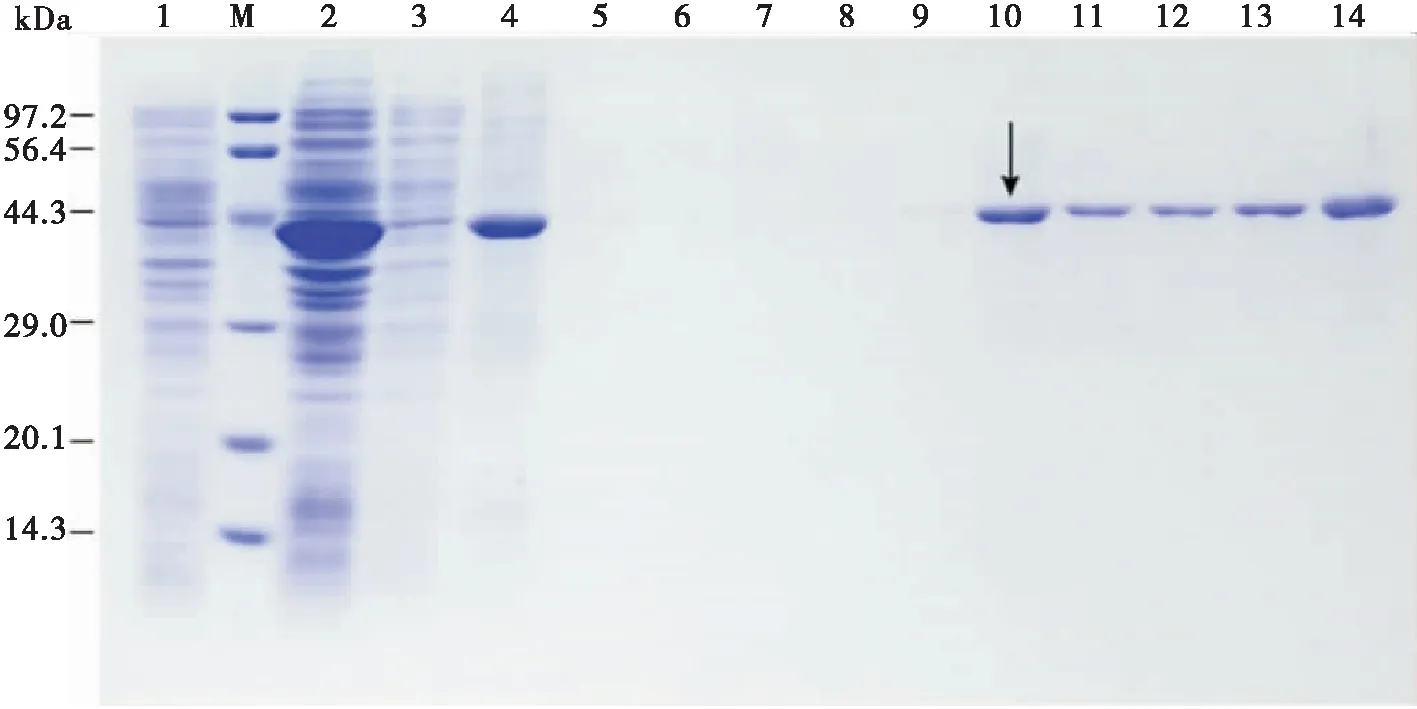
图4 3H-38的表达纯化
2.4 3h-38在甜菜夜蛾体内的转录、表达分析
为了确定3h-38是否在甜菜夜蛾体内被转录,从模拟感染和HvAV-3h感染后不同时间点的甜菜夜蛾幼虫体内提取总RNA进行RT-PCR分析,RT-PCR结果显示对照组未检测到明显的单一条带,3h-38在模拟感染的甜菜夜蛾幼虫体内无转录,处理组在感染3 h(hour post infection, hpi)时检测到单一的条带(大小约为0.6 kb),该条带到168 hpi仍可检测到,这些结果表明3h-38基因是一个在甜菜夜蛾体内早期转录的基因(图5)。
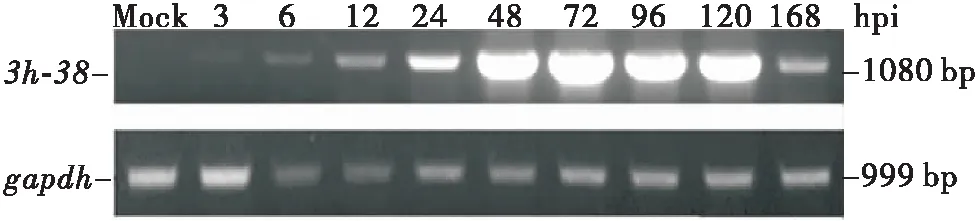
图5 HvAV-3h感染的甜菜夜蛾幼虫中3h-38转录分析
使用抗3H-38特异性兔抗血清进行Western blotting检测,结果显示3H-38蛋白首先在36 hpi检测到,到168 hpi仍然可检测到,其大小约40 kDa,和预期大小相符,表明3H-38蛋白质在转录翻译后没有发生重大的修饰,在模拟感染的幼虫体内未检测到3H-38的表达。GAPDH作为内参抗体在每个时间段都能够检测到(图6)。
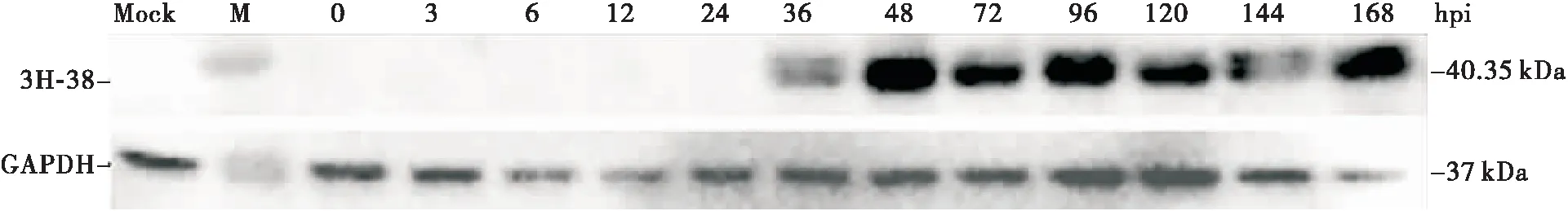
图6 HvAV-3h感染的甜菜夜蛾幼虫中3H-38表达分析
3 结论与讨论
本研究对3H-38蛋白序列进行了分析,发现3H-38与HvAV-3j-43(ORF43)、HvAV-3i-40(ORF40)相似性达到了85%以上。在线分析显示3H-38蛋白N端有一个未知功能的序列(DUF3627),N端23~121氨基酸位置有一个BRO家族结构域。虽然3H-38的N端被预测到含有一个bro基因家族结构域,但是其作用和功能还是未知的。在杆状病毒中,家蚕核型多角体病毒(Bombyxmorinucleopolyhedrovirus, BmNPV)可以编码5个bro基因,而其指导编码的BRO蛋白在病毒感染抑制宿主mRNA翻译方面有一定的作用,其N端氨基酸序列还有核输出信号的作用(Kangetal., 2006; Kotanietal., 2015)。此外,蛋白结构分析还表明3H-38在131~150氨基酸位置有一段由胞外向胞内的跨膜区序列,在鼠肝炎病毒(Murinehepatitisvirus, MHV)S蛋白中也存在一段由胞外向胞内的跨膜区,进一步研究发现这段跨膜区和病毒颗粒的装配有关,也具有病毒膜融合的功能(Yeetal., 2004)。这也提示着3H-38蛋白在病毒感染宿主过程也具有类似复杂功能。
本研究还检测了3h-38基因在感染HvAV-3h甜菜夜蛾体内的转录本,结果显示3h-38基因3 hpi开始在甜菜夜蛾体内转录,而其编码的蛋白在36 hpi开始表达。Kang等人表征了BmNPV的5个bro基因(bro-a、bro-b、bro-c、bro-d、bro-e)转录发生在感染后2~4 h(Kangetal., 1999),略早于3h-38基因的转录起始时间。3H-38的表达始于感染后36 h,较3h-38转录的起始时间相比,有30 h以上的延后(图5-6)。虽然病毒基因的表达较转录有所推迟在其他报道中也有出现,如董战旗等分析lef-11基因及其编码蛋白质在BmNPV侵染的家蚕卵巢培养细胞BmN中的转录与表达时相,发现lef-11从侵染后6 h开始转录,蛋白质从侵染后12 h开始持续表达(董战旗等, 2016);张楠等分析苜蓿银纹夜蛾核型多角体病毒(Autographacalifornicanucleopolyhedrovirus, AcMNPV)bro基因的转录和表达时相中也有表明AcMNPV的ac-bro基因在感染后6 h开始转录,在8 h检测到表达(张楠等, 2016),但这些延迟远没有3h-38明显。在已报道的HvAV-3h的结构蛋白3H-117和3H-21的表达相对转录的起始分别延迟了16 h和24 h,虽比本研究中3H-38的延迟短,但也明显比杆状病毒功能基因中的延迟更明显,这可能与囊泡病毒自身的特殊性相关(Zhaoetal., 2019; Zhaoetal., 2020)
本研究利用生物信息学技术分析了3H-38蛋白的结构,检测了3h-38基因在感染HvAV-3h甜菜夜蛾幼虫体内的转录水平和其编码蛋白的表达时相,展示了HvAV-3h的3H-38蛋白的转录和表达特性,为后续阐述3H-38功能、解明HvAV-3h的致病机制提供基础数据。

