去泛素化酶抑制剂b-AP15抑制马立克氏病病毒的复制
于 翀,王文婧,谢知航,周正轩,王 婷,范青松,王梦涵,吕 岩,许家翠,艾永兴 (吉林大学 动物科学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062)
马立克氏病(Marek's disease,MD)是致病型马立克氏病病毒(Marek's disease virus,MDV)引起鸡的一种烈性传染病,表现为免疫抑制、多脏器淋巴瘤和神经麻痹等,常引发其他病原合并感染以及死亡。MD在世界各地广泛存在,我国与埃及是MD的高发病率国家[1]。接种MD疫苗是控制MD暴发的最主要手段。近几十年来,随着疫苗的广泛使用,MDV的毒力一直在不断增强,出现了毒力更强的超强(very virulent,vv)和超超强(very virulent plus,vv+)型MDV株,这些毒株可造成感染鸡发生严重的脑水肿和数日内急性死亡[2-4]。通常每种新MD疫苗使用后约10年,就会出现毒力更强的毒株,而最有效的CVI988/Rispens疫苗早已超过了这个使用时限[2,5-6],常有免疫鸡群再次暴发MD的报道[4,7],因此,MD对我国的养禽业仍是重要威胁。研究发现,MD疫苗只能暂时控制MD的暴发,但不能阻止MDV对MD疫苗免疫鸡的感染以及在鸡细胞内的复制和释放。MD疫苗免疫使鸡寿命延长,为侵入鸡细胞内的MDV提供了充足的时间进行增殖、变异、成熟和传播[3,5]。因此,经MD疫苗免疫并被MDV强毒株感染而不发病的鸡,就成为MDV新的传染源。与此同时,疫苗免疫引起的免疫压力还促进MDV毒力不断增强[3]。因此,世界各国都在努力探寻各种办法加强MD的防控,包括使用免疫佐剂调节剂、采用新接种方式、构建新型基因工程苗、培育抗性鸡等方法[3,8-9],同时还致力于阐明MDV致病分子机制的研究[10-15],探寻可用于阻止MDV感染、增殖的靶点和通路,进而通过抑制MDV在细胞内复制阻止MDV致病、切断传染源、弥补疫苗免疫的“短板”。MDV编码的病毒型去泛素化酶UL36参与淋巴瘤的形成[16-17],通过突变抑制其去泛素化酶活性可以抑制MDV在鸡细胞内的复制,也可降低MD的发生率,减少MDV的水平传播[17]。而UL36的N端去泛素化酶(UL36 N端包含催化结构域和核定位信号的480个氨基酸片段,UL36-480)在所有致病型MDV株中完全保守[18],这也说明其活性对MDV生命活动至关重要。本研究以去泛素化酶UL36-480为靶点,高通量筛选对UL36-480活性有抑制作用的化合物,并利用MDV细胞病变(cytopathic effect,CPE)模型以及MD动物模型进一步确定所筛选化合物对MDV复制的影响。
1 材料与方法
1.1 动物、细胞和毒株SPF级9日龄鸡胚和1日龄雏鸡购于北京勃林格殷格翰维通生物技术有限公司;CEF细胞根据常规方法制备[19];MDV-J1株购于北京市农林科学院畜牧兽医研究所,液氮保存。
1.2 主要试剂与仪器包括b-AP15(CAS 1009817-63-3)、GW7647(CAS 265129-71-3)、Rottlerin(CAS 82-08-6)、MLN9708(CAS 1201902-80-8)、6-Thioguanine(CAS 154-42-7)、Spautin-1(CAS 1262888-28-7)、Epoxomicin(CAS 134381-21-8)、MG132(CAS 133407-82-6)、USP7/USP47 inhibitor(CAS 1247825-37-1)、Pimozide(CAS 2062-78-4)、Aprotinin(CAS 9087-70-1)、Bestatin(CAS 58970-76-6)等在内的2 448个蛋白酶抑制剂初选库购于MCE(中国)皓元生物公司;Strep-Ub-PLA2底物、UL36-480去泛素化酶由本实验室制备保存[18];各种常用分析纯化学试剂均购于鼎国公司;去泛素化酶切反应缓冲液10×Reaction Buffer(500 mmol/L HEPES,1 g/L BSA,5 mmol/L EDTA,10 mol/L DTT)及Cell Counting Kit-8(CCK-8)试剂盒购于长春三邦化学公司;DMEM、ChamQTMUniversal SYBR qPCR Master Mix试剂盒、Gibco胎牛血清(FBS)购于一向科技公司;LA Taq DNA聚合酶购于TaKaRa公司; EasyPure Viral DNA/RNA Kit试剂盒购于全式金公司;鸡淋巴细胞分离液由天津灏洋公司生产;FluoroMax 4荧光分光光度计购自HORIBA Scientific公司;蛋白质相对分子质量标准26610购自ThermoFisher公司。
1.3 载体和引物用于定量分析的含有UL36 N端1 025个氨基酸片段编码基因的标准质粒pMD18-T-UL36-1025为前期研究构建[18],其引物UL36 F:5′-AGTCCTGCGTCTTCAGTT-3′和UL-36 R:5′-CAGAAGTCGCTATTGTCC-3′由Genewiz公司合成。
1.4 UL36-480抑制剂的筛选以UL36-480酶水解Strep-Ub-PLA2底物反应体系为基础[18,20],以低于114 μmol/L的化合物能抑制UL36-480水解反应视为有效抑制作用[21]。反应体系:114 μmol/L化合物、 3 nmol/L UL36-480、1 μg Strep-Ub-PLA2、2 μL 10×Reaction Buffer,加灭菌H2O至20 μL。反应条件:先将含有不同化合物但无Strep-Ub-PLA2底物的反应体系在4℃孵育1 h,然后补充1 μg 的Strep-Ub-PLA2,于37℃孵育1 h;将酶切产物进行15% SDS-PAGE,分析结果。在0~114 μmol/L梯度稀释筛选出的化合物,进一步确定完全抑制UL36-480活性的最低有效浓度。
1.5 b-AP15对UL36-480酶的抑制动力学分析反应体系包含不同浓度(0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8 μmol/L)的荧光底物Ub-AMC,1.4中确定的5 μmol/L b-AP15、3 nmol/L UL36-480、10 μL 10×Reaction Buffer,加灭菌H2O至100 μL。反应条件:先将不同浓度的b-AP15分别与UL36-480在4℃孵育1 h, 然后加入不含Ub-AMC的反应体系,37℃孵育2 min,再加入Ub-AMC后立即将荧光比色皿放于荧光分光度计进行荧光值检测。应用GraphPad Prism 8.0软件拟合酶动力学曲线,计算相关参数,分析b-AP15对UL36-480的抑制作用。对于非竞争性抑制按公式Ki=[I]/(Vmax/Vmaxinh-1)计算Ki值[22],其中Vmaxinh为有抑制剂条件下的最大反应速度,Vmax为无抑制剂条件下的最大反应速度,[I]为抑制剂浓度,Ki为抑制常数。再应用Cheng-Prusoff方程计算IC50,对于非竞争性抑制使用公式IC50=Ki(1+Km/[S])计算IC50值[23-24],其中Ki为抑制常数,[S]为底物浓度,Km为米氏常数,IC50为50%抑制浓度。
1.6 b-AP15对CEF细胞安全浓度确定96孔板每孔铺入3×104个CEF细胞,用培养基将b-AP15稀释成浓度梯度(0.5,1.0,1.5,2.0,2.5,3.0 μmol/L),待细胞贴壁后更换含有梯度浓度b-AP15的培养基,终体积为100 μL,37℃培养3 d后,显微镜下观察细胞状态,并根据CCK-8说明书检测细胞活力,细胞活力>90%视为无显著影响[25],进而确定b-AP15对CEF细胞的安全浓度。利用Origin 2019作图,横坐标为药物浓度,纵坐标为细胞活力,每个处理进行3次重复。
1.7 b-AP15对MDV CPE的影响六孔板中每孔铺入8×105个CEF细胞, 贴壁长成单层后,将生长培养基分别更换为含有等体积DMSO或安全浓度b-AP15的培养基,并以120 PFU/孔接毒,3 d后在显微镜下观察MDV的CPE变化,统计每孔CPE个数及面积。每个处理进行3次重复。
1.8 定量分析b-AP15对MDV在CEF细胞内复制的影响首先将质粒pMD18-T-UL36-1025的质量浓度换算成拷贝数浓度,换算公式如下:拷贝数浓度(copy/μL)=质粒质量浓度(g/μL)÷质粒相对分子质量×NA(阿伏伽德罗常数),再以一定拷贝数梯度的标准质粒为模板进行q-PCR,并绘制标准曲线,横坐标为拷贝数(102,103,104,105,106,107共6个拷贝数梯度)的log值,纵坐标为Ct值,进行3次重复试验,反应条件参考q-PCR试剂盒说明。应用EasyPure Viral DNA/RNA Kit试剂盒提取步骤1.7中每孔细胞的总基因组,提取方法参照试剂盒说明书进行,所有最终洗脱DNA体积均40 μL。以1 μL各处理组细胞基因组DNA为模板,应用引物UL36 F/UL36 R进行q-PCR,将每组得到的Ct值带入标准曲线方程得到拷贝数,再乘以40即为每孔所含总MDV基因组的拷贝数。每组进行3次重复。
1.9 b-AP15对MDV在鸡T淋巴细胞中复制的影响将1日龄SPF雏鸡随机分为3组,每组5只,分3个房间隔离饲养,均在1日龄时腹腔接种0.2 mL MDV-J1(约100 PFU)。参考文献以及前期药物安全剂量预试验结果确定给药剂量[26],2个试验组鸡每日腹腔注射2 mg/kg和5 mg/kg的b-AP15,无药物处理组鸡每日腹腔注射等量灭菌生理盐水(含等量药物溶剂DMSO),做为对照组。鸡均在接种后21 d(感染后MDV增殖峰值期)采集外周抗凝血,按照鸡T淋巴细胞分离液说明书分离T淋巴细胞[27],每组取1×104个T淋巴细胞提取基因组,并应用引物UL36 F/UL36 R进行q-PCR分析。
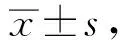
2 结果
2.1 b-AP15抑制UL36-480的去泛素化酶活性如图1所示,用Strep-Ub-PLA2作为底物对蛋白酶抑制剂初选库进行筛选,结果发现,在114 μmol/L浓度条件下,b-AP15对UL36-480水解Strep-Ub-PLA2反应具有抑制作用,无水解产物产生,而其他化合物对UL36-480的酶活性均无抑制作用,UL36-480仍能水解Strep-Ub-PLA2产生PLA2和Strep-Ub两种产物。进一步研究发现(图2),浓度高于10 μmol/L 的b-AP15均可完全抑制3 nmol/L UL36-480的酶活性,无水解产物产生。根据结果,选择5 μmol/L的b-AP15用于3 nmol/L UL36-480抑制动力学分析。

M.蛋白质相对分子质量标准;1~12.分别为添加了化合物GW7647、ML-323、MLN9708、6-Thioguanine、Spautin-1、Epoxomicin、MG132、USP7/USP47 inhibitor、Pimozide、Aprotinin、Bestatin和b-AP15在UL36-480酶切反应体系;13.只含反应Buffer的空白组;14.无抑制剂的UL36-480酶切反应体系;15.Strep-Ub-PLA2蛋白图1 部分化合物对UL36-480催化反应的影响

M.蛋白质相对分子质量标准;1~6.分别添加50,20,10,5,2,1 μmol/L b-AP15的UL36-480酶切反应体系;7.Strep-Ub-PLA2蛋白图2 不同浓度b-AP15对UL36-480催化反应的影响
2.2 b-AP15非竞争性抑制 UL36-480的酶活性检测5 μmol/L b-AP15对3 nmol/L UL36-480水解不同浓度Ub-AMC的抑制作用,使用GraphPad Prism 8.0对所得数据进行分析,如图3所示,无抑制剂条件下,UL36-480的Vmax为4.022 nmol·L-1·s-1,Km为0.691 μmol/L;添加5 μmol/L的b-AP15的条件下,UL36-480的Vmax为3.042 nmol·L-1·s-1,Km为0.691 μmol/L。据此判定b-AP15对UL36-480的抑制属于非竞争性抑制,Ki值为15.52 μmol/L。底物浓度为0.8 μmol/L时b-AP15对3 nmol/L的 UL36-480的IC50为8.33 μmol/L。
A.米氏方程曲线;B.双倒数拟合曲线。V.初始反应速度;[S].底物浓度;UL36-480.无抑制剂组;b-AP15.加b-AP15组图3 b-AP15对UL36-480抑制动力学分析
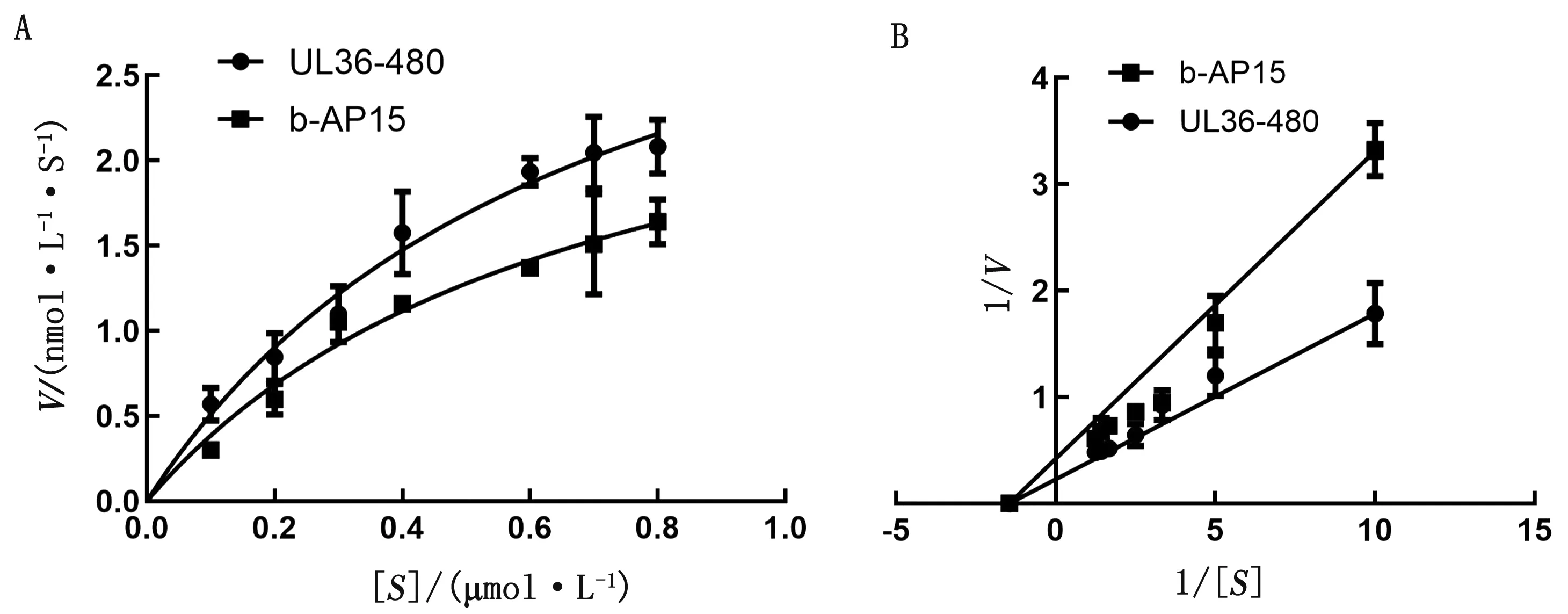
2.3 b-AP15抑制MDV在CEF细胞中的复制为进一步分析b-AP15是否影响MDV在CEF细胞中的复制,先确定b-AP15在CEF上的安全剂量。如图4所示,CCK-8法分析发现,当培养基中含1 μmol/L b-AP15时,细胞活力未发生显著变化(细胞活力>90%),因此,后续细胞试验使用低于1 μmol/L的b-AP15。应用0.25,0.50 μmol/L的b-AP15处理接种了MDV的CEF,镜下可见CPE个数减少,面积减小(图5)。对各孔总CPE进行统计分析,发现与无b-AP15的对照组相比,b-AP15显著抑制CPE的产生,对照组的CPE平均为111个,而b-AP15处理组的CPE个数和每孔CPE平均面积都显著低于对照组(P<0.01)(表1)。将含有UL36基因的标准质粒进行拷贝数梯度稀释,建立的标准曲线方程为y=43.131-1.702ln(x),其中y为Ct值,x为拷贝数。提取各处理组细胞的基因组DNA,并进行定量PCR,根据标准曲线方程计算各处理孔中MDV的拷贝数,如表2所示,b-AP15处理组中所含MDV的拷贝数显著低于对照组。与对照组相比,0.50 μmol/L b-AP15处理组MDV的拷贝数减少到1/407,0.25 μmol/L b-AP15处理组MDV的拷贝数减少到1/65。这些结果说明,b-AP15 有效抑制了MDV在CEF上的CPE,并抑制MDV在CEF细胞内的复制。
表2 b-AP15对MDV在CEF中复制的影响

图4 不同浓度b-AP15条件下CEF细胞活力分析

表1 b-AP15对MDV在CEF上的CPE的影响
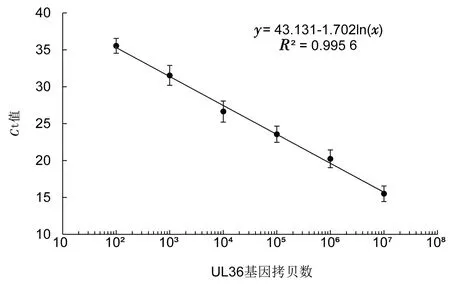
图6 MDV拷贝数标准曲线
2.4 b-AP15抑制MDV在鸡T淋巴细胞内的复制如表3所示,与对照组相比, b-AP15处理组T细胞中MDV基因组拷贝数显著降低(P<0.01),2 mg/kg b-AP15组降低到1/47,5 mg/kg b-AP15组降低到1/375。此结果表明,腹腔注射b-AP15可显著抑制MDV在鸡T细胞中的复制。
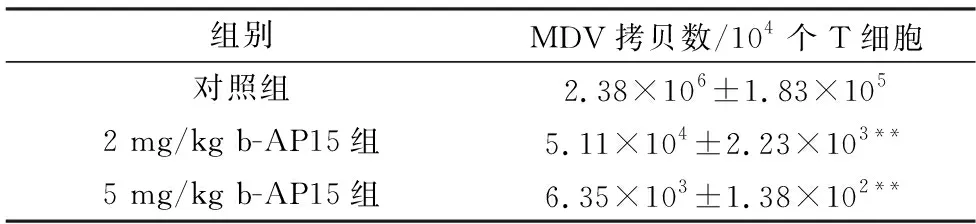
表3 b-AP15对MDV在鸡T细胞中复制的影响
3 讨论
泛素化修饰与去修饰过程是参与几乎所有细胞进程的蛋白质翻译后修饰调节机制。宿主细胞编码的以及一些病原体编码的泛素化相关酶与去泛素化酶对这种机制的调节都影响着细胞内稳态的平衡,使其成为一些疾病的研究靶点[28],如细胞内的去泛素化酶USP1参与DNA损伤的修复,其抑制剂具有抗癌作用[29]。USP7不但是诸多病毒诱导宿主细胞转化的重要靶点,同时也是维持基因组稳定的重要调节酶[30]。病毒编码的与泛素化调节相关的E1、E2、E3酶、去泛素化酶以及调节这些酶的蛋白可以调控细胞内泛素化组的稳态,进而抑制宿主细胞内参与免疫调节的泛素化系统[27,31-32]。揭示这些病毒编码的蛋白活性特点、阐明其对宿主细胞的调控机制,对于了解病毒致病机理以及研发靶向药物具有重要的价值。许多动物病毒可以编码类似的蛋白,现已发现HSV、KSHV、EBV、MDV、PRV、HCMV、SARS-CoV、MERS-CoV等病毒编码USP类去泛素化酶[33-35],EAV、PRRSV、CCHFV、DUGV等编码OTU类去泛素化酶[36-37]。SARS-CoV、MERS-CoV编码的去泛素化酶对这2种病毒的致病性至关重要,2种病毒的去泛素化酶的抑制剂可分别特异性抵抗这2种病毒,并且无交叉反应[38]。因此,以病毒编码的去泛素化酶为靶点研发抗病毒药物,是解决疫苗“短板”的一个重要策略。
本研究的前期工作已制备出有活性的MDV编码的去泛素化酶UL36,确定了其水解底物的特异性以及酶动力学参数[18],并揭示MDV可通过控制鸡CD4+T细胞的泛素化组进而促进T淋巴细胞转化成瘤[27]。有研究发现,通过突变破坏UL36去泛素化酶活性可以抑制MDV在鸡细胞内的增殖,减少肿瘤发生并降低MDV的水平传播能力[16-17]。据此,应用特异地靶向UL36的药物抑制MDV在细胞内复制,不但能增强MD疫苗的免疫效果,也可直接用于抵抗MDV。前期的研究发现,MDV编码的UL36的催化活性区与其他病毒编码的去泛素化酶甚至同一疱疹病毒属所编码的去泛素化酶在氨基酸序列、空间结构以及催化的底物特异性等方面均存在显著性差异。本研究所建立的初选库均为各种蛋白酶体或去泛素化酶抑制剂,经过本研究的筛选也证实,只有个别抑制剂对MDV编码的UL36具有抑制作用,也说明这些去泛素化酶在蛋白质结构水平上存在差异,所以可产生抑制作用的化合物也不同。因此,本研究通过筛选以及酶动力学参数分析,确定所筛选化合物的靶向性,尽可能减少所筛选化合物在细胞水平的脱靶效应,也为未来临床应用时尽可能减少毒副作用奠定基础。
本研究所中筛选出的b-AP15对UL36的酶活性、MDV的CPE以及复制具有显著的抑制作用。已有研究发现b-AP15是UCHL5 和 USP14等去泛素化酶的特异性抑制剂,可以诱导肺癌A549细胞、B淋巴瘤等肿瘤细胞的凋亡[39-41],并抑制荷瘤小鼠肿瘤的增殖[40]。在病毒相关研究中,只发现b-AP15可通过抑制人T细胞的UCH37和USP14进而逆转HIV的潜伏期,促进艾滋病的治疗[42],但b-AP15针对于其他病毒的研究还未见报道。动物细胞内含有数百种去泛素化酶,b-AP15除了抑制MDV的UL36,是否还通过抑制细胞内其他去泛素化酶或其他类型的酶进而抑制MDV复制,还需要进一步对其分子机制进行研究。在本研究中,使用了3 μmol/L 的b-AP15,此浓度高于b-AP15诱导人肿瘤细胞凋亡的浓度(1 μmol/L)[39-41],但本研究未发现b-AP15诱导鸡CEF凋亡,可能跟人与鸡细胞内泛素化调控凋亡的机制存在差异有关。MD鸡模型水平的研究发现,使用报道5 mg/kg的每日用药量可显著抑制MDV在鸡T细胞内的复制。对照组在攻毒后20 d未出现明显的肿瘤,只有个别鸡有肠出血现象,但给药组鸡肝脏出现非MD的病变,这可能与b-AP15毒性有关。将每日用药量降至2 mg/kg,给药鸡的肝脏仍有少量病变,而未用药的对照组无此现象。因此,进一步开展b-AP15在鸡体的药代动力学与毒理学研究,可为b-AP15抗MD的临床使用提供重要依据。
本研究确定了b-AP15可抑制MDV在鸡细胞内的复制,试验中为防止鸡红细胞中基因组的干扰,也为确定等量T淋巴细胞内MDV基因组的真实变化,消除MDV或b-AP15可能改变血液中T细胞含量对试验的影响,本研究使用了等数量的所分离的鸡外周血T细胞进行MDV基因组拷贝数变化的分析。另一重要原因是,鸡T细胞是MDV最主要的复制场所,所以此方法所获结果可直接体现MDV在鸡体内的变化,也为进一步研究b-AP15是否影响MDV通过T细胞浸润毛囊细胞完成包装、成熟以及释放活动提供直接参考。
由于MD疫苗不能抑制MDV在鸡细胞内的复制、成熟和释放,因此,b-AP15抑制MDV在鸡细胞内的复制可弥补疫苗免疫的不足,b-AP15可作为疫苗的增强剂用于临床研究。同时,本研究结果为b-AP15的分子改造以减少毒副作用以及推动抗MD靶向新药的研发提供了依据。还有很多病毒编码的去泛素化酶的功能尚未阐明,本研究也可为其他动物病毒病的靶向药物研究提供参考。

