绿光条件下氮浓度对紫球藻生长和生物活性产物合成的影响
郭 帅,黄子诚,谢 点,吴黎明,郑明敏,2,陈必链,2,何勇锦,2*
1福建师范大学生命科学学院;2福建师范大学 工业微生物教育部工程研究中心,福州 350117
紫球藻(Porphyridiumcruentum)是紫球藻科、紫球藻属一种较为原始的单细胞红藻,是红藻门中唯一的单细胞微藻[1]。紫球藻可合成藻胆蛋白、多不饱和脂肪酸(PUFAs)、硫酸酯胞外多糖等生物活性物质[2,3]。Ismail等[4]利用藻胆蛋白制成银纳米粒子,实验结果表明该粒子比原有藻胆蛋白表现出更强的抗菌、抗氧化和抗病毒活性。对于PUFAs,已有大量临床研究证实了,食用PUFAs可促进神经细胞和组织的发育,降低肿瘤、心血管疾病和其它慢性疾病的发生[5]。紫球藻硫酸酯多糖,具有抗病毒、抗辐射、抗氧化、抗癌等多种生物学功能[6]。因此,开发紫球藻生物活性物质对我国生物医药、化妆品、保健食品等行业的发展具有重要的意义。
已有研究表明[7],与其它光源(如白炽灯、金属卤化物灯)相比,发光二极管(LED)灯的使用寿命更长(约5万 h),生产工艺更环保,已广泛用于培养微藻。本课题组最近研究发现,与LED源的蓝灯、红灯和白灯相比,紫球藻(Porphyridiumcruentum,FJ-12)在LED绿光条件下生长最好[8]。因此,本研究培养紫球藻所使用的光源为LED绿光。
有研究表明,紫球藻细胞的生长特性及其活性物质的产量与氮源浓度存在很大的相关性。Guihéneuf等[9]研究表明,与缺氮条件相比,紫球藻在富氮(1 g/L)条件下可促进合成藻红蛋白或藻胆蛋白;然而,紫球藻在缺氮条件下,有利于PUFAs的合成和胞外多糖的分泌。已有的研究[10,11]也得到类似的结果。这些研究可表明,氮浓度调节着微藻细胞机体内蛋白质、油脂和糖类代谢的平衡,影响微藻储存物质的方向。正如前人的研究结果[9-11],氮调控只能调节紫球藻合成藻红蛋白或合成PUFAs和胞外多糖。因此,非常有必要调控培养紫球藻的工艺条件,使其机体内的代谢处于最佳平衡状态,进而达到协同合成藻红蛋白、PUFAs和胞外多糖。
有研究指出[12],在不适的光质条件下,微藻机体内的活性氧(ROS)水平上升,进而加速对藻红蛋白或藻胆蛋白的氧化或降解,降低对光量子的吸收,影响捕光效率和光合作用。本课题组的前期研究发现,LED绿光是最适合培养紫球藻(Porphyridiumcruentum, FJ-12)的光质。因此,有必要研究,在LED绿光条件下,不同氮源浓度对紫球藻生长和活性物质合成的影响。寻找最适合协同合成紫球藻藻红蛋白、PUFAs和胞外多糖的培养工艺。目前,关于这一方面的研究还尚未报道。基于本课题组已有的研究基础上,选择紫球藻(Porphyridiumcruentum,FJ-12)为藻种,在LED绿光条件下,系统评估不同氮源浓度对紫球藻细胞生长和藻胆蛋白、PUFAs与胞外硫酸酯多糖合成的影响,解决现有紫球藻协同合成生物活性物质的技术瓶颈,为产业化养殖紫球藻协同合成活性物质提供实践依据。
1 材料与方法
1.1 实验藻种及光生物反应器
紫球藻(Porphyridiumcruentum,FJ-12)藻种保藏于本实验室。培养紫球藻所使用的反应器为柱式光生物反应器(长1 000 mm,外径50 mm和内径45 mm),购置于南京启衡渔业科技有限公司。
1.2 培养基
人工海水(ASW)培养基[13]:27 g NaCl,6.6 g MgSO4·7H2O,5.6 g MgCl·6H2O,1.5 g CaCl2·2H2O,1 g KNO3,0.07 g KH2PO4,0.04 g NaHCO3,1 mol/L Tris·HCl(pH 7.6)20 mL,1 mL微量元素母液a,1 mL FeEDTA溶液b,加蒸馏水至1 L,121 ℃灭菌20 min。
微量元素母液a:4 mg ZnCl2,60 mg H3BO3,1.5 mg CoCl2·6H2O,4 mg CuCl2·2H2O,40 mg MnCl2·4H2O,37 mg (NH4)6Mo7O24,加蒸馏水至100 mL,121 ℃灭菌20 min。
FeEDTA溶液b:100 mL 0.05 mol/L Na2EDTA(pH 7.6),240 mg FeCl3·4H2O。
1.3 实验设计
将紫球藻细胞接种于含250 mL ASW培养基的500 mL锥形瓶中,在培养温度为25 ℃和光照强度为3 000 Lux条件下,24 h持续光照,培养10天,藻细胞作为种子。
用1‰盐酸溶液浸泡柱式光生物反应器处理48 h,蒸馏水冲洗反应器管内,用已灭菌的ASW培养基充分润洗反应器3次。在LED绿灯条件下,设置KNO3浓度分别为0、0.5、1和1.5 g/L的不同实验组,每组3管。紫球藻培养条件为:初始生物量为0.1 g/L,LED绿光强度为3 000 Lux,光照时间为24 h,培养温度为25 ℃,通气速率为1 L/min,通气中的CO2为5 %,装液量为1 L。培养过程中,每3天取样测定细胞生物量和生化组分指标。
1.4 生物量的测定
取藻液10 mL,在8 000 rpm 条件下离心10 min,弃去上清液收集藻泥,用蒸馏水洗涤藻泥,重复操作两次,最后将处理好的藻泥置于80 ℃干燥箱中烘干至恒重,测定其干重。紫球藻生物产量的计算公式为:
由于前置胎盘胎盘覆盖于子宫前壁切口位置,传统手术瘢痕可能会影响胎盘移动,最终造成胎盘前置,加之子宫瘢痕内膜过薄,使其绒毛组织侵入到子宫肌层中,使其胎盘植入几率明显提升。在进行本次研究发现,全部患者均符合手术病理标准,患者经过在腹彩超多普勒超声的检查发现,其诊断率为95.5%(85/89),漏诊率4.9%(4/89)。对此,前置胎盘并发胎盘植入临床诊断中,腹彩色超声多普勒具有较高准确率,且呈现无创安全的特点,具备临床推广与使用价值。
紫球藻生物产量(mg/(L·d))=
微藻生物量(mg/L)/培养时间
1.5 藻胆蛋白浓度的测定
依据Marcati等[14]的方法,测定藻胆蛋白的步骤如下:取3 mL藻液离心收集藻泥,加入5 mL PBS缓冲液(0.1 mol/L,pH 7.4),放入-20 ℃冰箱中反复冻融,至藻泥颜色变白,离心收集上清液分别于650、620和565 nm波长条件下测吸光值,藻胆蛋白中别藻蓝蛋白(APC)、藻蓝蛋白(R-PC)和藻红蛋白(B-PE)浓度换算用如下公式:
R-PC(mg/mL) = (OD620-0.7×OD650)/7.38
APC(mg/mL) = (OD650-0.19×OD620)/5.65
B-PE (mg/mL) = (OD565-2.8×(R-PC)-1.34×(APC))/12.7
紫球藻别藻蓝蛋白、藻蓝蛋白和藻红蛋白产量计算使用如下公式:
R-PC产量(mg/(L·d))=R-PC浓度/培养时间
APC产量(mg/(L·d))=APC浓度/培养时间
1.6 胞外多糖的测定
根据Dubois等[15]的方法测定微藻胞外多糖含量,取1 mL的藻液,离心(8 000 rpm,5 min)收集上清液。取适量的上清液,加入5 mL 98%硫酸和1 mL 6%苯酚溶液,反应30 min后,在波长490 nm条件下测定吸光值,D-葡萄糖作为测定微藻胞外多糖的标准品。测定公式为:
S=174.83×OD490-0.95,R2=0.997
其中,S为胞外多糖的浓度(mg/L);OD490为490 nm的吸光值。
紫球藻胞外多糖产量的计算使用如下公式:
紫球藻胞外多糖产量(mg/(L·d))=紫球藻胞外多糖浓度/培养时间
1.7 样品的甲酯化和脂肪酸组成的测定
取藻液5 mL离心收集藻泥,加1 mL 1%硫酸-甲醇溶液,加入100 μL 1 mol/L的BHT(2,6-二叔丁基对甲酚)溶液,置于70 ℃水浴处理45 min,待样品冷却至室温,加2 mL含十七酸甲酯(0.5 mg/L)的正己烷和2 mL蒸馏水,4 000 rpm离心5 min,取上清液的正己烷于试管中,加1 mL正己烷再次萃取,重复3次,合并提取的正己烷溶剂,氮吹去除正己烷,最后加1 mL正己烷溶解脂肪酸甲酯。37种脂肪酸甲酯标准品和十七烷酸甲酯(0.1 mg/mL)对处理样品进行定性定量分析。利用气相色谱仪(SCION 436-GC,Bruker)[8]测定样品的可皂化脂肪酸(TFA)浓度(mg/L)。
紫球藻ARA和EPA产量的计算公式为:
ARA产量(mg/(L·d))=紫球藻TFAs浓度×ARA含量/培养时间
EPA产量(mg/(L·d))=紫球藻TFAs浓度×EPA含量/培养时间
2 结果与分析
2.1 不同氮浓度条件下紫球藻的生长情况
在不同氮浓度条件下,紫球藻的生长情况如图1所示。由图1可得,在缺氮培养基条件下,紫球藻细胞的生长缓慢,其生物量维持在0.1~0.55 g/L。与其他氮浓度相比,紫球藻在1 g/L氮浓度条件下可获得最大生物量(3.09 g/L)。Kim等[16]在研究紫光(400 nm)、蓝光(465 nm)、绿光(520 nm)、黄光(590 nm)和红光(625 nm)对培养紫球藻的生长的影响,结果表明:紫球藻在绿色波长条件下培养14天,可获得最大生物量(1.28 g/L)。Li等[10]研究低氮(3.5 mM)、中氮(5.9 mM)和高氮(17.6 mM)对培养紫球藻生长的影响,结果表明:紫球藻在高氮条件下可获得最大生物量(5.54 g/L)。在本研究中(1 g/L KNO3即为9.9 mM),紫球藻获得的最高生物量比Li等[10]的研究结果低,这可能是因为培养紫球藻的培养基氮浓度的不同和培养条件的差异(如不同光质)所引起的。
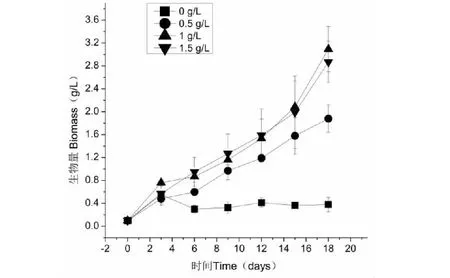
图1 不同氮浓度对紫球藻生长的影响Fig.1 Effect of different nitrogen concentration on P.cruentum cell growth
2.2 不同氮浓度条件下紫球藻藻胆蛋白的合成情况
紫球藻所合成藻胆蛋白包括别藻蓝蛋白、藻红蛋白和藻蓝蛋白。在LED绿光条件下,不同氮浓度对紫球藻APC、B-PE和R-PC合成性能的影响,见图2所示。从图2结果可以看出,在缺氮条件下,紫球藻所合成APC、B-PE和R-PC浓度先上升后下降的趋势;当培养结束后,紫球藻APC、B-PE和R-PC浓度分别为0.24、2.52和0.58 mg/L。这结果表明,缺氮条件下紫球藻进行光合作用产生的氧气会提高机体内活性氧水平,使叶绿体类囊体腔内的pH值下降,酸化环境易导致藻胆蛋白的分解[17]。
对于氮浓度为0.5 g/L时,紫球藻APC、B-PE和R-PC的最高浓度处于第12~15天、第15天和第15天;当培养时间超过15天,藻细胞可能已耗尽了培养基中的氮元素,进而影响对藻胆蛋白的合成,导致APC、B-PE和R-PC浓度下降。当氮浓度分别提高到1 g/L和1.5 g/L时,紫球藻所合成的APC、B-PE和R-PC浓度能维持在较高水平。这可能是因为充足氮浓度可满足紫球藻细胞合成所需的蛋白质。值得注意的是,Li等[10,11]的研究选择白光培养紫球藻,其合成的藻胆蛋白浓度在中后期(9~12天)则呈现下降趋势。在本研究中,选择LED绿光作为培养紫球藻的光源,则不会出现下降趋势。一方面,与白光光源相比,绿色具有较低的光量子吸收值,可能降低类囊体腔的ROS水平,避免藻胆蛋白的分解[18]。另一方面,紫球藻叶绿素a和捕光藻胆素可能赋予其对绿光的适应,促进光合效应[19]。因此,从图2结果可得,最适合紫球藻合成藻胆蛋白的氮浓度为1~1.5 g/L。
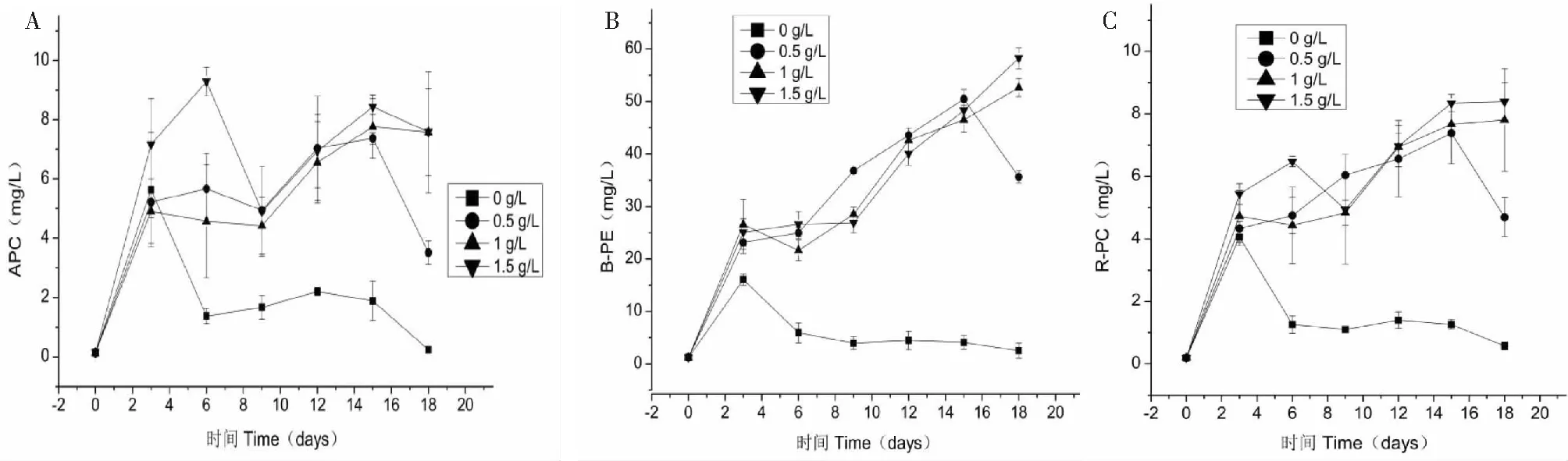
图2 不同氮浓度对紫球藻藻胆蛋白含量的影响Fig.2 Effects of different nitrogen concentrations on phycobiliprotein content of P.cruentum
2.3 不同氮浓度条件下紫球藻胞外多糖的合成情况
不同氮浓度对紫球藻合成胞外多糖的影响,结果见图3。由图3可知,在缺氮条件下,随着培养时间的延长,紫球藻胞外多糖浓度逐渐升高。已有的研究也证实,紫球藻在缺氮条件下,紫球藻细胞光合作用固定二氧化碳主要用于合成胞外多糖[20]。当氮浓度从0.5 g/L提高到1 g/L时,经18天培养后,紫球藻胞外多糖的浓度从103.81 mg/L提高到255.62 mg/L。但是,在氮浓度为1 g/L和1.5 g/L条件下的紫球藻所合成胞外多糖浓度则无显著差异。因此,最适合紫球藻合成胞外多糖的氮浓度为1~1.5 g/L。
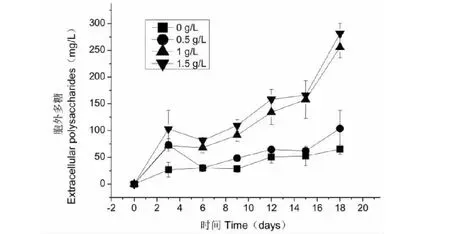
图3 不同氮浓度对紫球藻胞外多糖含量的影响Fig.3 Effect of different nitrogen concentrations on extracellular polysaccharides content of P.cruentum
2.4 不同氮浓度条件下紫球藻油脂的合成情况
图4为不同氮浓度条件下紫球藻合成油脂的结果。已有的研究[10,11,21]和本研究的结果都表明,缺氮有利于紫球藻油脂的合成。但是,与缺氮条件相比,紫球藻在0.5、1和1.5 g/L三个氮浓度条件下具有更高油脂浓度。这主要是因为微藻在这三个氮浓度条件下具有更高的生物量(见图1)。同时,与其他氮浓度相比,在氮浓度为1 g/L下的紫球藻可合成最大的油脂浓度233.86 mg/L。
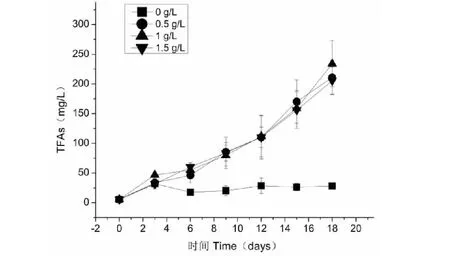
图4 不同氮浓度对紫球藻TFAs含量的影响Fig.4 Effects of different nitrogen concentrations on TFAs content of P.cruentum
在LED绿光下,经18天培养后,采收紫球藻细胞,利用气相色谱法分析其脂肪酸组成,结果见表1。由表1可知,紫球藻所合成的主要脂肪酸是二十碳五烯酸(EPA/C20∶5(ω-3))、花生四烯酸(ARA/C20∶4(ω-6))、亚油酸(LA/C18∶2(ω-6))和棕榈酸(PA/C16∶0)。此外,实验结果表明,不同氮浓度会明显影响紫球藻某些脂肪酸的合成。如,在缺氮条件下,紫球藻有利于棕榈酸和亚油酸的合成。但是,随着培养基氮浓度的升高,紫球藻油脂中棕榈酸和亚油酸的比例呈下降趋势;相反的是,ARA和EPA的比例则呈上升趋势。Breuer等[22]和Asgharpour等[23]研究也表明,在缺氮的条件下,紫球藻倾向合成棕榈酸和亚油酸,不利于ARA和EPA的积累。Hu等[21]考察氮磷胁迫对紫球藻脂肪酸合成的影响,结果发现紫球藻在氮充足和磷限制的条件下可提高ARA和EPA的合成。这些已有的研究和本研究的结果都可表明,氮浓度水平可调控紫球藻机体某些特定脂肪酸的合成。因此,从紫球藻脂肪酸组成上,高氮(1.5 g/L)有利于紫球藻合成ARA和EPA。
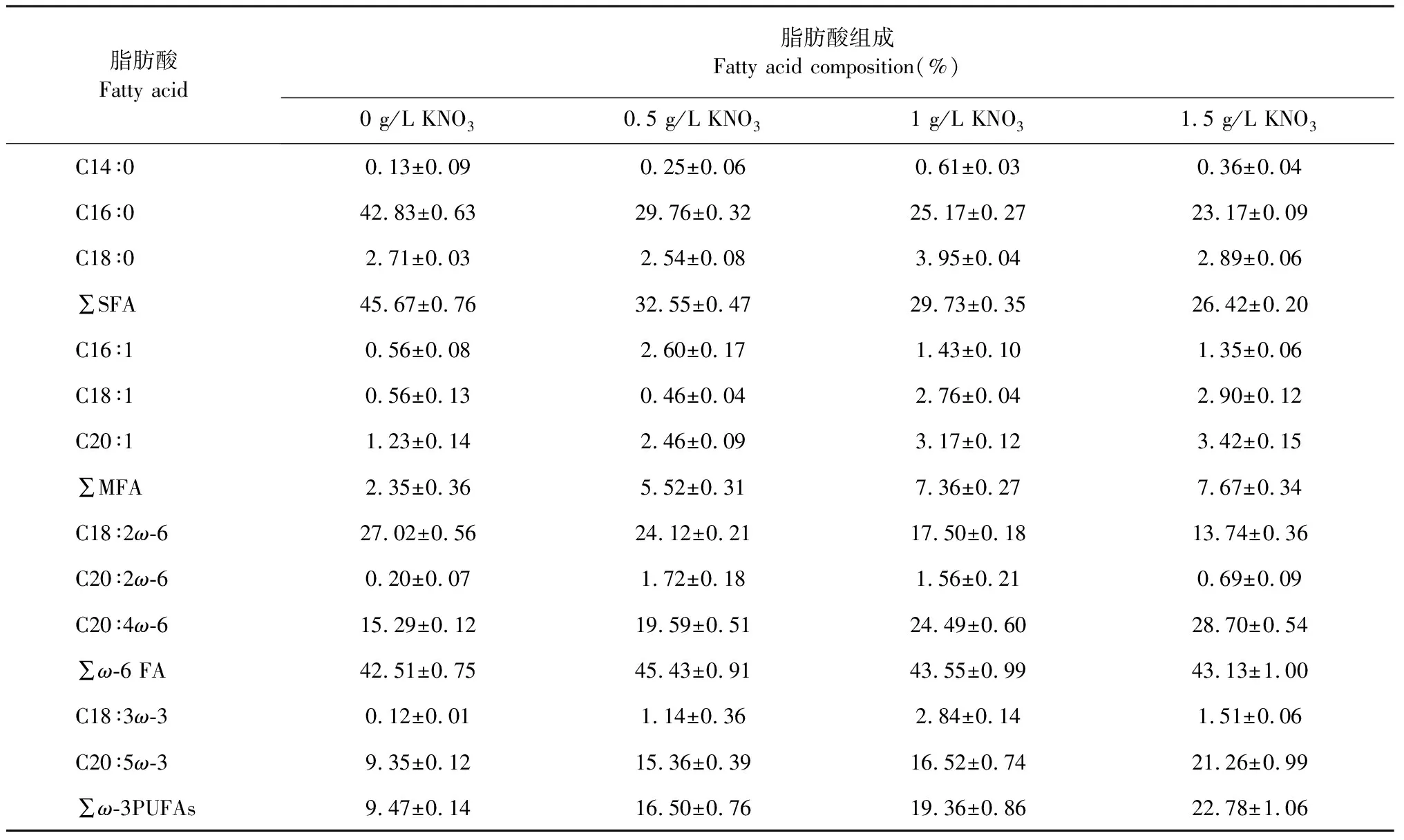
表1 紫球藻在不同氮浓度实验组培养18天后的脂肪酸组成Table 1 Fatty acid composition of P.cruentum after cultivation for 18 days under the different nitrogen concentrations media treatments
2.5 不同氮浓度条件下的紫球藻生物产量和活性物质产量
经培养18天后,分析不同氮浓度条件下的紫球藻生物产量和活性物质产量,结果见图5。在紫球藻生物产量方面,在氮浓度为1 g/L条件下培养紫球藻可获得最大生物产量为150 mg/(L·d)。在藻胆蛋白产量方面,紫球藻在1 g/L和1.5 g/L的氮浓度下可获得最大APC和R-PC产量;对于B-PE,紫球藻B-PE产量随氮浓度的升高而升高。在胞外多糖产量方面,紫球藻获得最大胞外多糖所需的氮浓度为1.5 g/L;但是,氮浓度为1 g/L和1.5 g/L下的紫球藻胞外多糖产量则无显著差异。对于ARA产量方面,紫球藻在1 g/L和1.5 g/L的氮浓度下获得的ARA产量无显著差异,但显著高于其他氮浓度下的值。EPA产量的变化趋势与ARA产量趋势是一致的。因此,基于图5的结果,为了节省培养成本,选择氮浓度为1 g/L作为紫球藻FJ-12培养的最佳氮浓度,不仅有利于紫球藻细胞的生长,还可以促进藻胆蛋白、胞外硫酸酯多糖和PUFAs活性产物的联产协同合成,克服了现有技术调控紫球藻合成多种活性物质的瓶颈问题。
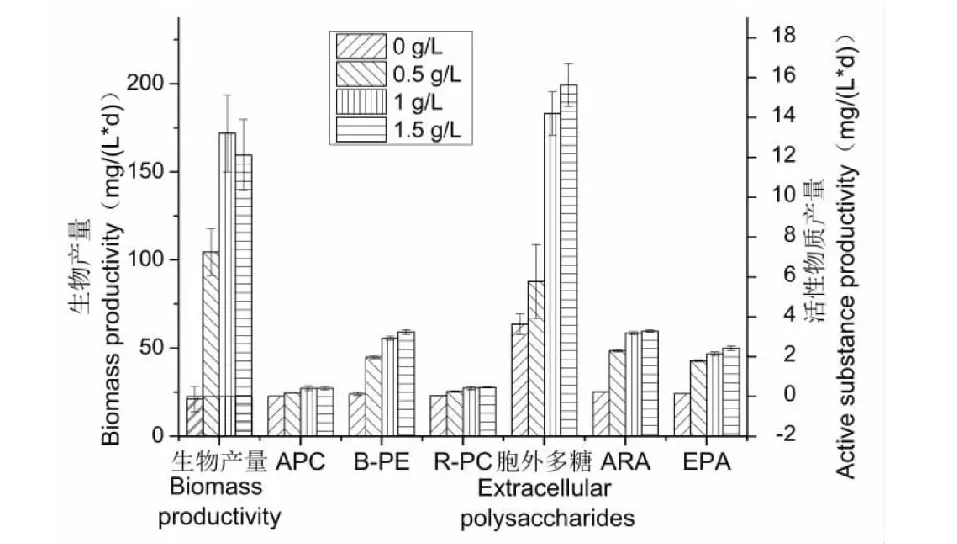
图5 不同氮浓度条件下的紫球藻生物产量和活性物质产量Fig.5 Biomass and active substance productivity of P.cruentum under different nitrogen concentrations
在LED绿光条件下,探究了不同氮浓度(0、0.5、1和1.5 g/L)对紫球藻细胞的生长和活性产物合成的影响。实验结果表明:紫球藻细胞在氮浓度为1 g/L条件下可获得最大的生物量(3.09 g/L);在氮浓度为1 g/L和1.5 g/L条件下,紫球藻细胞可获得较高的APC、B-PE、R-PC、胞外多糖、ARA和EPA浓度和产量。此外,与其他前人研究不同的是,本研究在LED绿光条件下,紫球藻在高氮浓度条件下所合成的这些活性物质不会出现下降趋势,可实现紫球藻联产协同合成藻胆蛋白、胞外硫酸酯多糖和PUFAs,为规模化养殖紫球藻多联产开发生物活性物质提供实践依据。

