自建Tg.C57-ras V1.0小鼠模型与日本Tg.rasH2小鼠遗传学及其杂交1代生物学特性比较*
刘甦苏 曹 愿 杨艳伟 王辰飞 王三龙 范昌发
(1.中国食品药品检定研究院实验动物资源研究所,北京 102629)(2.中国食品药品检定研究院国家药物安全评价监测中心,北京 100176)
致癌实验是创新药物安全性评价和上市风险控制的重要组成部分。传统的评价方法是采用两年期大、小鼠致癌性实验。1997年,人用药品注册技术规定国际协调会(ICH)会议提出了致癌实验新框架(ICH S1B),要求在一项长期啮齿类动物实验的基础上,可选择转基因致癌模型进行致癌实验。目前这种新的评价方法已获得美国、欧盟、日本等管理部门的认可[1-4],我国也在2010年提出了建议使用替代方法的致癌性实验指导原则[5],常用的小鼠模型为日本实验动物中心研究所建立的Tg.rasH2[6-10]。通过代理机构从日本购买该模型,存在价格高、供应周期长等弊端,间接增加药物研发成本,延缓国内创新药物发展。本单位从2004年开始筹备建立该致癌模型,2010年基本构建成功[11]后陆续开展背景数据分析[12-17]、保种技术研究[18]等多项工作,并于2013年获得国家发明专利(专利号:ZL 2008 1 0101666.0.)[19]。构建该模型不仅用于基础研究,而且拟在中国建立具有自主知识产权的,符合ICH的药物致癌实验替代方法,推动我国该领域替代方法的建立。
本单位Tg.C57-rasV1.0和日本Tg.rasH2小鼠模型均采用传统的转基因方法获得,因而模型的遗传学特性是比较关注的问题[20]。其次,鉴于实验动物的生物学特性是药物临床前长期毒性研究中必须观测的项目,且基因改造及繁育饲养条件的不一致,有必要将两种模型的相关生物学特征进行测定分析[21-23]。由于自发肿瘤是该转基因动物模型应有的特性,但是自发肿瘤过高,必然会影响其应用。在实际安全性评价中,使用的是ras转基因动物与BALB/c杂交F1代,以降低自发肿瘤的背景值,生物学特性比较使用的是自主建立的Tg.C57-ras转基因小鼠与BALB/c小鼠的杂交 1 代小鼠(简称CB6F1-NIFDC)与日本Tg.rasH2转基因小鼠模型杂交 1 代小鼠(简称CB6F1-CIEA),为国内药物安全评价机构提供多元化的选择,以期推动我国自建致癌性小鼠模型的应用。
1 两种模型遗传学特性比较
1.1 模型的构建方式
日本科学家首先通过转基因方法将人源的c-Ha-ras基因导入小鼠胚胎中,建立了ras基因的小鼠模型,命名为Tg.rasH2。该转入基因是通过将膀胱癌和黑色素瘤病人激活突变的c-Ha-ras进行拼接操作得到,仅最后一个内含子有突变,有自己的启动子和增强子(图1A)。另外,日本模型是在DBA/2和C57BL/6小鼠品系的杂交胚中进行转基因操作,产生并获得8只首建鼠,其中2只存活。初步比较后,选择其中2系作为模型的首建鼠,并将首建鼠与C57BL/6J品系进行超过10代的回交,使其与C57BL/6J回交纯度达到99.5%后开始大规模生产,目前使用的为C57BL/6J品系的Tg.rasH2小鼠模型[24-26]。
本单位从2004年开始,参照日本模型设计思路,构建了人源的c-Ha-ras的转基因小鼠模型,命名为Tg.C57-rasV1.0。该模型同样使用转基因方法构建,PCR方法克隆人的原癌基因c-Ha-ras,含有4个外显子和该基因本身的启动子、调控序列和polyA信号序列[11](图1B)。转入基因在原核注射后的整合率达到1.6%,共得到6只首建鼠,其中3只成活,筛选后选择3系保种繁殖。目前,已获得10余代仍能稳定遗传和表达c-Ha-ras基因的致癌性小鼠[12]。

图1 我国Tg.C57-ras V1.0与日本Tg.rasH2致癌性转基因小鼠的转基因结构策略注:MM: 来自于黑素瘤患者的人源c-Ha-ras基因片段(Bam HI)该患者的61号密码子发生了突变。BB: 来自于膀胱癌患者的的人源c-Ha -ras基因片段(Bam HI)片段,患者的12号密码子发生了突变;MB:MM和BB没有突变的重组基因,MB基因被用来构建Tg.rasH2小鼠模型;★指在基因最后的内含子突变的位置Fig.1 Transgenic structure strategy of Tg.C57-ras V1.0 and Japanese Tg.rasH2 transgenic miceNote: MM: a human c-HRAS gene (Bam HI fragment) derived from a patient with melanoma carrying the mutation at codon 61. BB:a human c-HRAS Bam Hl gene fragment derived from a patient with urinary bladder carcinoma carrying the mutation at codon 12.MB: the recombinant of MM and BB with no mutation at codons 12 and 61. The MB gene was introduced to create the original rasH2 mouse.
1.2 拷贝数分析
c-Ha-ras基因的拷贝数对于模型的遗传稳定性和致癌性评价功能非常重要[27]。根据Suemizu[28]报道,日本模型的拷贝数通过PCR方法一共转入3个拷贝基因,并在15号染色体E3区以从头到尾的方式排列,且有自己的启动子和增强子。
根据文献报道采用Real-time PCR方法,可以更加迅速的鉴定拷贝数。根据标准曲线方程,通过各样本c-Ha-ras和GAPDH的Ct值分别计算出各自的初始模板数(NRAS和NCAPDH),经计算,目前保留的转基因3系小鼠的拷贝数为4[14]。
1.3 mRNA表达水平及蛋白表达水平
1.3.1两种模型不同组织转入基因,mRNA水平结果:转基因沉默,即不能正常表达或者表达量过低,是建立转基因模型过程中常见的现象,也是转基因模型建立失败的重要原因[29-30]。分别选取8周龄小鼠3只,解剖其主要目的脏器,结果表明转入基因在两种小鼠的心、肝、脾、肺、肾以及前胃6种组织器官中具有相似的mRNA表达谱,均在肺脏表达最高,而在心脏表达最低;肺脏中,日本模型表达量高于自建模型,其他脏器表达量相当(图2A)[12]。
1.3.2两种模型肺组织转入基因,蛋白表达水平结果:mRNA水平两模型转入基因在肺组织中表达最高,因此选取肺组织检测蛋白表达并进行灰度扫描,内参GAPDH校正,衡量蛋白表达水平。CB6F1-CIEA小鼠的灰度值(96.4±9.9)、CB6F1-NIFDC小鼠的灰度值(63.4±1.5),野生型小鼠的灰度值(25.7±1.8)。两种转基因小鼠与野生型的表达差异均有统计学意义(P<0.01)。蛋白结果及灰度统计结果见图2B。
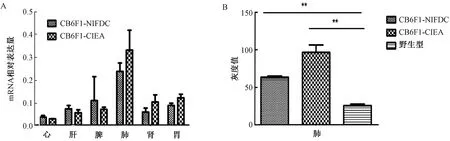
图2 转入基因在两种小鼠组织器官中的mRNA及蛋白水平表达注:**P<0.01:两种转基因小鼠与野生型小鼠的表达差异极显著Fig.2 mRNA and protein expressions of the transferred gene in 2 kinds of mouse tissues and organsNote:**P<0.01, the expression difference between the two transgenic mice and the wild type was very significant
2 两种模型的生物学特性比较
2.1 模型生长曲线
鼠的生长发育性能是动物饲养管理和健康状况的重要指标。本研究中测定的是致癌实验中使用的是c-Ha-ras阳性小鼠与BALB/c小鼠的杂交一代。Yamamoto等[31]测定了日本模型55周的生长曲线(图3A),基因阳性的雄性和雌性鼠分别是野生型小鼠体质量的80%~90%。另外,Nambiar等[32]报道辉瑞公司的研究数据表明,6个月的致癌实验中,Tg.rasH2雄性小鼠和雌性小鼠的平均初始体质量分别为24.7 g和19.6 g,最终体质量分别为28.4~34.5 g和22.9~25.1 g。
关于自建模型,本实验室也选取雌雄小鼠各20只,测定其离乳后的体质量共24周,具体生长曲线见图3B所示。比较两种模型的生长曲线数据,生长趋势一致。另致癌实验所用的雄雌鼠的平均初始体质量分别为24.2 g和18.3 g,与日本小鼠差别不大。

图3 两种模型的生长曲线注:A,CB6F1-CIEA小鼠及同窝野生鼠的生长曲线,参考Yamamoto等[31];B,CB6F1-NIFDC小鼠及同窝野生输的生长曲线Fig.3 Growth curves of two modelsNote:A,The growth curve of CB6F1-CIEA mice and wild mice in the same nest, modified from Yamamoto et al.[31];B,Growth curve of CB6F1-NIFDC mice and wild mice in the same nest
2.2 血液生理数据
根据Sehata等[33]数据显示日本模型心、肺、肝、脾、肾、肾上腺、睾丸、卵巢等主要脏器脏体比、血液化学和血液学与阴性小鼠没有显著差异。对于自建模型,本单位也多次测定及比较脏器质量及血液生理生化指标,包括22项血液生理学指标及12 项血液生化指标。其中,雌性阳性鼠和阴性鼠的嗜中性粒细胞(NEUT)及嗜中性粒细胞百分比(NEUT%),差异显著(P<0.05),血小板压积(PCT)差异极显著(P<0.01),其余19 项无显著性差异(P>0.05)。雌性阳性鼠和阴性鼠的12项生化指标均差异不显著(P>0.05);雄性中,丙氨酸氨基转移酶(ALT)和甘油三酯(TG)差异显著(P< 0.05),其余10项差异不显著(P>0.05),具体见前期研究[13-15]。
3 讨论与展望
近几年来,随着新药研发项目增加,国内药物安全评价机构对致癌性小鼠模型的需求不断增加[34-35]。我国拥有自主知识产权的致癌动物模型非常必要。为推动国内基于转基因小鼠模型的致癌实验平台加快发展,自建Tg.C57-rasV1.0小鼠模型与日本Tg.rasH2小鼠进行了比较。遗传学特性:自建与日本模型均是通过转基因方法构建,拷贝数分别是4和3,转入基因c-Ha-ras在不同脏器的mRNA水平表达趋势相似,肺组织中蛋白水平表达无统计学差异。生物学特性:两种模型的生长曲线,特别是致癌实验所需周龄的小鼠平均初始体质量差别不大。另外,两种模型和同窝转基因阴性动物相比较,其血液生理、脏器和脏器系数相差不大,这有利于模型将来在临床前安全评价中应用。虽然近几年来,国内市场采用我国致癌性转基因模型呈上升趋势,但实例较日本的少很多,背景数据不及日本模型丰富。
通过进一步文献查阅,Tamaoki[36]报道日本模型构建时采用的是DBA/2和C57BL/6小鼠品系的杂交胚,如果回交不充分,会导致模型遗传背景不纯,从而降低了实验数据的质量。本单位自建模型为C57BL/6的背景,小鼠种群不经过回交,用于药物致癌实验的动物遗传背景一致,减少了个体差异对结果的影响,是一种有实际意义的改进。
众所周知,采用转基因方式构建的小鼠模型存在一定程度的不足,主要表现在其外源基因在模型中遗传和表达的稳定性较差,需要通过不间断遗传监测来维持种群遗传稳定性。目前,基于干细胞打靶技术在编辑复杂基因领域已经获得长足进步[37]。本单位已获得基于干细胞打靶技术建立的致癌性模型,相较于日本Tg.rasH2小鼠模型,吸取其优势,例如:与日本模型插入基因序列c-Ha-ras的拷贝数、基因位点以及小鼠的遗传背景均一致。按照现代遗传学认知,可以推测新构建的模型具有与日本Tg.rasH2小鼠相似或者相同的表型。本研究采用定点插入技术,摒弃了转基因动物模型遗传稳定性差,个体差异较大的缺点,新建的模型称为致癌性模型KI.C57-rasV2.0,是原有Tg.C57-rasV1.0致癌性小鼠的升级版模型。新的致癌模型已经由本单位安评中心及国内多家安评中心展开联合验证,实现有动物模型可用、有技术标准可查、有关键技术可用及有背景数据可考的新局面[38],并满足我国药物安全性评价、药品检定及新药创制中对此类遗传修饰模型的需要。

