二次铝灰酸浸制备聚合氯化铝的研究
晁曦,张廷安,张宇斌,吕国志,陈杨
(1.东北大学多金属共生矿生态化冶金教育部重点实验室,沈阳 110819;2.沈阳铝镁设计研究院有限公司,沈阳 110001)
1 概述
铝灰是铝冶炼过程所产生的固体废弃物,是金属铝与其他含铝化合物的混合物[1-3],由于其中包括少量重金属元素、氟化物等毒性物质,因此属于危险废弃物。根据原料来源与生产工艺不同,其化学成分也有所差异,有Al、Al2O3、AlN和其他金属氧化物等,其中铝元素含量可以占到10%~80%[4-5]。随着国内电解铝行业的快速发展,每年铝灰产量已达到112~180 万吨,所以,经济有效地回收综合利用有巨大的价值[6-8]。
处理铝灰通常包括2 部分:一是提取其中的金属Al,该部分渣又被认为“一次铝灰”,其中Al 元素质量分数为15%~75%,一般为灰白色,也被称为“白铝灰”,常通过炒灰等方法提取金属Al[9-10]。炒灰法主要过程是将铝灰与一定量的盐熔剂加入到铁锅中,利用铝灰自身氧化所放出的热量供热,用铁锹翻炒,同时铝灰中的镁等物质继续氧化放热,进而使金属铝熔化汇集到铁锅底部,熔融的铝水可以从底部流出进一步回收[11];二是对一次铝灰再次处理,被认为“二次铝灰”,其中Al 元素大约在7%~30%,一般呈现为灰黑色,也被称为“黑铝灰”,该部分铝灰中95%以填埋的方式处置,综合利用率较低[12-14]。
目前,我国对于铝灰的处理技术仍处于初级阶段,主要的处理方式有堆存、填埋和资源化利用等,由于其中还存在硒、砷、钡、隔、铬、铅等有害元素,大量堆存与填埋不仅浪费土地还会破坏生态环境[15]。资源化利用提取其中的金属Al 及其他化合物常用技术有湿法和火法[16-17]。桓书星等对二次铝灰先钙化煅烧后溶出提取Al2O3进行探究,得出当CaCO3与铝灰质量比1∶1、1 000 ℃下煅烧时间90 min 时,煅烧渣的主要成分是Ca12Al14O32F2,当煅烧渣在NaOH 浓度160 g/L、Na2CO3浓度66.67 g/L、85℃条件下溶出45 min 时,Al2O3的浸出率达到最大值79.22%[18]。杨娜等探究利用H2SO4从铝灰中浸取Al,得出结论:2.0 mol/L H2SO4、铝灰粒径80 μm、反应物配比n(H2SO4)/n(Al)=1.95、100 ℃条件下浸出120 min 时,铝浸出率达到较优的87.5%[19]。Wang Jianhui 等研究利用加入冰晶石后高温焙烧的火法技术脱除二次铝灰中的AlN,通过模型计算与实验得到较优实验条件:当加入17.7%质量分数的冰晶石,在750 ℃下焙烧194 min 时,二次铝灰的脱氮率最高94.71%,尾渣中含0.55%的AlN[20]。
聚合氯化铝(PAC)是一种高分子絮凝剂,由于其分子结构特殊,具有较强的吸附性。与传统的絮凝剂相比较,具有沉淀性较好、适用pH 值范围广等优点。PAC 产品可以作为一种净水剂,能有效去除水中的重金属离子,被广泛应用于水处理领域[21]。目前,我国用于水处理领域的PAC 年用量约为5×105t,并且随着净水要求的不断提高,PAC 的年用量逐年增大[22]。
以经过炒灰后的二次铝灰为原料,通过水洗、盐酸浸出、固液分离、添加铝酸钙等过程得到聚合氯化铝溶液,可以用于饮用水、工业用水与污水处理领域,实现铝灰中铝的回收循环利用,既降低了铝灰堆存对环境造成的污染与危害,又能缓解铝土矿资源压力。
2 实 验
2.1 实验原料
原料产生于某铝厂熔铸过程,是经过炒灰提取金属Al 之后的二次铝灰,经过研磨、筛分后过270 μm检验筛,筛下物用于实验研究,其化学成分由XRF 测定,结果如表1 所列。图1 所示为原料XRD 图,分析可得其主要组成为刚玉、镁铝尖晶石、AlN 以及金属Al。

表1 铝灰原料的化学成分组成Table 1 Chemical composition of aluminum dross raw materials 单位:质量分数,%
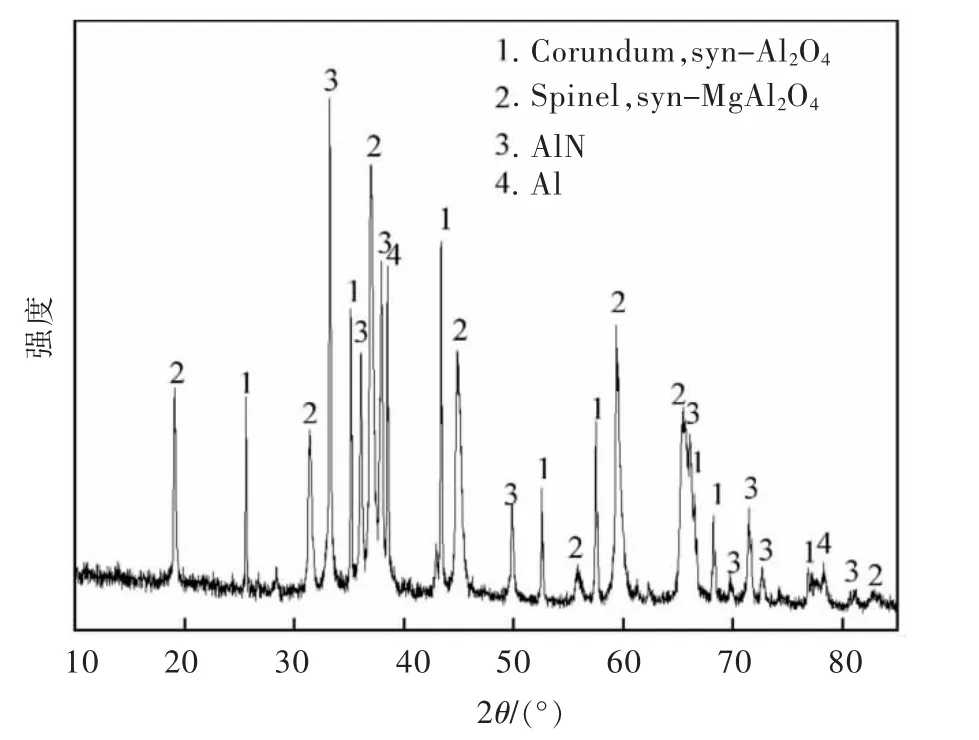
图1 铝灰原料XRD 谱Fig.1 XRD pattern of aluminum dross raw material
2.2 实验所用试剂及仪器
试剂:分析纯盐酸(HCl)、分析纯铝酸钙(CaO·Al2O3)。
仪器:棒磨机RK/ZQM(BM)、恒温磁力搅拌器T09-1S、数显恒温水浴锅HH-6、DSX-120 数显搅拌机、pHSJ-3F 型pH 计。
2.3 实验方法
先将经过棒磨筛分后的二次铝灰水洗过滤后烘干,然后称取20 g 干燥的铝灰倒入烧杯中分别加入不同浓度的HCl 溶液置于恒温水浴锅中,在不同条件下实验,抽滤使固液分离,最后用去离子水冲洗滤饼至洗液呈中性后烘干,将浸出液倒入干净的锥形瓶中并加入不同质量的铝酸钙置于恒温水浴锅中在不同的反应温度、反应时间下制备液体聚合氯化铝,具体工艺流程如图2 所示。
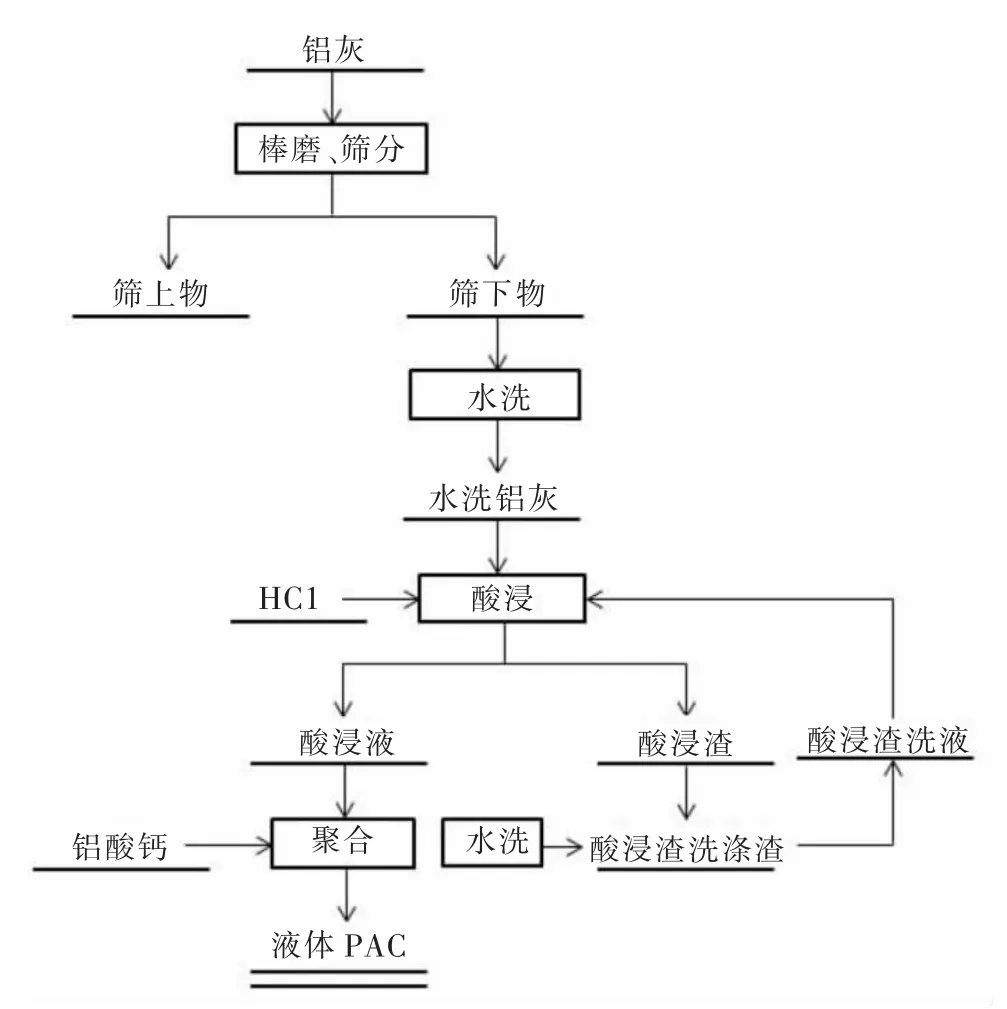
图2 铝灰酸浸制备聚合氯化铝工艺流程Fig.2 Process flow chart of polyaluminum chloride prepared by aluminum dross acid leaching method
液体PAC 产品中各项指标标准参照生活饮用水用聚氯化铝GB 15892—2009[23],如表2 所列。

表2 生活饮用水用液体聚合氯化铝(PAC)产品国标Table 2 National standard of liquid polyaluminum chloride(PAC)products for drinking water
2.4 实验原理
经过水洗后的铝灰中的Al 主要以刚玉、镁铝尖晶石、少量AlN、金属Al和Al(OH)3等形式存在,这些物质可以与HCl 溶液反应得到AlCl3溶液,主要反应如下:随着反应进行,体系中OH-浓度增大使其pH 值升高,AlCl3溶液发生水解,反应如下:
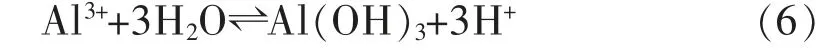
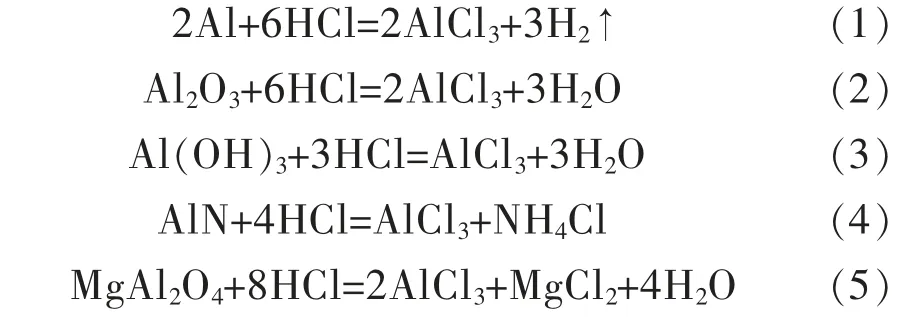
随着水解反应的发生,Al(OH)3与HCl 继续反应,溶液pH 值升高,相邻的2 个羟基之间产生架桥作用生成聚合氯化铝溶液[24-25],酸浸液中添加CaO·Al2O3既增加了其中铝含量,又消耗了体系中多余的盐酸,提高了其pH 值,促进了聚合氯化铝的生成,反应如下:
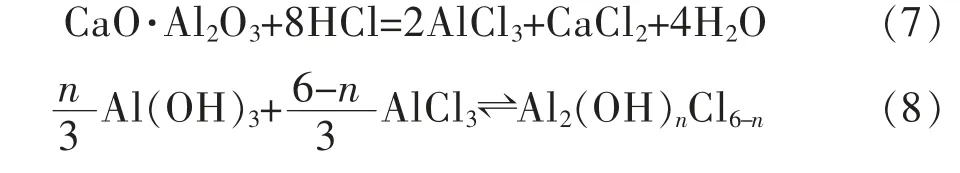
3 实验结果与讨论
3.1 二次铝灰酸浸
3.1.1 HCl 浓度对二次铝灰中铝浸出率的影响
在浸出温度85 ℃,时间2 h,搅拌速度200 r/min,加入铝灰20 g,HCl 溶液∶铝灰=6∶1 mL/g 的条件下考察了2,4,6,8,10 mol/L 的HCl 溶液对二次铝灰中Al 浸出率的影响,结果如图3 所示。
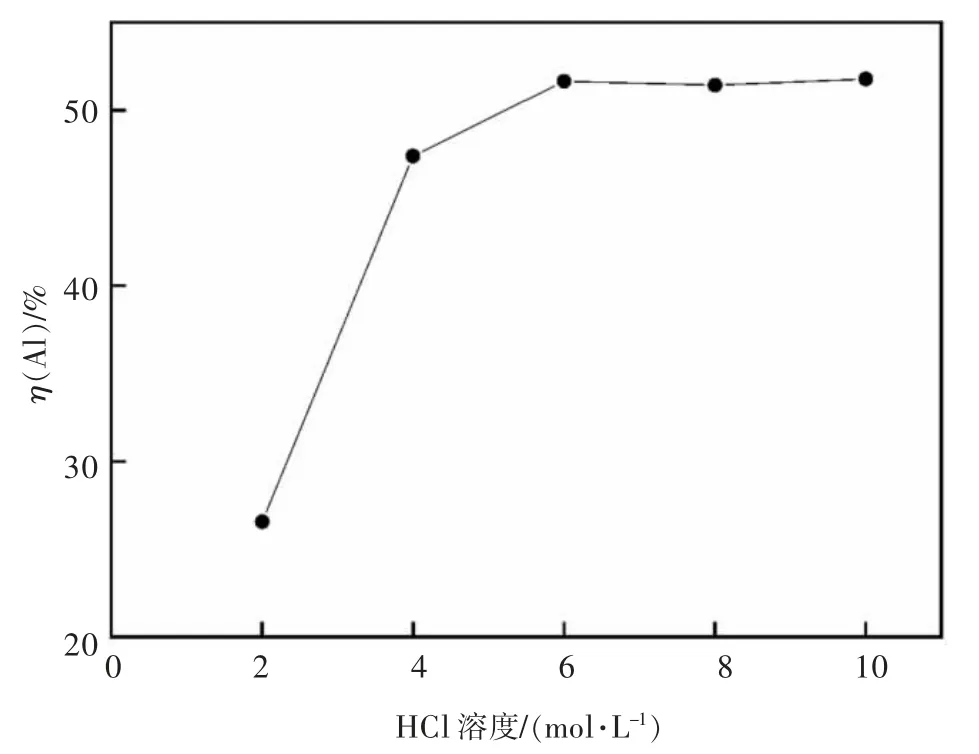
图3 HCl 浓度对二次铝灰中铝的浸出率的影响Fig.3 The effect of HCl concentration on the leaching rate of Al in the secondary aluminum dross
由图3 可知,随着HCl 浓度增大,Al 的浸出率先上升后逐渐趋于平稳,这是由于HCl 浓度较低时发生化学反应的能力弱,HCl 浓度从2 mol/L 增大到6 mol/L,铝的浸出率从26.6%提高到51.6%,之后再提高HCl 浓度影响不大,说明反应达到一定程度,不再受酸浓度所限制。
3.1.2 酸浸温度对二次铝灰中铝浸出率的影响
在HCl 浓度6 mol/L,浸出2 h,搅拌转速200 r/min,加入铝灰20 g,HCl 溶液∶铝灰6∶1 mL/g 时,探究了酸浸温度对浸出Al 的影响,结果如图4 所示。
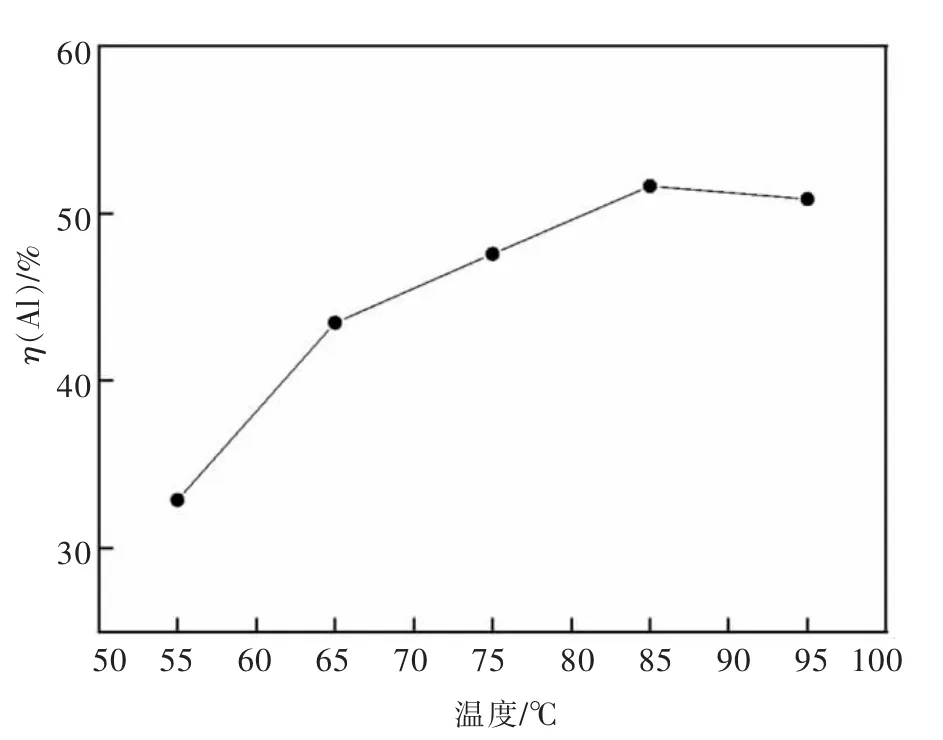
图4 酸浸温度对二次铝灰中铝浸出率的影响Fig.4 The effect of acid leaching temperature on the leaching rate of Al in the secondary aluminum dross
由图4 可知,随温度升高铝灰中的铝更容易被浸出,在85 ℃浸出率达到最大51.6%。这是由于温度升高加快反应速率,提高了HCl 反应率,当超过85 ℃会加速HCl 溶液挥发使浸出率稍有降低。
3.1.3 酸浸时间对二次铝灰中铝浸出率的影响
在HCl 浓度6 mol/L,浸出温度85 ℃,搅拌转速200 r/min,加入铝灰20 g,HCl 溶液∶铝灰=6∶1 mL/g时,探究了不同酸浸时间对浸出Al 的影响,结果如图5所示。
由图5 可知,浸出时间从1 h 延长到5 h,浸出率仅从46.4%上升到53.2%,这是由于铝灰中容易被HCl 溶液浸出的含Al 物相在2 h 内已接近反应完全,在反应时间3 h 时浸出率出现下降是由于反应体系中Al3+发生水解反应式(6),生成Al(OH)3沉淀进入浸出渣中导致浸出率降低,再次延长浸出时间水解平衡反应式(6)逆向移动,使溶液中Al3+含量增大,浸出率略有上升。
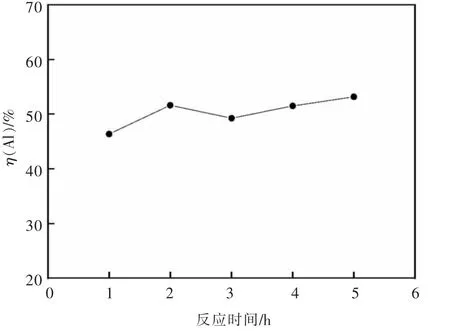
图5 酸浸时间对二次铝灰中铝浸出率的影响Fig.5 The effect of acid leaching time on the leaching rate of Al in the secondary aluminum dross
3.1.4 液固比对二次铝灰中Al 浸出率的影响
在HCl 浓度6 mol/L,浸出温度85 ℃,搅拌转速200 r/min,加入铝灰20 g,浸出2 h 时,探究了不同液固比(液体体积与固体质量之比)对浸出Al 的影响,结果如图6 所示。
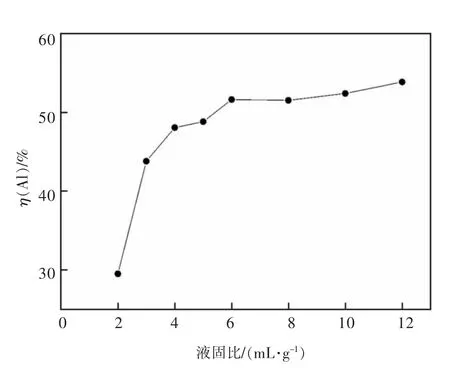
图6 HCl 溶液与铝灰液固比对二次铝灰中铝浸出率的影响Fig.6 The effect of liquid-solid ratio of HCl solution and aluminum dross on the leaching rate of Al in the secondary aluminum dross
由图6 可得,随着液固比从2 mL/g 增加到4 mL/g时,Al 的浸出率从29.5%明显提高至48.1%,再继续增加液固比,Al 的浸出率缓慢上升,并在液固比为12 mL/g 时达到了53.9%。这是由于随着液固比增大,参与反应的HCl 量增大,提高了固液接触,Al 更加容易被浸出,盐酸过量后其未出现明显升高,可能是反应达到限度。综合考虑,液固比加大会提高成本,因此选择液固比为4∶1 mL/g 作为适宜液固比。
3.1.5 二次铝灰酸浸渣的物相与微观形貌分析
对比原二次铝灰与酸浸渣XRD 图,如图7、图8所示,通过SEM 分析不同铝浸出率下的酸浸渣微观形貌,结果如图9 所示,对η(Al)=51.6%酸浸渣进行EDS 能谱分析渣中不同位置元素分布,结果如图10所示。
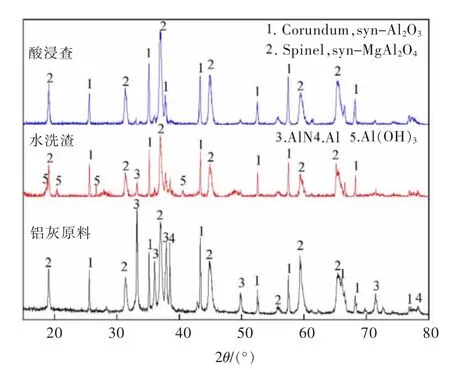
图7 二次铝灰经水洗和酸浸后的XRD 对比Fig.7 XRD pattern of the secondary aluminum dross after water washing and acid leaching
由图7 可以看出,水洗二次铝灰再经过酸浸之后,渣中AlN,Al(OH)3的衍射峰消失,主要组成为刚玉型Al2O3,MgAl2O4。由图8 可知,经过酸浸后渣中AlN和Al2O3的衍射峰随着Al 被浸出逐步削弱,直至浸出率达到51.6%时,AlN 的衍射峰不再出现,且所有酸浸渣中均未显示Al(OH)3的衍射峰。说明酸浸时HCl 溶液优先与铝灰中的AlN 及Al(OH)3反应,而刚玉型Al2O3与MgAl2O4结构较为稳定,难以参与反应。
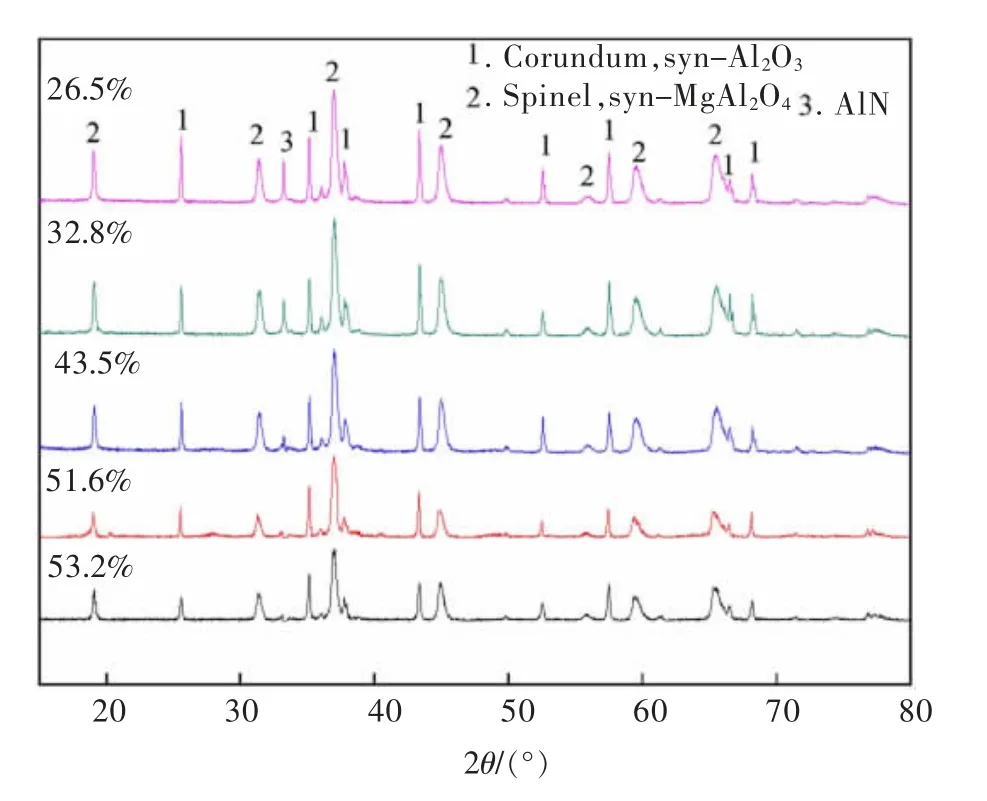
图8 不同铝浸出率下酸浸渣的XRD 对比Fig.8 XRD pattern of acid leaching slag with different aluminum leaching rate
由图9 可知,Al 浸出率越高,浸出渣表面被侵蚀的程度越大,表面由光滑变得粗糙多孔,颗粒尺寸增大,发生聚集。颗粒呈内外包裹结构,结合图10 中EDS 分析结果可知B 处Mg 原子占比较A 处更多,说明这是刚玉相在表面对内部的镁铝尖晶石相形成了包裹,且二者结构较为稳定,所以导致Al 的浸出率达到上限。


图9 不同浸出率下的酸浸渣SEM 像Fig.9 SEM pattern of acid leaching slag with different leaching rate
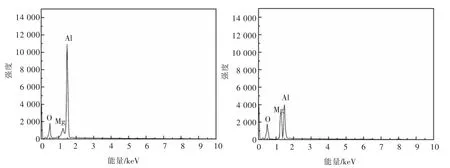
图10 η(Al)=51.6%酸浸渣的EDS 分析图Fig.10 EDS analysis pattern of η(Al)=51.6% acid leaching slag
3.2 铝灰酸浸液制备聚合氯化铝
本节实验以上述二次铝灰酸浸液(80 mL)为原料加入铝酸钙粉(CaO·Al2O3),选取液相获得条件:6 mol/L 的HCl 溶液80 mL 在85 ℃条件下浸出20 g二次铝灰原料2 h、搅拌转速200 r/min。
3.2.1 铝酸钙质量对液体PAC 各项指标的影响
在加入80 mL 二次铝灰酸浸液,85 ℃反应2 h,搅拌速度200 r/min 的条件下研究铝酸钙(CaO·Al2O3)质量对液体PAC 产品各项指标的影响,结果如图11、图12 所示。
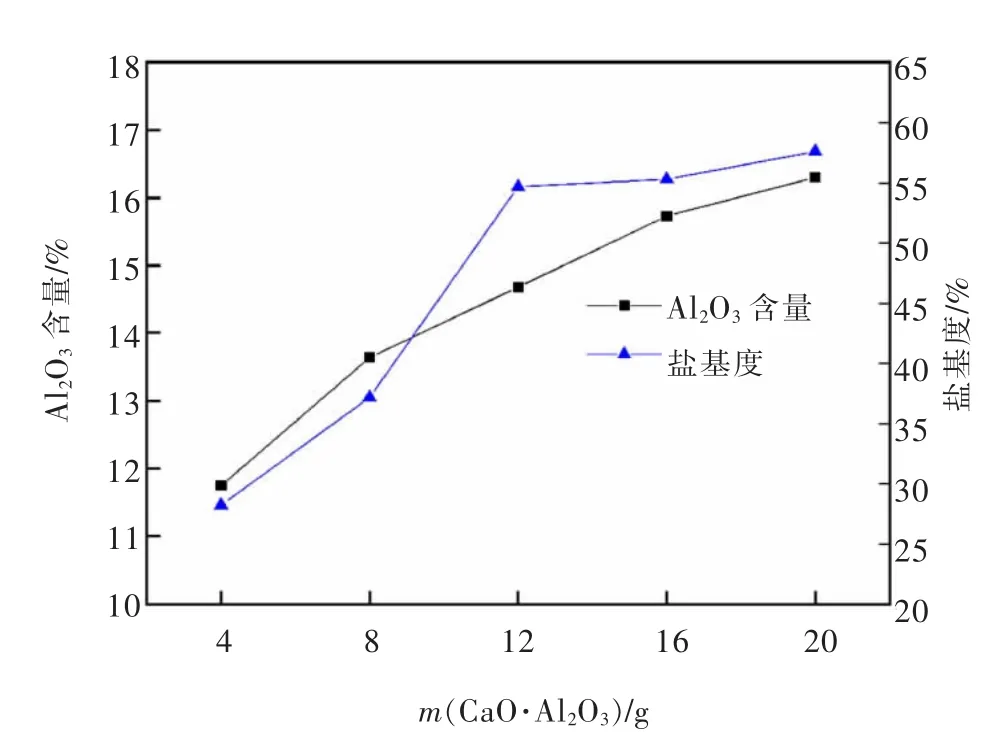
图11 CaO·Al2O3 质量对PAC 产品Al2O3 含量和盐基度的影响Fig.11 Effect of CaO·Al2O3 quality on Al2O3 content and basicity of PAC product
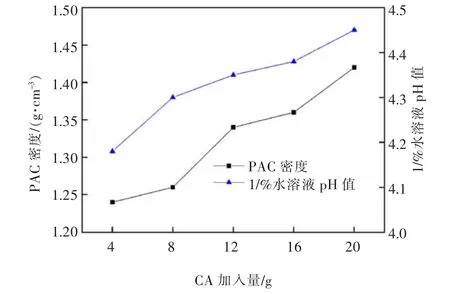
图12 CaO·Al2O3 质量对PAC 产品密度和1%水溶液pH 的影响Fig.12 Effect of CaO·Al2O3 quality on density and 1% aqueous solution pH of PAC product
由图11 可知,液体PAC 中Al2O3含量随CaO·Al2O3质量增加逐渐上升,盐基度随CaO·Al2O3质量增加先增大后趋于平缓。这是由于铝酸钙中更多的铝被溶于液相中参与反应,使Al2O3含量增大,同时溶液pH 值上升,二者上升速度逐渐趋于一致。但是对于生活饮用水用液体PAC,其中Al2O3含量并非越高越好,过高容易出现Al(OH)3悬浮物,使液体黏度增大,增大了液固分离难度。盐基度高意味着产品的絮凝效果好,净水能力强,但是过高时会降低其稳定性,影响净水效果。
由图12 可知,液体PAC 产品密度和1%水溶液pH 随CaO·Al2O3质量增加而增大。这是由于随着加入的铝酸钙增多,参与反应的固相量增大,液体PAC 中的Al2O3含量与盐基度增大,使其密度与pH 上升。参照生活饮用水用聚氯化铝国家标准[16],综合考虑,选择12 g/80 mL 铝酸钙的加入量为宜。
3.2.2 反应时间对液体PAC 各项指标的影响
在80 mL 铝灰酸浸液中加入铝酸钙12 g,反应温度85 ℃,搅拌转速200 r/min 时,探究了不同反应时间对液体PAC 产品各项指标的影响,结果如图13、图14 所示。
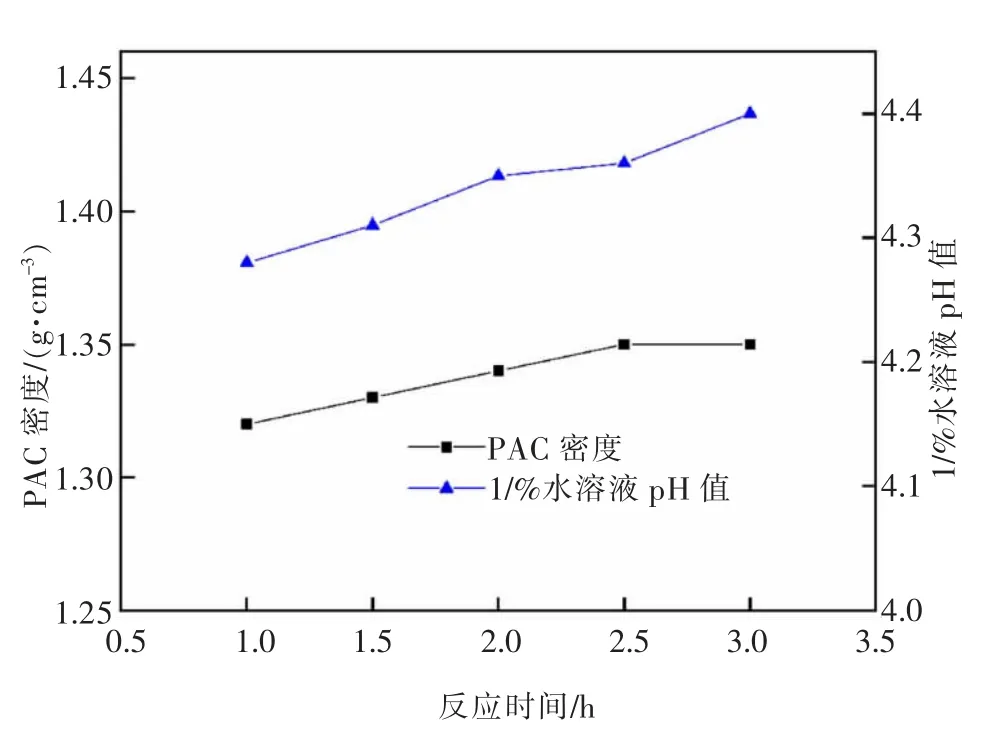
图14 反应时间对PAC 产品密度和1%水溶液pH 的影响Fig.14 Effect of reaction time on density and 1% aqueous solution pH of PAC product
由图13 可知,液体PAC 产品中Al2O3含量随着反应时间增加略有提高,说明时间不是主要控制因素。产品盐基度在反应1 h 到1.5 h 先升高后下降逐渐趋于稳定趋势,这是由于反应前期OH-浓度增大速度快,之后与Al3+浓度增大速度相当,使盐基度趋于稳定。
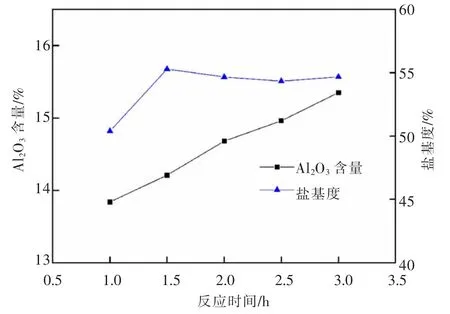
图13 反应时间对液体PAC 中Al2O3 含量和盐基度的影响Fig.13 Effect of reaction time on Al2O3 content and basicity of liquid PAC
由图14 可知,增加反应时间,液体PAC 产品密度整体变化不大,1%水溶液pH 略有上升,这是由于随着反应进行,消耗的HCl 增多,体系中的Al3+浓度略有增大,使产品密度与溶液pH 稍有增大。由于盐基度可以很好地反映出液体PAC 产品的聚合状态以及处理废水的能力,因此,选取1.5 h 为较优反应时间。
3.2.3 温度对聚合过程的影响
在80 mL 铝灰酸浸液中加入铝酸钙12 g,反应1.5 h,搅拌转速200 r/min 时,探究了不同温度对液体PAC 产品各项指标的影响,结果如图15、图16所示。
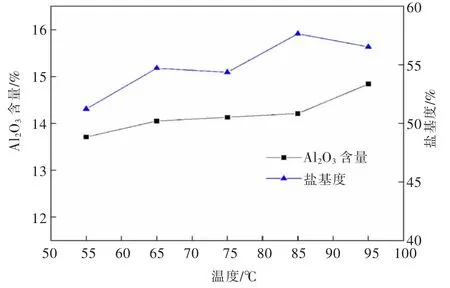
图15 反应温度对PAC 产品Al2O3 含量和盐基度的影响Fig.15 Effect of reaction temperature on Al2O3 content and basicity of PAC product
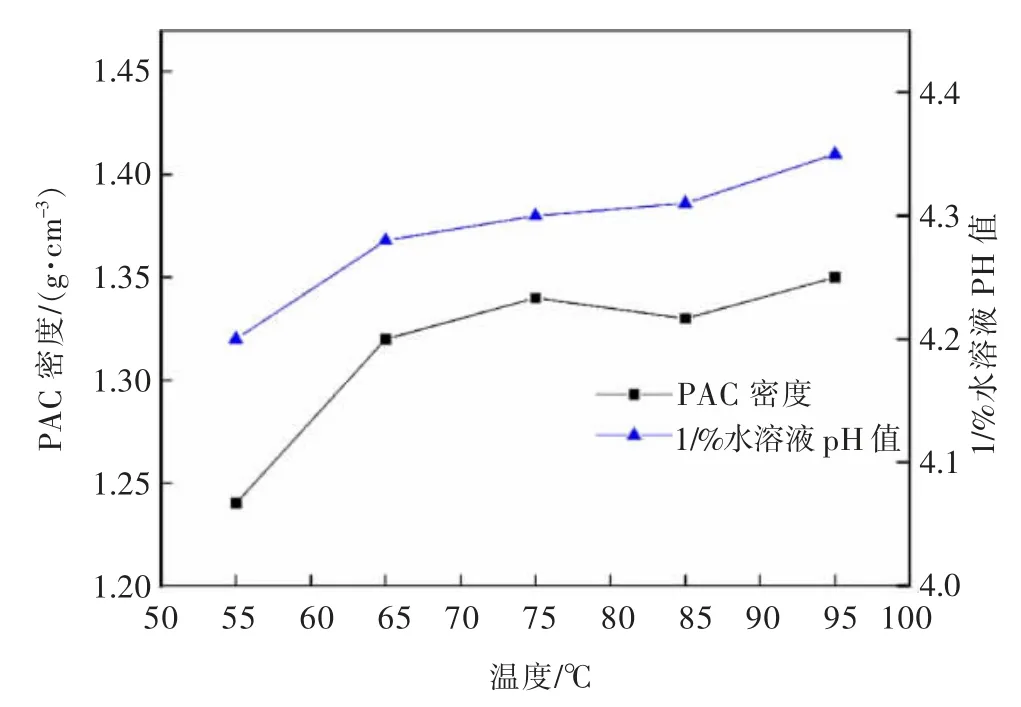
图16 反应温度对PAC 产品密度和1%水溶液pH 的影响Fig.16 Effect of reaction temperature on density and 1% aqueous solution pH of PAC product
由图15 可知,液体PAC 产品中Al2O3含量随反应温度升高而升高。这是因为温度升高提高了铝酸钙与溶液中HCl 的反应率,使溶液中Al3+浓度增大且pH 值升高,盐基度增大。但温度过高时会造成盐酸挥发,溶液浑浊,出现凝胶状氢氧化铝,增大固液分离难度且降低了产品盐基度。
由图16 可知,液体PAC 产品密度与1%水溶液pH 随着温度升高整体呈升高趋势,这是由于温度升高使反应率提高,液体PAC 中Al2O3含量增加从而增加了产品密度且消耗了多余的盐酸溶液增大了溶液pH。当反应温度较低时,产品盐基度较低,会影响其净水能力,当反应温度过高时,溶液中固体悬浮物较多,影响液体PAC 质量,因此,温度选择85 ℃为宜。
4 结论
1)二次铝灰酸浸过程中,当HCl 浓度6 mol/L,温度85 ℃,反应2 h,搅拌转速200 r/min,HCl 溶液体积∶铝灰质量为12∶1 mL/g 时,Al 浸出率达到最高53.8%,但考虑到经济成本,在酸浸液制备聚合氯化铝实验中选择酸浸液固比4∶1。酸浸渣的主要物相为刚玉和镁铝尖晶石,且呈现出刚玉包裹镁铝尖晶石的形态。
2)利用铝灰酸浸液制备聚合氯化铝实验中,制得的液体PAC 产品中Al2O3含量为11.75%~16.30%,盐基度为28.23%~57.58%,密度在1.24~1.42 g/cm3,1%水溶液pH 处于4.18~4.45。当每80 mL酸浸液中加入铝酸钙粉超过12 g 时,液体PAC 产品各项指标均达到生活饮用水用聚氯化铝国家标准。
3)铝灰酸浸液制备PAC 较优参数:铝酸钙12 g/80 mL 酸浸液,温度85 ℃,反应1.5 h,搅拌转速200 r/min,此时产品中Al2O3含量14.21%,盐基度55.29%,密度1.33 g/cm3,1%水溶液pH 值为4.31。

