亚氯酸钠和氢氧化钠两步预处理杨木制备低聚木糖和单糖
方 鑫,文沛瑶,徐 勇,张军华,2*
(1.南京林业大学 化学工程学院,江苏 南京210037;2.西北农林科技大学 林学院,陕西 杨凌712100)
随着人们生活品质的提高,以低聚木糖为主的益生性功能食品受到广泛关注。低聚木糖(XOS)具有降低血液胆固醇、维持肠胃健康、降低结肠癌风险等功效[1]。酶解法是定向酶解木聚糖制备低聚木糖的主要方法,该法清洁、温和,生产的低聚木糖纯度高、副产物少,可以减轻后续分离纯化的负担。预处理是酶解前的一个重要步骤,其目的是破坏木质纤维素的结构。传统的酶解法是首先通过预处理从生物质原料中提取木聚糖后再采用木聚糖酶水解制备低聚木糖。近年来,采用木聚糖酶直接水解预处理后的生物质原料制备低聚木糖逐渐成为热点。Wu等[2]研究了一种热稳定型重组木聚糖酶用于水解经过水热处理后的玉米芯,最终低聚木糖的产率最高为26.4%。Chang等[3]在超高压条件下预处理玉米芯后,再添加木聚糖酶水解,获得的低聚木糖得率较未处理原料提升了180.3%。但是,水热预处理和超高压预处理均需要在苛刻的条件下进行,对仪器设备要求高。此外,木质素还会通过物理阻碍和非生产性吸附作用降低酶对底物的可及度,抑制木质纤维原料糖化。亚氯酸钠预处理因反应条件温和、可选择性脱除木质素而被广泛报道[4-5]。研究发现,杨木经过亚氯酸钠预处理后,木质素脱除率高达70.3%,但底物中木聚糖的水解仍然受到限制。采用氢氧化钠在温和条件下进行第二步处理可有效促进木聚糖水解,提升木质纤维原料单糖得率[6]。然而,基于亚氯酸钠和碱预处理组合木聚糖酶法制备低聚木糖的相关研究较少。杨木作为一种生长快、分布广泛的阔叶材,其半纤维素主要为木聚糖,可用于制备低聚木糖。本研究采用亚氯酸钠和氢氧化钠两步预处理杨木,然后分别利用木聚糖酶和纤维素酶水解预处理后的杨木制备低聚木糖和单糖,考察不同预处理条件下杨木化学组分及结构特性的变化,探究两步预处理条件对低聚木糖和单糖得率的影响,以期为杨木的高价值化利用奠定理论基础。
1 材料和方法
1.1 材料、试剂与仪器
杨木来自于江苏宿迁,经粉碎后全部过筛,取粒径≤0.25 mm的部分经自然风干后储存在密封袋中备用。亚氯酸钠(纯度80%)和氢氧化钠(分析纯)购自上海阿拉丁生化科技股份有限公司。纤维素酶CTec2和内切β-1,4-木聚糖酶X2753(Aspergillusoryzae)均购自上海的Sigma-Aldrich公司,酶活分别为120.4 FPU/mL(每毫升170.8 mg酶蛋白)和2 500.0 U/g。木二糖、木三糖、木四糖、木五糖和木六糖标准样品购自Megazyme公司(爱尔兰)。
HC 800Y粉碎机;Agilent 1260高效液相色谱,Aminex Bio-Rad HPX-87H色谱柱和示差折光检测器,美国安捷伦科技有限公司;Dionex ICS-5000高效液相阴离子交换色谱,CarboPacTMPA-200色谱柱(250 mm×4 mm),美国赛默飞世尔科技公司;Quanta 200扫描电镜(SEM),美国FEI公司;UltimaⅣX射线粉末衍射(XRD)仪,日本Rigaku公司;AXISUltra DLD X射线光电子能谱(XPS)仪,英国Kratos公司。
1.2 亚氯酸钠预处理
取10 g(干质量)杨木和配置好的100 mL质量分数6%的亚氯酸钠水溶液,在250 mL的锥形瓶中混合后置于70℃的恒温水浴锅中分别反应0.5、1和3 h(SC0.5、SC1和SC3)。反应结束后,通过真空抽滤将固体残渣和预处理液进行分离。抽滤过程中用蒸馏水洗涤固体残渣至中性,置于-18℃冰箱中备用。每个条件进行2次平行实验。
1.3 氢氧化钠后处理
将5 g亚氯酸钠预处理后的杨木(SC0.5、SC1和SC3)和50 mL质量分数1%的氢氧化钠在100 mL的锥形瓶中混合,置于50℃的水浴锅中反应1 h[6],对应的预处理样品标记为SC0.5-SH、SC1-SH和SC3-SH。反应结束后,通过真空抽滤分离固体残渣和预处理液,用蒸馏水洗涤残渣至洗涤液接近中性后收集固体残渣,风干后置于-18℃冰箱中备用。每个条件进行2次平行实验。
1.4 木聚糖酶水解
分别以SC和SC-SH预处理后杨木为底物,在50℃、150 r/min的恒温水浴振荡器中进行木聚糖酶水解,分别以亚氯酸钠和氢氧化钠预处理后杨木为底物,底物质量浓度为20 g/L,酶用量为600 U/g(以底物质量计,下同),水解体系体积为5 mL,用50 mmol/L柠檬酸钠缓冲液维持体系pH值为4.8,反应时间48 h。酶水解结束后,离心(10 000 r/min,10 min)分离固体残渣和水解液。采用高效液相阴离子交换色谱测定水解液中的低聚木糖(XOS)含量,每个样品进行2次平行实验。
1.5 纤维素酶水解
纤维素酶水解实验在50℃、150 r/min的恒温水浴振荡器中进行,底物为亚氯酸钠和氢氧化钠预处理后且被木聚糖酶水解后的杨木固体残渣,底物质量浓度为20 g/L,酶蛋白用量为10、30和60 mg/g(以底物质量计,下同),水解体系体积为3 mL,用50 mmol/L柠檬酸钠缓冲液维持体系pH值为4.8,反应时间72 h。酶水解结束后,离心(10 000 r/min,10 min)分离固体残渣和水解液,采用高效液相色谱测定水解液中的单糖含量。每个样品进行2次平行实验。
1.6 分析方法
1.6.1化学成分分析原料和预处理后的固形物化学组成按照美国国家可再生能源实验室提供的分析方法进行分析[7]。预处理后固形物的回收率、固形物中各组分(葡聚糖、木聚糖、木质素)的移除率以及低聚木糖得率的计算公式见式(1)~(3):

式中:R—预处理后固形物的回收率,%;M1—预处理后固形物的质量,g;M2—预处理前固形物的质量,g;r—固形物中各组分(葡聚糖、木聚糖、木质素)移除率,%;m1—预处理前固形物中各组分(葡聚糖、木聚糖、木质素)的质量,g;m2—预处理后固形物中各组分(葡聚糖、木聚糖、木质素)的质量,g;Y—低聚木糖得率,%;m3—酶水解液中聚合度2~6的低聚木糖的质量,g;m4—预处理杨木样品中木聚糖的质量,g。
单糖的水解得率计算参照Hao等[1]的报道。其中葡萄糖和木糖的测定采用Agilent 1260高效液相色谱测定,流动相为5 mmol/L硫酸,流速为0.6 mL/min。酶水解液中低聚木糖(聚合度2~6)采用Dionex ICS-5000高效液相阴离子交换色谱检测,使用CarboPacTMPA-200色谱柱。
1.6.2SEM分析 采用Quanta 200扫描电镜观察实验样品的表面形貌。样品在成像前进行喷金处理,以增强其导电性。仪器的工作电压为25 kV。
1.6.3XRD分析 采用UltimaⅣX射线粉末衍射仪,以铜靶为X射线源,进行XRD分析并测定了样品结晶度(ICr)。扫描速率5(°)/min,并根据ICr=(I002-Iam)/I002×100%计算ICr。其中I002和Iam分别是最大(约22.5°)和最小(约18°)衍射峰强度。
1.6.4XPS分析 采用AXISUltra DLD X射线光电子能谱仪分析样品表面的元素组成和化学键分布。
1.6.5可及性分析采用刚果红染料(DR 28)吸附法,用Langmuir吸附等温线计算得到最大吸附容量(Γmax)代表样品对酶的可及性。将DR 28溶液(0.00、0.05、0.10、1.00、2.00、3.00和4.00 g/L)与10 g/L样品(0.06 g)在10 mL离心管中混合,混合物在150 r/min,50℃下吸附24 h。吸附反应结束后,离心分离上清液,在498 nm下测定吸光度并计算上清液中游离染料的浓度,以及底物对染料的吸附量。每个样品的吸附实验进行3次平行实验。
2 结果与讨论
2.1 亚氯酸钠预处理杨木的分析与表征
2.1.1化学组成未经预处理的杨木和亚氯酸钠(SC)预处理后的杨木组分如表1所示。
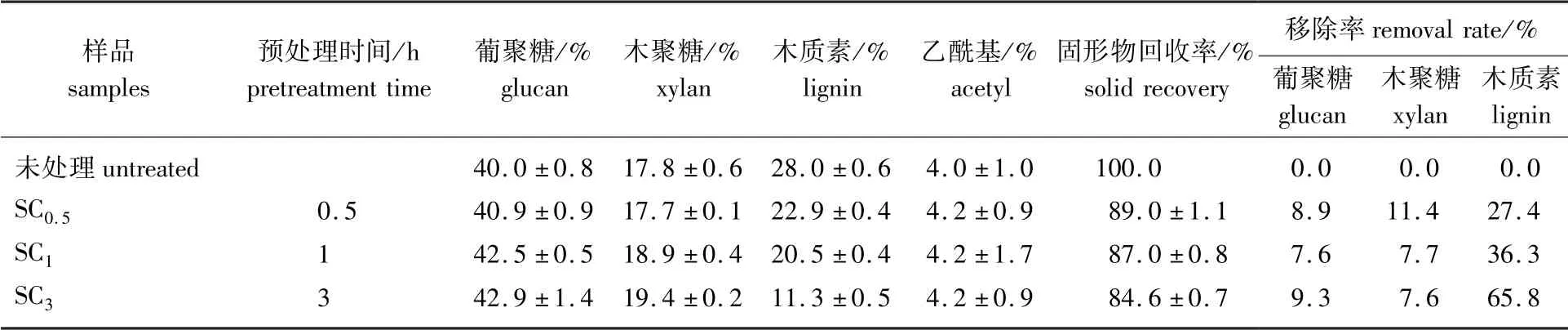
表1 亚氯酸钠预处理杨木的化学组成Table 1 Chemical composition of poplar after sodium chlorite pretreatment
原料杨木的葡聚糖、木聚糖和木质素质量分数分别为40.0%、17.8%和28.0%。亚氯酸钠预处理3 h后,木质素的质量分数则由初始的28.0%下降到SC3的11.3%,木质素的去除使葡聚糖和木聚糖的质量分数分别提高至42.9%和19.4%。虽然固形物的回收率分别在84.6%~89.0%之间,但葡聚糖和木聚糖的回收率均超过90%和88%。类似的结果也在之前的研究中报道过,Nan等[8]采用质量分数6%的亚氯酸钠在80℃处理荻草0.5~24 h后,其葡聚糖和木聚糖的回收率也均超过80%。由此表明,亚氯酸钠预处理可以选择性脱除杨木中的木质素,同时保留大量的碳水化合物组分。此外,经过预处理后,杨木中的乙酰基含量有所上升,这可能是预处理后乙酰化纤维素或木聚糖的含量有所增加导致的[9]。
2.1.2SEM分析 未处理和亚氯酸钠预处理杨木的扫描电镜图片如图1所示,由图1可观察到未进行预处理的杨木表面纤维结构完整且光滑。经亚氯酸钠预处理后,原料表面的刚性纤维结构被不同程度地破坏,纤维表面出现裂纹、空腔,其中SC3的纤维结构被破坏的最严重。在底物SC1的纤维结构中,还观察到不同孔径大小的纤维孔隙。这一表面现象与之前报道相似,这是预处理过程中木质素被脱除所致。据报道,亚氯酸钠预处理初期去除的是细胞角隅区和复合胞间层的木质素,中后期主要去除的是复合胞间层和次生壁的木质素[10]。木质素的去除可导致细胞壁结构的坍塌和裂纹的出现,从而增加样品表面积,有利于后续酶水解的进行,类似的结果也在其他研究中被报道[11]。

图1 未处理杨木和亚氯酸钠预处理杨木的扫描电镜图(×800)Fig.1 SEM images of unpretreated poplar and SC-pretreated poplar(×800)
2.1.3XPS、XRD和纤维素可及性分析 表2列举了未经过处理和经过亚氯酸钠预处理杨木的表面元素组成。

表2 不同杨木样品的表面元素组成、结晶度和纤维素可及性分析Table 2 Surface elemental compositions,crystallinity and cellulose accessibility analysis of different poplar samples
据报道,XPS光谱中的C—C/C—H结构的碳原子对应的峰主要来源于木质素和萃取物,该峰的面积越大,表明样品表面的木质素含量越高[12]。C—O和C==O/O—C—O结构的碳原子对应的峰分别来源于纤维素和半纤维素。从表2中可以看出C—C/C—H结构的碳原子对应的峰的相对面积从原始的49.3%先减小再增加,C—O和C==O/O—C—O结构的碳原子对应的峰的相对面积先增加后减小。该现象可能是因为在预处理的初始阶段木质素不断脱除,使纤维素和半纤维素含量上升。经过长时间处理后溶液中的木质素和多糖降解产物形成了假木质素并沉积到原料表面所致[13]。最终使C—C/C—H结构的碳原子对应的峰的相对面积上升,而C==O/O—C—O结构的碳原子对应的峰的相对面积下降。另外通过XRD技术检测了样品的结晶度,如表2所示,与未处理的杨木相比,预处理后的杨木样品结晶度均有所上升,均达到或超过55%。结晶度的上升主要是由于木质素和非结晶态半纤维素的去除所致[14]。可及性实验中,4种底物对刚果红的最大吸附量分别为240.4、259.3、355.1和566.5 mg/g,吸附量越大说明其可及性越高。随着预处理时间的延长,最大吸附量逐渐增大,可及性增加。这是因为预处理时间越长,原有的纤维结构被破坏的更加严重,有更多的木质素被脱除而使底物孔隙率增大,即纤维素的可及性得到了更大的提高[15]。
2.2 氢氧化钠处理
有文献报道,采用碱对亚氯酸钠处理后的杨木进行第二步处理,可以极大地提升杨木的木聚糖水解得率,并且有效降低纤维素酶用量[6]。因此,本研究采用氢氧化钠(SH)对亚氯酸钠处理后的杨木进行第二步预处理,以提高葡聚糖和木聚糖的可降解性能。亚氯酸钠预处理的杨木经过氢氧化钠预处理后,木质素的量分别从22.9%(SC0.5)、20.5%(SC1)、11.3%(SC3)降低到10.6%(SC0.5-SH)、4.7%(SC1-SH)、2.9%(SC2-SH),木质素的移除率为67.9%~85.4%(表3),超过95%的葡聚糖和70%左右的木聚糖在预处理过程中被保留。此外,经过氢氧化钠进一步预处理后,杨木的乙酰基从4%左右(表1)降低至0%。据文献报道,乙酰基的去除有利于增加酶对纤维素的可及性从而促进酶水解[16]。
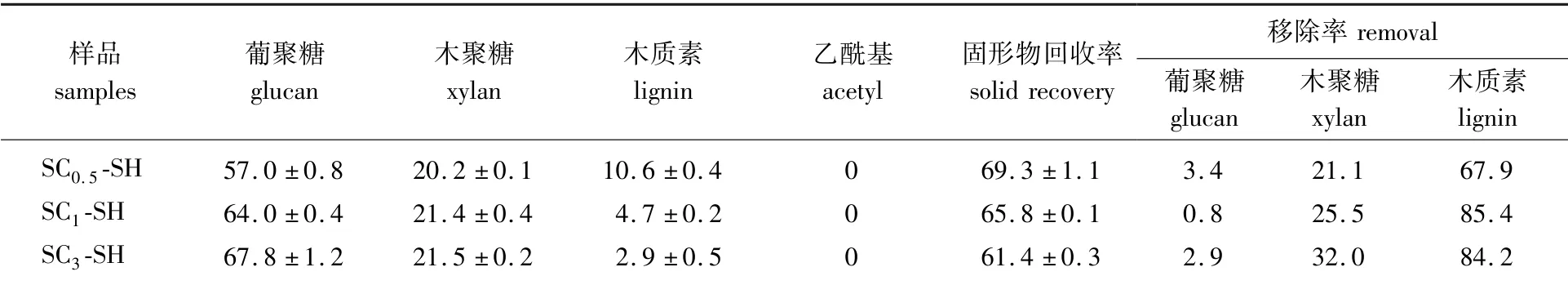
表3 亚氯酸钠和氢氧化钠两步预处理后杨木的化学组成1)Table 3 Chemical composition of poplar after SC and SH two-step pretreatment %
2.3 预处理后样品的酶水解
2.3.1木聚糖酶水解以亚氯酸钠处理的杨木为对照组,对两步预处理后的杨木采用木聚糖酶水解制备低聚木糖。不同底物的低聚木糖得率如表4所示。

表4 两步预处理对杨木木聚糖水解制备低聚木糖的影响Table 4 Effect of two-step pretreatment on enzymatic preparation of xylooligosaccharides
只经过亚氯酸钠预处理的杨木经木聚糖酶水解得到的低聚木糖总得率分别为1.06%、1.60%和5.85%。经过亚氯酸钠-氢氧化钠处理后,3种底物的低聚木糖得率分别提升至41.62%(SC0.5-SH)、43.74%(SC1-SH)和47.20%(SC3-SH),相对未经碱处理的底物,低聚木糖的得率分别提高了38.3、26.5、7.1倍。碱处理有效地促进了底物中木聚糖的水解,显著地提高了低聚木糖的得率。此外,经过碱处理后,SC3酶水解液中的木糖与低聚木糖质量比值从0.33降低至0.20[1],这表明碱处理还减少了酶水解液中的木糖。这可能是因为碱处理移除了杨木中大量木质素之后,提高了杨木样品中木聚糖对木聚糖酶的可及性,导致低聚木糖得率大幅度提高(表4),从而使木糖质量/低聚木糖质量的比值明显降低。值得注意的是,经过碱处理后,在杨木水解液中低聚木糖的主要组成为木二糖,3种底物所得的木二糖得率分别达到41.0%、43.19%和46.97%,占水解液中低聚木糖的组成98%以上。
2.3.2纤维素酶水解
2.3.2.1亚氯酸钠预处理杨木酶水解效率是评价预处理效果的重要指标。以未处理的杨木为对照,对3种不同预处理时间的亚氯酸钠预处理杨木底物进行了纤维素酶水解实验,结果如图2所示。当酶用量为10 mg/g时,经过亚氯酸钠预处理0.5 h后,杨木的葡萄糖和木糖得率分别从8.4%和4.8%提升至12.4%和8.4%;延长预处理时间至3 h后,葡萄糖和木糖得率分别提升至30.0%和24.3%。这是由于亚氯酸钠预处理移除了杨木中的木质素,从而增加了纤维素酶对纤维素的可及性,改善了杨木酶水解效果[5]。由于本研究所用的商品纤维素酶中含有木聚糖酶,所以它能将底物中的木聚糖水解而产生木糖。继续增加酶用量至60 mg/g时,SC3的葡萄糖和木糖得率最高,分别为85.2%和59.0%。本研究结果与Siqueira等[4]和Wen等[6]所报道的一致。
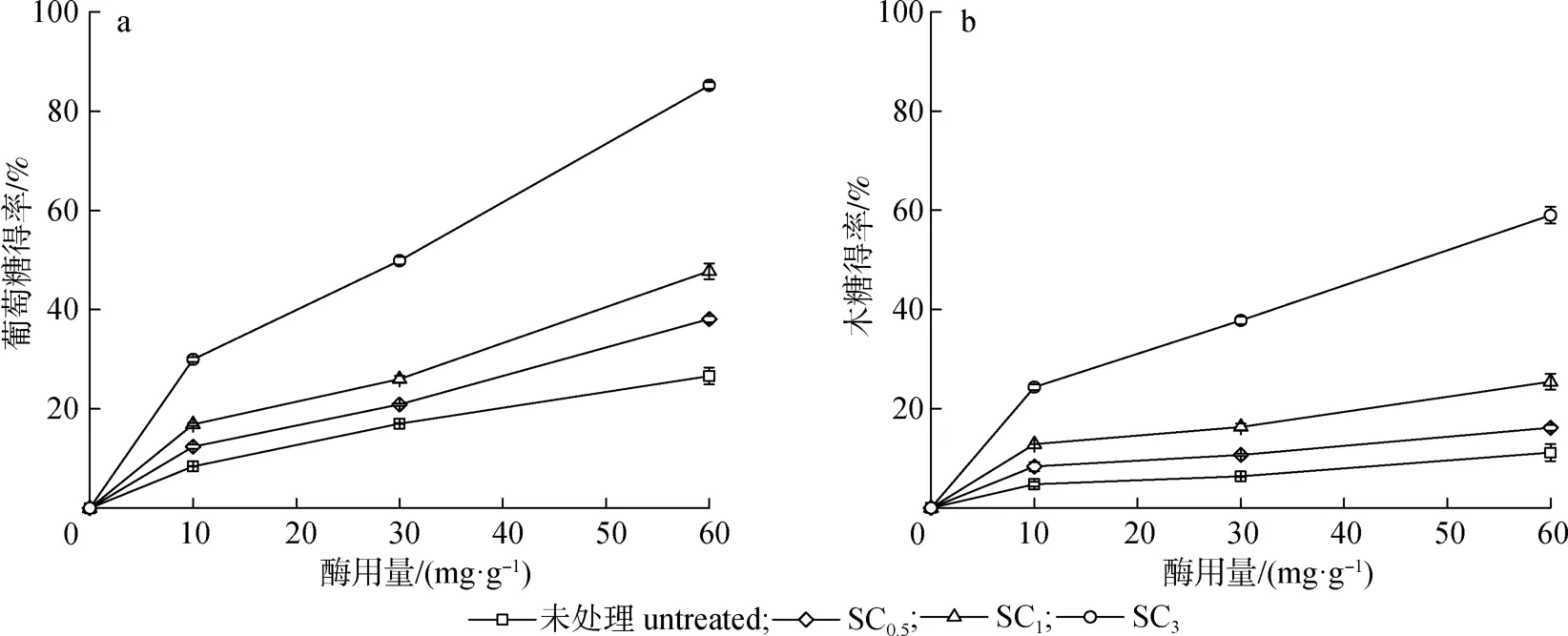
图2 亚氯酸钠预处理杨木的纤维素酶水解Fig.2 Cellulase hydrolysis of poplar after sodium chlorite pretreatment
2.3.2.2木聚糖酶水解残渣经过木聚糖酶水解后,将杨木水解残渣进行纤维素酶水解制备单糖,结果见表5。在酶用量10 mg/g条件下,3种底物均呈现出较高的水解效率。SC0.5-SH、SC1-SH和SC3-SH的葡萄糖得率分别为41.1%、55.5%和64.7%。继续增加酶用量至30 mg/g,葡萄糖得率分别提升至81.4%、84.0%和90.2%,比亚氯酸钠预处理杨木在60 mg/g的纤维素酶用量下的得率更高。由此,证实碱处理不仅使底物中的木聚糖更容易水解,还促进了纤维素的酶水解特性。值得注意的是,表5中各原料的木糖得率均低于葡萄糖得率,这是因为底物中易于水解的木聚糖已被水解为低聚木糖(表4),因此该商品纤维素酶中存在的木聚糖酶很难将杨木中残留的木聚糖水解为木糖。

表5 木聚糖酶水解残渣的纤维素酶水解Table 5 Cellulase enzymatic hydrolysis of SC-SH-pretreated poplar
2.4 物料衡算
图3是1 kg杨木经亚氯酸钠和氢氧化钠预处理后,经木聚糖酶水解制备低聚木糖和纤维素酶水解制备单糖的物料衡算图。如图3所示,1 kg杨木在70℃下经过质量分数6%亚氯酸钠处理3 h后,可得到846.0 g的预处理杨木。若直接经纤维素酶水解后可获得181.0 g的葡萄糖和62.1 g木糖。若将亚氯酸钠预处理杨木在70℃下经质量分数1%氢氧化钠处理1 h后,再经木聚糖酶水解制备低聚木糖后,纤维素酶水解木聚糖酶水解的残渣制备单糖。整个工艺流程可获得52.5 g的低聚木糖、317.6 g葡萄糖和49.9 g木糖。Hao等[1]报道采用过氧化氢-乙酸预处理杨木后进行两步酶水解制备低聚木糖和单糖,1 kg杨木可获得16.9 g低聚木糖和296.4 g葡萄糖。相比过氧化氢-乙酸预处理,杨木经过亚氯酸钠和氢氧化钠两步预处理后有着更高的低聚木糖和葡萄糖产量。亚氯酸钠和氢氧化钠预处理均在较温和的条件下进行,亚氯酸钠预处理后产生的氯气可以回收后循环利用[17]。因此,本研究所采用的亚氯酸钠和氢氧化钠两步预处理酶法制备低聚木糖和单糖有着较好的应用潜力。

图3 杨木酶法水解制备低聚木糖和单糖的物料衡算Fig.3 Mass balance of xylooligosaccharides and monosaccharides production from poplar
3 结 论
3.1以杨木为原料,研究了亚氯酸钠和氢氧化钠两步预处理对杨木酶水解制备低聚木糖和单糖的影响,结果表明:经亚氯酸钠在70℃下预处理3 h后,杨木木质素移除率达到65.8%,葡聚糖和木聚糖的保留率均在90%以上。预处理还能移除底物表面的木质素,提高底物结晶度,改善纤维素酶对底物中纤维素的可及性。
3.2杨木经亚氯酸钠处理3 h和氢氧化钠处理1 h后,经木聚糖酶水解后获得的低聚木糖得率达到47.2%,相比未经氢氧化钠预处理的杨木,低聚木糖得率提高了7.1倍。其中木二糖为主要成分,占98%以上。木聚糖酶水解后得到的固形物经30 mg/g的纤维素酶水解后葡萄糖得率为90.2%,木糖得率为35.3%。
3.3物料衡算结果表明,1 kg杨木经亚氯酸钠和氢氧化钠预处理后,再经木聚糖酶和纤维素酶两步酶水解可获得52.5 g低聚木糖、317.6 g葡萄糖和49.9 g木糖。亚氯酸钠和氢氧化钠的预处理温度分别为70℃和50℃,反应条件温和,得到的低聚木糖和单糖得率较高,副产物少,具有较好的应用潜力。

