土地利用驱动的土壤性状变化影响微生物群落结构和功能
吴希慧,王 蕊, 高长青, 高 胜, 杜兰兰, KHAN Asif , BARMON Milon , 郭胜利,,*
1 西北农林科技大学水土保持研究所, 黄土高原土壤侵蚀与旱地农业国家重点实验室, 杨凌 712100
2 陕西省长武旱作小麦育种试验中心, 长武 713600
3 中国科学院、水利部水土保持研究所, 杨凌 712100
土壤微生物作为陆地生态系统的重要组成部分,是物质循环和能量流动的重要媒介,在调节陆地生态系统碳、氮等元素的地球化学循环过程中具有重要意义[1]。微生物功能及相关过程都是由微生物群落所决定的[2]。大量研究发现土壤中细菌群落主要为酸杆菌(Acidobacteria)、放线菌(Actinobacteria)、变形菌(Proteobacteria)等[3- 4],真菌群落主要是子囊菌(Ascomytota)、担子菌(Basidiomycota)、接合菌(Zygomycotina)等[5-6]。根据这些微生物群落具有的某种相同或相似的生物学功能将其划分成不同的功能群,如:参与土壤氮循环的硝化及反硝化型细菌等[1];参与土壤碳循环的异养型细菌[7]及腐生型真菌等[8]。据报道,土壤有机碳(SOC)、氮含量及组分、容重等土壤性状的改变显著影响土壤微生物多样性和群落组成[3,9-13]及功能[13-14]。但是,也有报道指出土壤微生物多样性[15]不受土壤性状的影响。因此,明确土壤性状变化对微生物群落和功能的影响,有助于进一步深入探讨陆地生态系统地球化学循环过程。
土地利用方式变化是影响土壤性状的重要因素[16]。研究表明土地利用方式间,不同植被[17]和管理措施[18]都会导致土壤性状存在显著差异。例如,自然条件下[12]牧场、松林、阔叶林中土壤性状变化较大:容重(1.2—1.7 g/cm3)、全氮含量(0.4—0.8 g/kg)、碳含量(9—18 g/kg)、土壤碳氮比(14—22)。耕地、林地、湿地土壤中[13]:全氮含量(0.5—0.8 g/kg)、铵态氮含量(9.2—11.4 mg/kg)。此外,Wang等[17]指出农田不同作物种植模式(冬小麦连作、小麦-苜蓿轮作、小麦-土豆轮作、小麦-糜子-玉米轮作)也会引起土壤养分显著变化:土壤有机碳(7.9—9.6 g/kg)、土壤全氮(1.0—1.2 g/kg)。这些土壤性状的变化势必会引起微生物群落结构和功能的改变[12]。已有研究指出黄土高原地区将废弃农田进行植被恢复后(始于1998年),SOC含量从1998年的4.0 g/kg增加至2006年的4.5 g/kg[19];到2014年SOC含量提高至6.2 g/kg,此时植被恢复区域SOC含量比废弃农田高2.8 g/kg[20]。目前大多数研究关注于该地区土地利用方式改变对土壤性状的影响[20-21],但土地利用驱动的土壤性状变化对微生物群落结构和功能的影响尚不十分清楚。
基于此,本研究依托陕西长武县长期定位监测试验,研究了不同土地利用方式(裸地、农田、草地)的土壤容重及碳氮养分含量等土壤性状差异;分析了不同土地利用方式下细菌和真菌群落丰富度、多样性及土壤碳氮代谢相关功能特征的变化;进而分析了二者之间的关系,以期明确土地利用方式变化条件下土壤性状和微生物群落与功能的作用机制。
1 材料与方法
1.1 研究区概况
本实验在陕西长武农田生态系统国家野外科学观测研究站长期定位监测试验(始于1984年)进行,该站位于高塬沟壑区的陕西省长武县十里铺村(107°40′E,35°12′N,海拔1200 m),该地属于旱作雨养农业区,无灌溉条件[22]。据长武县气象局资料统计(1957—2018年),该地区年均降水量为580 mm,7—9月份降水量占年降水量的49%左右,平均气温为9.1℃,大于10℃的积温为3029℃,年日照时数2230 h,日照率为51%,年辐射总量为484 kJ/cm2。土壤为粘壤质黑垆土,1984年布设试验时土壤有机碳含量为6.5 g/kg,全氮含量为0.6 g/kg,pH值8.4,CaCO3含量10.5%,粘粒含量(<0.002 mm)24%。
1.2 试验设计与管理
长期定位监测试验共计36个处理,3次重复,均由农田转化而来。在该长期定位监测试验中选取3个典型土地利用方式(均未进行施肥处理):①农田(小麦):从1984年开始,小麦地连续种植冬小麦,一年一茬,播种期为9月中下旬,定期进行除草和松土,试验管理措施与当地大田一致,到6月下旬小麦成熟后将地上生物量进行一次性收割,随后用翻耕机将小麦地表层0—20 cm土壤进行翻耕,掩埋根系残茬并将其输入土壤,进入夏季休闲期(7—9月),9月份进行再一次小麦耕作播种;②草地(紫花苜蓿):草地选择根系具有较强固氮作用的苜蓿地,其品种为紫花苜蓿,自1984年播种紫花苜蓿生长至今,不复种,每年6月下旬和9月下旬进行两次地上生物量的刈割,小区内散生杂草,定期进行除草松土;③裸地:作为对照处理,自1984年开始已连续多年不种作物,定期移除地面生长的杂草。各土地利用方式随机排列。小区长5.5 m,宽4 m,面积为22 m2。
1.3 土壤样品的采集
2018年6月下旬,小麦和苜蓿收割后,用直径为3 cm的土钻采集了长期试验地农田、草地、裸地耕层0—20 cm土壤。每个小区以S型选定5个采样点采集5钻土样,制成混合土样为一次重复,每个处理3次重复。新鲜土样通过2 mm筛后,剔除根系残体,装进采样盒中,用冷藏箱尽快带回实验室:-20℃保存供分析微生物群落结构;4℃保存供分析微生物量碳(SMBC),硝态氮和铵态氮(矿质氮)等;样品风干用于测定SOC和TN等理化指标。
1.4 DNA提取和高通量测序
采用Fast DNA SPIN Kit for soil试剂盒根据说明提取DNA。用Nanodrop ND- 2000 UV-Vis分光光度计(Nano Drop Technologies, Wilmington, DE, USA)检测DNA的数量和质量。根据测序区域的选择,使用带Barcode的特异引物进行PCR扩增:338F(5′ACTCCTACGGGAGGCAGCAG- 3′)和806R(5′-GGACTACHV GGGTWTCTAAT3′)[23]扩增细菌16S rRNA基因的V3-V4区域,ITS1(5′-CTTGGTCATTTAGAGGAAGTAA3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC- 3′)扩增真菌ITS基因区域[24]。纯化扩增产物并制备序列文库,然后用Qubit@2.0 Fluorometer(Thermo Scientific)和Agilent Bioanalyzer 2100系统检测文库质量。最后送北京诺禾致源科技股份有限公司利用Illumina Hi Seq 2500 PE250平台进行高通量测序。
将双末端序列根据Barcode序列和PCR扩增引物标签拆分出各个样品的数据,将每个样品的序列借助FLASH(V1.2.7,httP://ccb.jhu.edu/software/FLASH/)进行拼接,然后根据QIIME[25]质控流程进行质量控制。根据UCHIME算法[26]去除嵌合体序列,然后将剩余的序列利用UParse软件[27]以97%的相似度聚类划分OTU。对于OTU的每一个代表序列,使用RDP Classifier算法与GreenGene数据库以80%的置信阈值进行物种注释分析。最后以数据量最少的样品为标准对得到的OTU丰度数据进行均一化处理,后续的alpha和beta多样性分析均基于均一化处理后的数据。
1.5 土壤理化性状分析
土壤容重采用环刀法测定,SOC利用H2SO4-K2Cr2O7外加热法测定[28],TN利用凯氏定氮法测定[29],SMBC利用氯仿熏蒸-萃取法测定[30],土壤铵态氮和硝态氮用2 mol/L KCl溶液浸提鲜土样后,用流动分析仪测定(SAN++,Skalar,Holland)[31],并在本研究中用土壤铵态氮和硝态氮测定含量之和来表示土壤矿质氮的总量。
1.6 数据分析方法
采用SPSS 2.0软件对土壤性状和微生物群落α-、β-多样性指数进行单因素方差分析(ANOVA),并进行F显著性检验,当检验显著时,再通过Duncan检验将不同土地利用方式的均值进行比较(P<0.05)。显著性检验完成后运用Sigmaplot(12.5)软件绘制门、纲、目、科四个水平排名前十的细菌和真菌群落相对丰度图。采用R语言(3.5.1)对微生物数据进行整理,通过ape包和ggplot2包绘制主坐标分析图(Principal Co-ordinates Analysis, PCoA)。细菌和真菌功能分别利用FAPROTAX[7]和FUN Guild[32]进行预测。土壤微生物群落丰富度(Chao1指数)及多样性(Shannon指数)、功能结构和土壤理化性状之间相关关系采用SPSS 2.0软件通过Spearman进行定量分析。
2 结果与分析
2.1 不同土地利用方式下土壤理化性状的变化
不同土地利用方式下(裸地vs.农田vs.草地)土壤性状存在显著差异(表1)。其中裸地土壤容重最大(1.4 g/cm3)、其次为农田(1.3 g/cm3)、最次为草地(1.2 g/cm3)。裸地中SOC含量为5.9 g/kg,农田(6.5 g/kg)和草地(10.5 g/kg)分别较裸地高出10.2%和78.0%。裸地与农田土壤中TN含量均为0.8 g/kg,而草地较裸地高出1.5倍。三个不同土地利用方式中矿质氮含量范围为12.7—34.0 mg/kg,其中草地最高(34.0 mg/kg)。

表1 不同土地利用方式土壤性状Table 1 Soil properties under different land uses
2.2 微生物多样性
土壤样本中细菌和真菌群落分别获得64246和31162个高通量序列。细菌和真菌OTU数在土地利用方式间无显著差异。细菌群落Chao1指数差异显著(P<0.05)(表2),大小排序为:农田(4921)>裸地(4831)>草地(4202)。细菌群落Shannon指数同样具有显著差异(P<0.05)(表2),大小排序为:农田(10.2)>草地(10.1)>裸地(9.9)。真菌群落Chao1指数与Shannon指数按农田、裸地、草地依次降低,但均未达到显著水平。土地利用方式对细菌和真菌群落β-多样性也存在一定影响(图1)。裸地土壤细菌群落β-多样性指数较高(0.3),农田和草地较裸地低31.0%、13.8%。裸地中真菌群落β-多样性指数为0.8,农田较裸地低37.5%,而草地较裸地高出14.3%。

表2 根据64246条细菌序列及31162条真菌序列计算基因序列相似度为97%的微生物alpha多样性指数Table 2 Microbial alpha diversity indicates at 97 % sequence similarity of gene sequence calculated based on 64,246 bacterial sequences and 31,162 fungal sequences for each sample
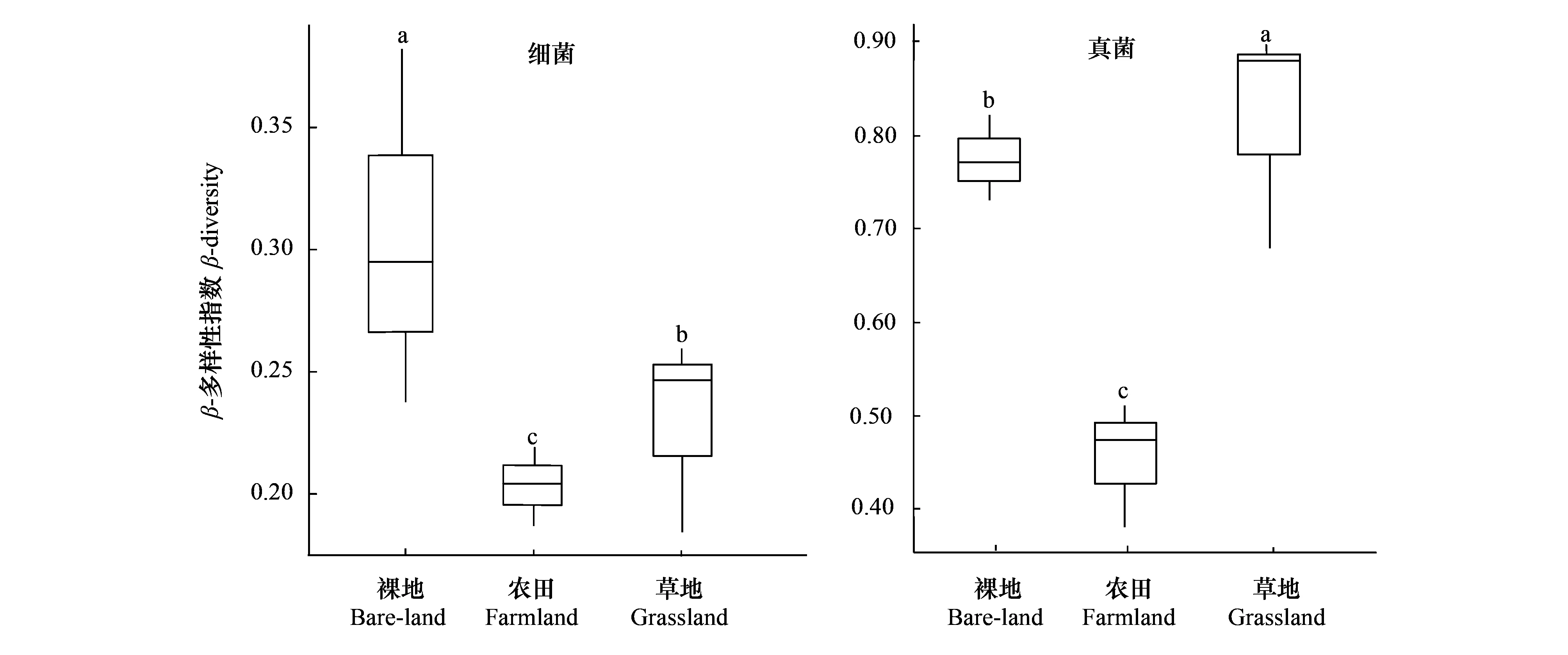
图1 细菌和真菌群落beta多样性Fig.1 Beta diversity of bacterial and fungal communities图中不同小写字母表示处理间差异显著(P<0.05)
2.3 微生物群落丰度变化
土壤微生物群落门、纲、目、科四个水平相对丰度在不同土地利用方式间存在差异(图2、图3)。细菌群落在门水平上,变形菌(Proteobacteria)、放线菌(Actinobacteria)和酸杆菌(Acidobacteria)均为优势菌(图2)(29.8%—31.1%、17.6%—18.3%、17.6%—19.5%),但只有变形菌门存在显著性差异,农田和草地中变形菌门相对丰度为29.7%和29.9%,分别较裸地(31.1%)低4.5%和3.9%(P<0.05)。
真菌群落中,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉菌门(Mortierellomycota)和毛霉菌门(Mucoromycota)为优势菌,且在土地利用方式间存在较大变异性(图3)。草地中子囊菌门相对丰度(5.5%)较低,农田(9.2%)和裸地(27.0%)中较草地高出67.3%、3.9倍;裸地中担子菌门相对丰度较高(24.7%),农田(12.8%)和草地(4.2%)分别较裸地低48.2%和83.0%;农田中被孢霉菌门相对丰度最高(农田vs.草地vs.裸地:5.7%vs.3.6%vs.1.8%),但在不同土地利用方式间无显著差异;农田(4.3%)和草地(0.9%)中毛霉菌门相对丰度分别高出裸地16.9倍、2.8倍(P<0.05)。
2.4 微生物功能变化
通过对裸地、农田、草地中采集的土壤样本进行PCoA分析,发现微生物功能在土地利用方式间存在显著差异(图4)。细菌功能排序轴第1轴的贡献率为39.8%,排序轴第2轴的贡献率为25.7%,前2轴累计解释量为65.5%。其中,第一主成分轴上裸地、农田、草地均聚类明显。根据FAPROTAX算法,按照排名选取了土壤细菌群落中相对丰度排名前10的功能分组(图5)。细菌群落功能基因中占据优势的是化能异养型和好氧化能异养型细菌。对照组裸地中化能异养型细菌相对丰度较高(10.3%),农田(9.6%)和草地(8.2%)分别较裸地低6.8%和20.3%(P<0.05)。农田和草地中好氧化能异养型细菌相对丰度为8.9%和7.5%,分别较裸地低4.3%和19.4%。此外,硝化型细菌在裸地中相对丰度较低(1.0%),农田(1.4%)和草地(2.3%)较裸地高出40.0%和1.3倍(P<0.05)。类似地,裸地中好氧氨氧化型细菌的含量也较低(0.6%),农田(0.9%)和草地(1.9%)分别较裸地高50%和2.2倍(P<0.05)。

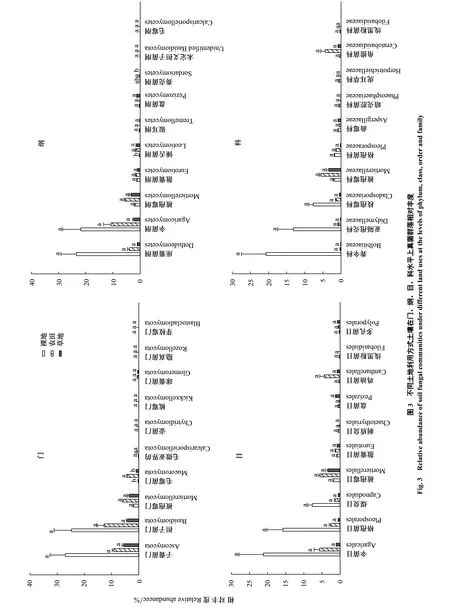
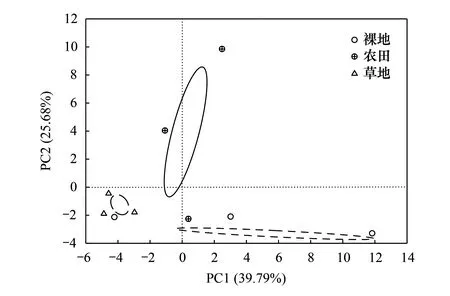
图4 不同土地利用方式土壤细菌群落功能基因预测PCoA分析Fig.4 PCoA analysis of soil bacterial community predicted by functional genes composition under different land uses

图5 不同土地利用方式土壤细菌群落功能基因丰度 Fig.5 The abundance of soil bacterial community predicted by functional genes composition under different land uses图中同一组柱状图不同小写字母表示处理间差异显著(P<0.05)
本研究借助FUN Guild在线数据平台(https://github.-com/UMNFuN/FUNGild),将真菌群落划分到不同的营养型(Trophic mode)和共位群(Guild)。主要营养型为腐生菌,其次为病原菌和共生菌。其中腐生菌和病原菌相对丰度在不同土地利用方式中大小排序均为:裸地>农田>草地(图6)。Guild是一种类似于资源利用吸收所进行的功能分类,其中包括动物病原菌、植物病原菌、木腐生菌等。通过对Guild的预测,可以从另外的生态功能角度研究真菌的功能。因此,基于不同营养型对本研究中的菌群进行了各种功能共位群的划分,除未知的菌群外土壤真菌群落可以划分为未定义腐生菌、植物病原菌、木腐生菌等多个功能菌群(图7)。其中未定义腐生菌相对丰度最高(裸地vs.农田vs.草地:23.8%vs.17.2%vs.5.5%),其次是植物病原菌。此外还有多种混合型营养型共位菌群,如:寄生植物病原菌、动物病原-植物内生病原-木材腐生菌、寄生型真菌-植物病原菌等。本研究中共注释到37个Guild,裸地、农田和草地中分别注释到31、35和28个Guild。不同土地利用方式土壤真菌功能组成相似,但优势功能基因相对丰度差异较大。
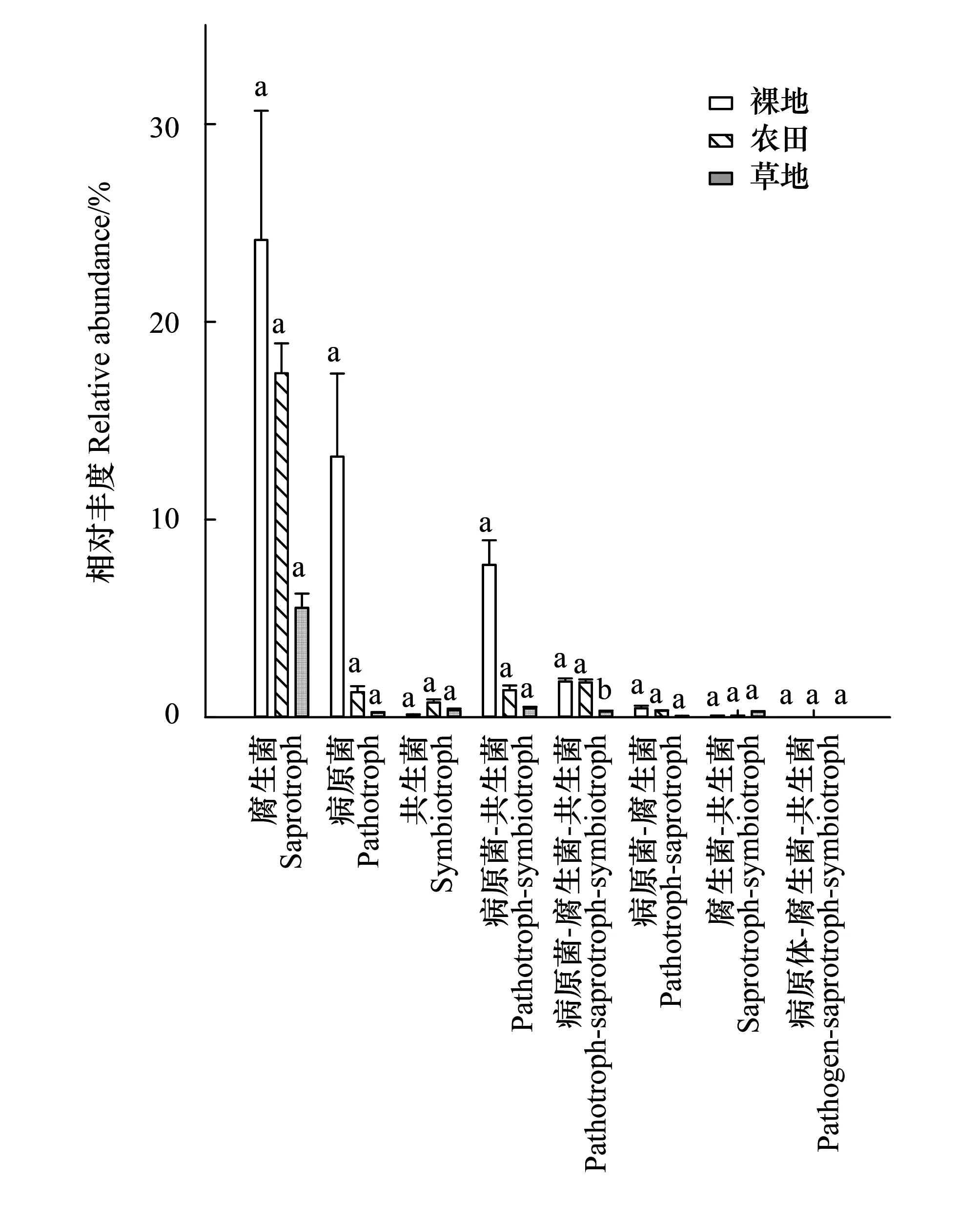
图6 不同土地利用方式土壤真菌营养型基因丰度 Fig.6 The abundance of soil fungal community nutrient under different land uses图中同一组柱状图不同小写字母表示处理间差异显著(P<0.05)

图7 不同土地利用方式土壤真菌功能型基因丰度 Fig.7 The abundance of soil fungal community functional genes under different land uses图中同一组柱状图不同小写字母表示处理间差异显著(P<0.05)
2.5 土壤性状对微生物群落和功能的影响
将不同土地利用方式下土壤理化各指标与微生物群落、微生物功能基因丰度之间进行了Spearman相关性分析后发现,微生物群落和功能与土壤理化性状之间存在不同程度相关关系(表3、表4、表5)。
SOC和TN与细菌群落OTU数之间呈显著负相关(P<0.05;P<0.01),而真菌群落OTU数与土壤矿质氮含量呈负相关(P<0.05)(表3)。细菌和真菌Shannon指数分别与TN、土壤矿质氮呈负相关(P<0.05);真菌Chao1指数与C∶N比呈正相关(P<0.05)。细菌和真菌β-多样性的主要影响因素分别是SMBC/SOC(P<0.01)、C∶N和矿质氮含量(P<0.01)。此外,不同土地利用方式间细菌优势菌门变形菌中的α-变形菌(Alphaproteobacteria)和ϒ-变形菌(Gammaproteobacteria)与土壤容重均呈正相关(P<0.01;P<0.05),与SOC(P<0.05)和SMBC呈负相关(P<0.01;P<0.05)(表3)。子囊菌、担子菌和被孢霉菌门为优势真菌类群,但与土壤理化性状之间无显著相关关系。
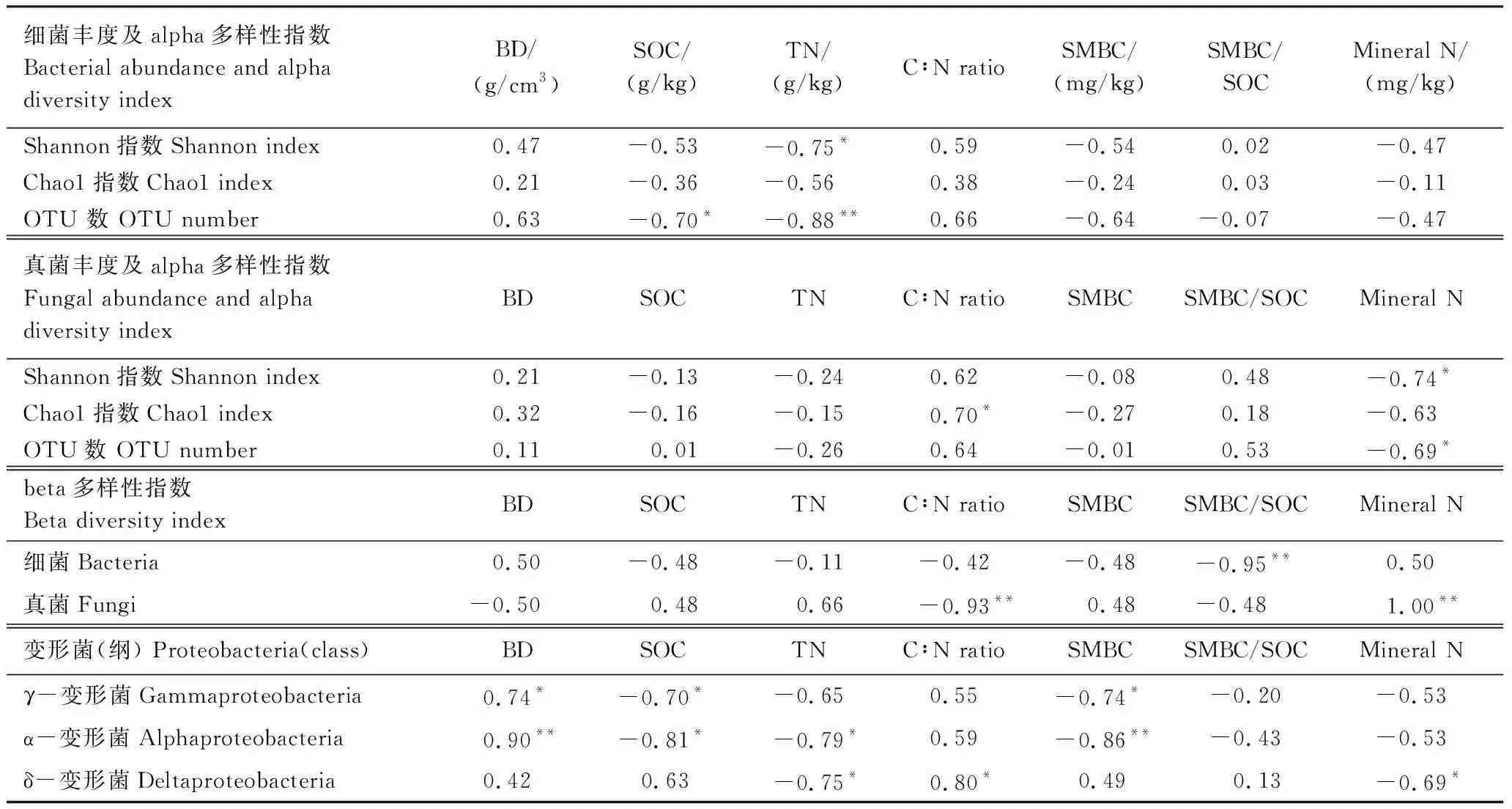
表3 微生物群落丰度及多样性指数与土壤性状之间相关关系Table 3 Correlations between the abundance and the diversity index of microbial and soil properties
本研究中化能异养型和好氧化能异养型细菌与土壤容重呈正相关(P<0.05);与SOC和TN呈负相关(P<0.01)(表4)。硝化型和好氧氨氧化型细菌相对丰度与土壤容重呈负相关(P<0.01);与SOC(P<0.01;P<0.05)、TN(P<0.05)及SMBC(P<0.01)呈正相关关系。参与硫和硫化物呼吸的细菌丰度与SOC呈正相关(P<0.05)。与细菌不同,土地利用方式对真菌营养型影响较小(表5)。但是,土壤理化性状显著影响真菌的共位群:其中寄生植物病原菌和动物病原-植物内生病原-木材腐生菌均与土壤容重正相关(P<0.05;P<0.01),与SOC负相关(P<0.05;P<0.01);动物病原-土壤腐生菌与土壤矿质氮含量负相关(P<0.05),兰花菌根与土壤C∶N(P<0.05)和矿质氮(P<0.01)分别正、负相关。
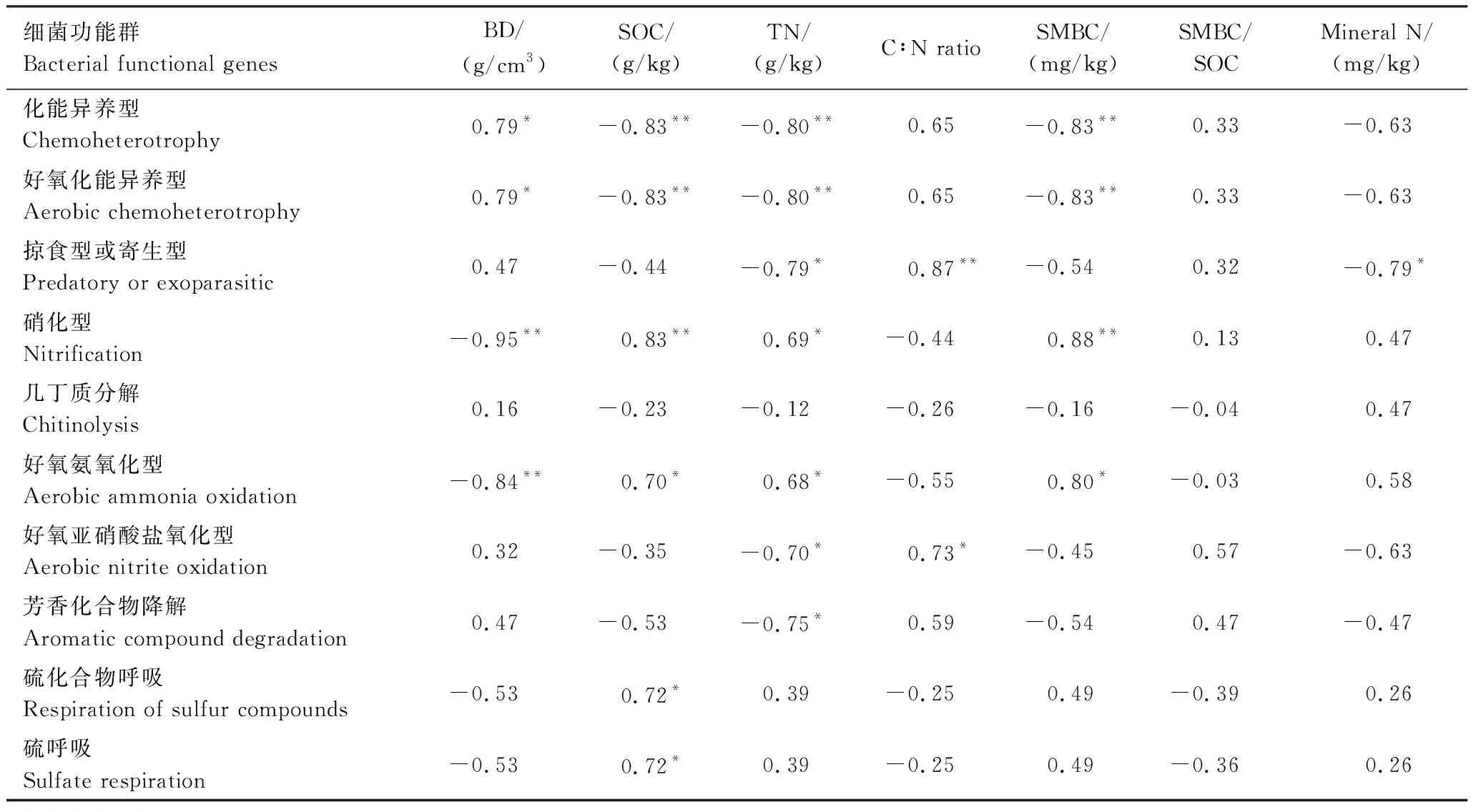
表4 细菌功能基因丰度与土壤性状之间相关关系Table 4 Correlations between the abundance of bacterial functional genes and soil properties

表5 真菌功能型及营养型基因丰度与土壤理化性状之间相关关系Table 5 Correlations between the abundance of nutrient and functional genes of fungal community and soil properties
3 讨论
3.1 土地利用方式对土壤性状的影响
土地利用方式显著影响土壤容重,本研究中裸地土壤容重(1.4 g/cm3)大于农田和草地,这可能与裸地中地表裸露无植物覆盖,地下无根系生长扰动有关,韩蕾等人也得到相似的结果[33]。农田和草地中SOC与TN含量高于裸地(表1),出现这一现象可能与不同土地利用方式中不同的植物残茬输入以及根系分泌物有关。同时,本研究结果显示草地中SOC和TN含量显著高于农田中,可能是因为农田中作物覆盖度远不如草地大,且随着作物的连年收获,土壤养分耗竭,土壤有机质含量下降[34]。此外,苜蓿作为豆科植物具有良好的固氮能力,使得土壤矿质氮含量在草地中较高[35],进而刺激微生物生长和繁殖并提高了SMBC含量,这与李英等[36]的研究结果存在差异,主要原因可能是不同研究区草地和农田中植被类型的不同所导致。
3.2 微生物群落结构对土壤性状的响应
土壤性状显著影响微生物群落结构[37],本研究中SOC和TN是细菌群落OTU数的主要影响因素(表3),而真菌群落OTU数受土壤矿质氮含量的影响,这与Guo等[38]的研究结果一致。宋贤冲等[39]发现土壤微生物Shannon指数与SOC、TN负相关,本研究结果与之存在相似之处。此外,β-多样性的主要影响因素是SMBC/SOC、C∶N及矿质氮含量,这与Landesman等[40]认为β-多样性不受土壤养分影响的结论存在差异,原因可能是本研究区域不同土地利用方式下土壤理化指标含量尚未达到满足微生物充分生长的水平,仍是制约微生物生长的主要因素[41]。
不同土地利用方式间变形菌均为细菌优势菌门(图2),说明变形菌具有较强的环境适应性[42]。据报道,变形菌的相对丰度与土壤容重呈负相关[10],与TN正相关[1]。但在本研究中α-变形菌和ϒ-变形菌与土壤容重之间的关系与之相反,且SOC、TN和SMBC与α-变形菌和ϒ-变形菌也存在相关关系(表3),这可能与二者属于寡养型细菌有关[43]。此外,裸地中ϒ-变形菌纲与α-变形菌纲相对丰度显著高于草地和农田也进一步证实了此结论(图2)。子囊菌、担子菌[44]和被孢霉菌门[6]为真菌优势菌门,与细菌不同的是真菌群落与土壤理化指标之间并无相关关系,这与Bahram等的研究结果相似[45],可能是因为子囊菌和担子菌处在较低的系统发育水平,对土壤养分不同程度的响应[46]。
3.3 不同土地利用方式下土壤性状的变化影响土壤微生物功能
本研究结果表明,参与土壤碳循环[47]的细菌主要为化能异养型和好氧化能异养型。这与Liang等[9]的研究结果一致。2021年Hou等[48]发现化能异养型和好氧化能异养型细菌相对丰度随土壤中SOC和TN含量上升而增加,而本研究结果与之相反,一方面可能是因为SOC含量过高时抑制了微生物对碳的同化和利用,从而导致异养型微生物量的减少;另一方面可能与Hou的研究土样为沼泽沉积泥沙,而本研究中为旱地土壤有关。不同土地利用方式引起的土壤性状变化对氮循环过程也存在显著影响[13]。此外,参与氮循环的硝化型和好氧氨氧化型细菌相对丰度随土壤容重增加而降低,随SOC、TN及SMBC含量的增加而升高。2015年Cheng等[49]发现农田土壤中增加的SOC及C∶N比促进了硝化作用的发生,这也刚好验证了上述研究结果。可能是因为容重较低时土壤透气性较好,氧气供应充足;同时较高的碳氮底物(SOC、TN)[50]势必会加快微生物对物质的分解转化,并促进氮代谢;因此,参与土壤氮循环的细菌在草地中较农田富集。Huang等[1]发现土壤TN与硫化合物呼吸负相关,与硫呼吸正相关,而本研究中参与硫和硫化物呼吸的细菌丰度与SOC呈正相关(P<0.05),原因可能是微生物在驱动硫化合物的氧化还原过程中也和其他元素(碳和氮等)的循环相互耦合[51]。
与细菌不同,土地利用方式对真菌营养型影响较小(表5),可能是土壤容重及养分含量处于真菌群落适宜生活范围之内[44]。但是,土壤理化性状显著影响真菌的共位群(表5):土壤容重、SOC对寄生植物病原菌和动物病原-植物内生病原-木材腐生菌;土壤矿质氮含量对动物病原-土壤腐生菌;土壤C∶N和矿质氮对兰花菌根。上述四类真菌共位群富集程度均以裸地最高(图7)。2018年关于长期水稻田的一项研究发现,植物病原菌不受土壤理化性状的影响,动物病原菌易在养分较低的环境中生存,而丛枝菌根、外生菌及内生菌更偏好于养分较高的土壤环境[44]。这与本研究结果不一致的原因可能与土壤类型的不同有关。2021年Zhang等[52]认为土壤腐生型真菌相对丰度随土壤中有机质含量上升而增加,这与本研究趋势相反。导致出现这一现象的原因可能是不同研究中田间管理措施的不同。腐生菌可以分解大量难分解碳[8],它们与碳循环密切相关,故农田土壤环境更有利于土壤碳循环过程的发生。
4 结论
不同土地利用方式中土壤微生物群落优势菌群相对丰度及功能基因相对丰度存在差异,主要是受不同土地利用方式引起的土壤性状变化影响。细菌群落变化主要与土壤容重、TN、矿质氮、C∶N比和微生物量碳有关,而真菌群落与土壤矿质氮有关;化能异养型、好氧化能异养型、硝化型、好氧氨氧化型细菌丰度均随土壤容重、SOC、TN及微生物量碳变化;与细菌不同,土地利用方式对真菌营养型影响较小。因此,相比于草地,细菌优势菌群变形菌和放线菌,以及真菌优势菌群子囊菌和担子菌较宜生存于农田土壤;参与土壤碳循环的化能异养型和好氧化能异养型细菌及腐生型真菌也主要富集在农田土壤中;而参与氮循环的硝化型和好氧氨氧化型细菌主要富集在草地中。所以土地利用驱动的土壤容重和碳氮变化影响微生物的群落结构和功能。

