ZNRF3在类风湿关节炎滑膜组织与细胞表达及意义
许静,梁翼,杨茂益,李强
(四川省骨科医院,四川成都 610041 1 风湿骨关节病科; 2 膝关节运动损伤科)
类风湿关节炎(RA)是人体关节滑膜病变出现的慢性炎症反应,导致病人出现不同程度关节破坏的疾病[1-2]。目前我国RA 患病率为0.42%,病程越长病人致残率越高,其中病程超过15年者致残率可高达61.3%[3-4]。既往资料显示,成纤维样滑膜细胞(FLS)在RA 病人中呈病态上升,而其凋亡下降,形成血管翳侵蚀软骨,最终导致关节功能障碍甚至丧失,严重影响病人身心健康及生活质量[5-6]。在RA中,激活FLS由多信号通路决定,而Wnt信号通路具有重要性,被认为参与了RA 发生发展[6-7]。锌指环指蛋白3(ZNRF3)是一种Wnt通路调控蛋白,可经泛素化降解细胞膜表面Wnt蛋白受体卷曲蛋白,从而对Wnt信号通路活性产生抑制作用[8-9]。目前关于ZNRF3的研究主要集中于肿瘤细胞中,对RA研究较少。本研究探讨ZNRF3在RA 病人滑膜组织及细胞中表达,并分析其与疾病发生的关系。现将结果报告如下。
1 资料与方法
1.1 实验材料
1.1.1 对象选择 2018年3月—2020年3月,选择我院收治一侧RA 膝关节病变病人20例,男6例,女14例,年龄(44.32±9.65)岁。红细胞沉降率为(39.84±16.56)mm/1 h,C 反应蛋白为(20.42±12.65)mg/L。根据病人病灶组织位置分为观察组(病变侧,RA 侧)与对照组(正常侧,C 侧)。纳入标准:①符合《2018中国类风湿关节炎诊疗指南》中相关诊断标准[10];②临床资料完整;③正常组织侧滑膜组织及检测部位无外伤,无其他炎症性疾病或一侧关节慢性疾病。排除标准:①其他肌肉骨骼疾病者;②合并重要脏器疾病者。本研究通过我院医学伦理委员会批准,所有病人及家属均知情同意。
1.1.2 主要试剂与仪器 包括免疫组化、实时定量聚合酶链反应(qPCR)、Western blot方法的主要试剂与仪器。仪器:Rigel S2流式细胞仪(上海睿钰生物科技有限公司),微量分光光度仪(美国哈希,DR 6000型),光学显微镜(奥林巴斯,CX43 型),PCR仪(美国罗氏,LC480型)。试剂:Anti-ZNRF3一抗(上海瑞齐生物技术有限公司),ZNRF3二抗(微蒙上海生物科技有限公司),CD29、CD90 抗体(英国Bio Legend公司),Vimentin、CD68一抗(美国Santa Cruz公司),Ⅱ型胶原酶(美国Sigma公司),TRIzal试剂(赛默飞世尔科技中国有限公司),RT Master Mix试剂盒(上海力敏实业有限公司),GAPDH 一抗(武汉赛维尔公司)。
1.2 实验方法
1.2.1 标本收集与处理 采用膝关节穿刺术收集RA 病人两侧滑膜。将滑膜组织置入含体积分数为0.10双抗磷酸盐缓冲液(PBS)的离心管中(存放冰盒)送检。在生物安全柜中采用体积分数0.10 的PBS清洗标本,并分离标本上血管和脂肪组织。将处理后标本分3份:第1份用于多聚甲醛固定;第2份处理成小块,放入冻存管中置液氮罐内10 min,再置入-80 ℃冰箱中备用;第3 份放入新培养皿中,用于提取FLS。
1.2.2 苏木精-伊红(HE)染色及评分 RA 滑膜常规进行HE 染色后,采用光学显微镜观察RA 滑膜病理变化并记录。滑膜HE染色评分标准见表1。

表1 RA滑膜染色评分标准
1.2.3 免疫组化染色 按照文献方法[11]进行免疫组化染色。采用光镜高倍视野观察细胞改变。免疫组化染色半定量评分标准[12]如下。阳性细胞百分比评分:0分,无阳性细胞;1分,阳性细胞<25%;2分,阳性细胞25%~50%;3 分,阳性细胞51%~75%;4分,阳性细胞>75%。阳性细胞染色强弱评分:0分,无着色;1分,淡黄色;2分,棕黄色;3分,棕褐色。
1.2.4 FLS分离与培养及细胞鉴定 FLS分离及培养参考文献方法[13]进行。细胞鉴定采用PBS清洗第3代冻存FLS共2次,胰蛋白酶消化后终止消化。1 200 r/min离心5 min,去培养基、PBS清洗。加1 m L单细胞悬液,并加CD90、CD29抗体行免疫荧光染色,设阴性对照。避光孵育20 min,用PBS清洗,加缓冲重悬液,采用Rigel S2 流式细胞仪进行检测。
1.2.5 qPCR 检测 提取细胞RNA 后去培养基,PBS清洗后在培养板中滴入500μL 的RA2液混匀,吹打细胞移至内套管内。以12 000 r/min离心1 min,去外套管中液体,内套管内滴500μL 洗脱液;重复操作1次。弃外套管,将内套管移入新EP管内,在膜中央加入洗脱液30μL,室温下静置后以12 000 r/min 离心1 min,获取细胞总RNA。取100 mg组织剪碎研磨,加入1 m L 的TRIzal震荡30 s,室温放置至组织裂解。以8 500 r/min 离心5 min取上清液,加氯仿200μL,震荡30 s,室温放置;再离心15 min取上清液,加等量异丙醇,室温静置10 min,再离心10 min,弃上清液,加500μL 体积分数0.75的乙醇,离心5 min;重复此操作。将沉淀存放室温晾干,加10~20μL 的DEPC 液溶解RNA 后,提取组织RNA。应用微量分光光度仪分别检测细胞和组织RNA 浓度。使用RT Master Mix试剂盒,反转录c DNA 保存于-20 ℃冰箱中备用。qPCR 反应采用两步法进行:①预变,195 ℃条件下持续30 s;②PCR,40、90 ℃条件下进行5 s反应或60 ℃条件下进行30 s反应。qPCR 反应体系按照试剂盒说明配制,所用引物及其序列见表2。

表2 qPCR 扩增引物及其序列
1.2.6 Western blot方法 细胞、组织蛋白提取后备用。取电泳缓冲液粉,参照说明书溶解于1 L 纯水内制成电泳缓冲液。200 A 电泳90 min转膜后,取出膜用50 g/L脱脂牛奶室温闭封2 h。加入一抗(1∶2 000 GAPDH 抗体,1∶1 000 ZNRF3 抗体)4 ℃冰箱摇床上摇动孵育10 h。次日洗膜3次,加入辣根过氧化物酶(HRP)标记的二抗(1∶2 000),室温孵育2 h,再洗膜3次。取ECL试剂A、B底物液1∶1混匀,将冲洗后的膜置入避光反应后进行显影。使用Adobe Photoshop测量各条带灰度值,采用相对灰度值表示蛋白表达量。
1.3 统计学分析
应用SPSS 20.0统计软件对数据进行分析。计量资料数据用±s表示,组间均数比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两侧滑膜组织HE染色评分比较
观察组炎性细胞浸润、纤维组织增生、滑膜细胞增生和新生血管形成等评分均高于对照组,差异均有统计学意义(t=54.243~98.522,P<0.05)。见表3和图1。
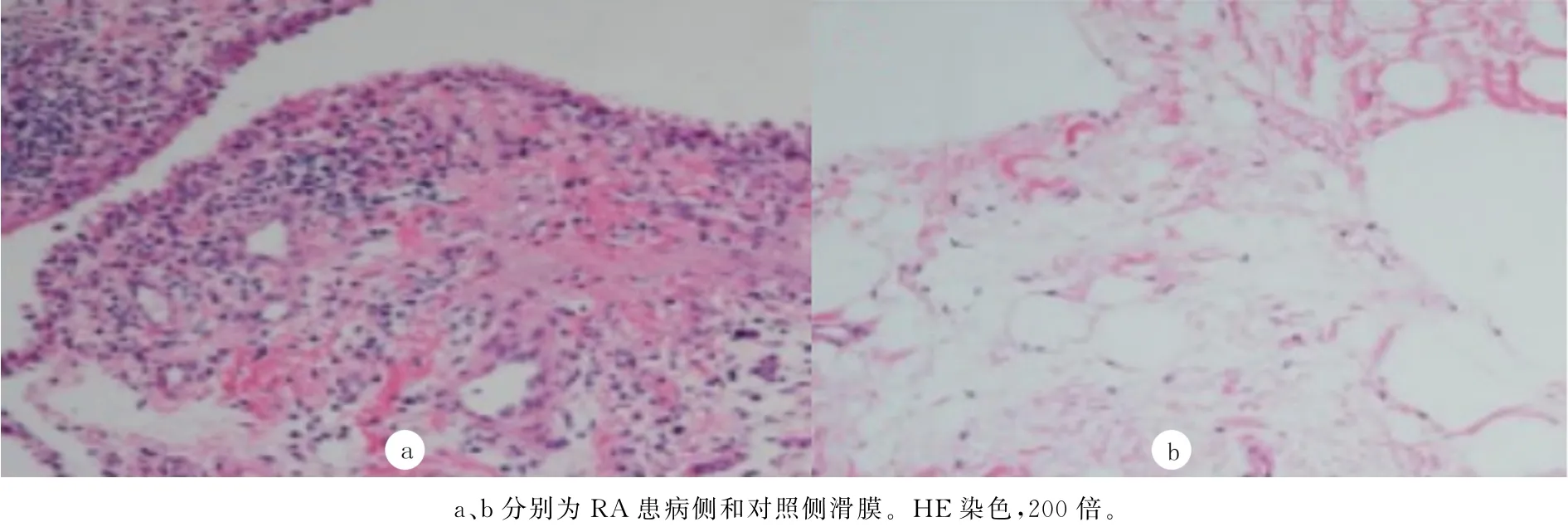
图1 RA病人两侧滑膜组织HE染色
表3 病人两侧HE染色评分比较(n=20,分,±s)

表3 病人两侧HE染色评分比较(n=20,分,±s)
组别 炎性细胞浸润 纤维组织增生 滑膜细胞增生新生血管形成对照组 1.27±0.47 0.57±0.48 0.41±0.38 0.34±0.31观察组 2.81±0.39* 2.02±0.48* 2.71±0.67* 2.27±0.52*
与对照组比较,*t=54.243~98.522,P<0.05。
2.2 FLS细胞形态观察
本研究观察到FLS细胞核呈卵圆形,位于细胞中部,细胞形态呈梭形、星形和纺锤状,边界清晰,周围见聚集性分泌物,还混杂卵圆形巨噬样滑膜细胞(MLS)。细胞传至第3代,MLS分裂、增殖作用丧失,其后FLS、RA-FLS、C-FLS 细胞形态相似。从原代FLS细胞图可见观察组(图2a、b)生长速度较对照组(图2c、d)增快。

图2 FLS细胞形态观察
2.3 FLS细胞鉴定
本研究的细胞检测抗体为CD90、CD29,用于第3代RA-FLS、C-FLS细胞鉴定,若两者阳性率超过90%,则表示提取细胞为纯化FLS。本文检测结果表明,CD90、CD29两者阳性率为93.19%,提示提取细胞为纯化FLS。见图3。

图3 FLS流式细胞检测
2.4 ZNRF3在病人两侧滑膜组织表达比较
ZNRF3在观察组的免疫组化评分、m RNA 和蛋白表达均明显高于对照组,差异均有统计学意义(t=8.963~105.292,P<0.05)。见表4和图4。
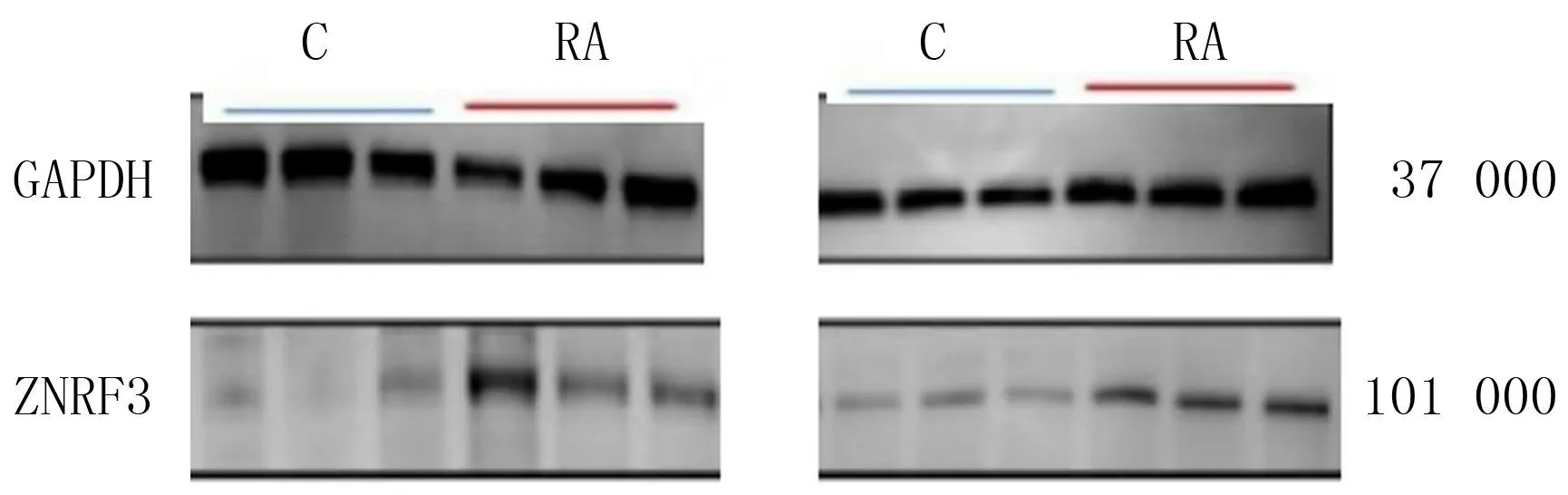
图4 Western blot检测ZNRF3蛋白在病人两侧滑膜组织表达
表4 ZNRF3在病人两侧滑膜组织表达比较(n=20,±s)
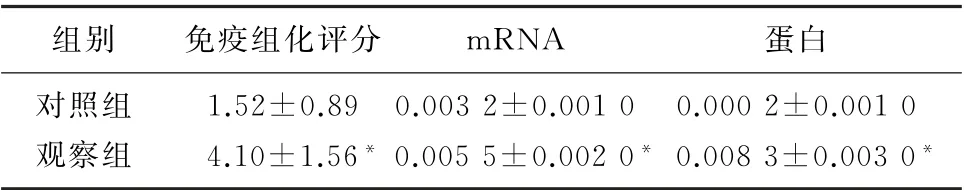
表4 ZNRF3在病人两侧滑膜组织表达比较(n=20,±s)
与对照组比较,*t=8.963~105.292,P<0.05。
组别免疫组化评分m RNA蛋白对照组1.52±0.89 0.003 2±0.001 0 0.000 2±0.001 0观察组 4.10±1.56* 0.005 5±0.002 0* 0.008 3±0.003 0*
2.5 ZNRF3在病人两侧滑膜FLS细胞中的分布与表达
免疫荧光法检测结果显示,ZNRF3(荧光绿)在RA-FLS 和C-FLS 的质膜、细胞质均有表达,但RA-FLS的荧光明显强于C-FLS。见图5。qPCR和Western blot检测结果表明,ZNRF3在RA-FLS的mRNA 和蛋白表达量均明显高于C-FLS,差异均有统计学意义(t=43.330、62.721,P<0.05)。见表5和图6。
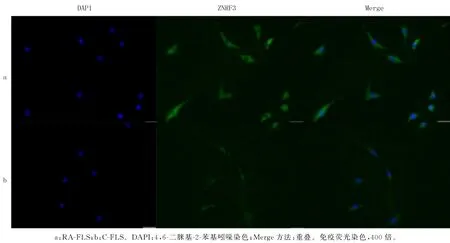
图5 滑膜FLS的免疫荧光检测

图6 Western blot检测ZNRF3蛋白在RA-FLS和C-FLS表达
表5 ZNRF3在病人两侧滑膜FLS细胞中的表达(n=20,±s)

表5 ZNRF3在病人两侧滑膜FLS细胞中的表达(n=20,±s)
与对照组比较,*t=43.330、62.721,P<0.05。
组别m RNA蛋白对照组0.03±0.01 0.000 2±0.000 1观察组0.07±0.02 0.005 0±0.002 0
3 讨 论
ZNRF3是一种调控蛋白,其细胞外结构与R脊柱蛋白相互作用,与富含亮氨酸的G 蛋白偶联受体生成复合物,致使ZNRF3 自动膜清除、泛素化,使胞膜表面卷曲受体蛋白稳定,维持Wnt信号活性通路;细胞表面ZNRF3 结合巢乱蛋白某区,识别Wnt巢乱蛋白,诱导该蛋白泛素化降解,从而抑制Wnt信号通路[14-16]。有学者认为,ZNRF3对Wnt/β-catenin、Wnt/PCP 信号通路呈负性调控性[17]。目前关于ZNRF的研究以肿瘤为主。已有学者指出,在肿瘤疾病中R-spondin-ZNRF3板块常发生突变[18]。有研究表明,ZNRF3对Wnt/β-catenin信号通路的调控属负性,其在肿瘤组织中表达不尽相同[19]。有学者对乳头状甲状腺癌组织与正常甲状腺组织的研究结果显示,ZNRF3在乳头状甲状腺癌组织内呈下调,且与其分化等级呈负相关[20-21]。而ZNRF3在原发性结直肠癌表达上调[22]。ZNRF3在骨关节的研究有待明确,但考虑RA 病变与Wnt信号通路存在联系,推测ZNRF3 可能与RA 病变的发生发展有关。
本研究对膝关节RA 病人的RA 侧与C侧滑膜组织、细胞采用免疫组化、qRCR 和Westen blot法研究显示,病人RA 侧滑膜组织中ZNRF3 表达高于C侧。相关研究已表明,RA 侧Wnt信号通路与其组织发病有关;在RA 侧组织、FLS中,β-catenin表达上调,表示Wnt通路过度激活,并抑制RA 侧的成骨细胞[23-25]。由此推测,ZNRF3在RA 侧滑膜组织中表达增高与Wnt信号通路在滑膜炎症中过度激活相关,ZNRF3在RA 发病中可抑制被过度激活的Wnt通路,而且呈负增长表达[26-27]。进一步分析ZNRF3在RA 发病中的作用,采用酶消法从滑膜组织中分离原代FLS细胞,使用Ⅱ型胶原酶将组织离散成单个细胞,并用含FBS培养基培养数天,使细胞贴壁达80%~90%[28-30]。本文光镜下观察显示,经HE染色的RA 侧滑膜组织明显增生,细胞层数增加,并见大量炎性细胞浸润滑膜间质中,且伴大量新生血管生成,部分组织中见淋巴滤泡形成、间质纤维化。本文应用流式细胞检测术、免疫荧光检测对第3代细胞进行鉴定,并观察ZNRF3在FLS中的表达,结果显示,RA-FLS和C-FLS中ZNRF3均定位于细胞质和质膜,RA-FLS中ZNRF3表达明显增高,而C-FLS中无明显表达,qRCR 与Westen blot检测结果也相同。上述结果均提示,激活Wnt信号通路后可诱导ZNRF3 生成并在细胞核外分泌,从而调控Wnt信号通路活性。
总而言之,RA 病人病变侧滑膜组织、FLS中的ZNRF3表达量升高,推测与Wnt信号通路过度激活诱导ZNRF3生成增加有关,而ZNRF3高表达可负反馈调节Wnt通路活性。

