CYP2C19基因引导的个性化抗血小板治疗在经皮冠状动脉介入术后的应用Meta分析*
马筱洁,张天一,史清海
1.新疆维吾尔自治区人民医院输血科,新疆乌鲁木齐 830001;2.石河子大学医学院临床医学系,新疆石河子 832002;3.新疆军区总医院全军临床检验诊断中心,新疆乌鲁木齐 830001
经皮冠状动脉(简称冠脉)介入术(PCI)主要采用球囊、支架重建冠脉血运,用于冠脉狭窄、闭塞等病变所致的冠心病。以氯吡格雷为代表的P2Y12抑制剂是PCI术后抗血小板治疗的主要药物。氯吡格雷的疗效存在人群差异[1],氯吡格雷用药后出现“血小板高聚集”被定义为氯吡格雷抵抗。持续血小板高聚集与支架植入术后缺血事件强相关[2]。氯吡格雷代谢途径相关功能缺陷基因可升高心血管不良事件风险[3-5]。由CYP2C19同工酶介导的药代途径是氯吡格雷活性代谢的重要途径之一[6]。CYP2C19突变可导致同工酶功能下降,引发氯吡格雷无效或抵抗,CYP2C19突变基因与心血管事件密切相关,药物代谢基因多态性种族分布不一,存在个体差异[7-13]。目前已有系统综述和Meta分析阐明增加氯吡格雷维持剂量和高负荷预处理无法抵消缺陷基因引发的心血管不良事件风险[14-15]。指南推荐对基因突变者选用替代治疗,但其疗效参差不齐[16-19]。患者的生活习惯、合并症、用药依从性均可影响血小板功能或干扰氯吡格雷肝脏代谢[20-21]。CYP2C19基因引导的个性化P2Y12受体抑制剂疗法能否带来确切的临床益处尚存争议[22-23]。虽有Meta分析表明基因型或表型指导的抗血小板治疗在降低主要不良心血管事件和出血事件中均未优于传统治疗[24],但笼统地将主要不良心血管事件和出血事件作为结局指标,割裂了出血与血栓相互关联的平衡性,使得研究不能切实反映氯吡格雷的实际疗效。本研究纳入了2010年1月1日至2020年10月1日发表的随机对照试验(RCT),旨在分析CYP2C19基因引导的个性化疗法存在的问题,评价CYP2C19基因引导组与标准治疗组PCI术后全因死亡、心脏死亡、脑卒中、心肌梗死、出血的发生率、出血与缺血事件的合并发生率及其相应风险指标。进一步阐明CYP2C19基因引导的个性化疗法能否改善患者PCI术后的临床结局,为既往抗血小板用药提供补充或纠正,为PCI术后抗血小板疗法的制订提供根据。
1 材料与方法
1.1文献检索策略 在PubMed、Cochrane Library和Embase平台中检索出2010年1月1日至2020年10月1日公开发表的RCT。英文检索词包含:(1)percutaneous coronary intervention;(2)clopidogrel;(3)CYP2C19。为避免遗漏,将同义词纳入检索范围。
1.2文献纳入排除标准 纳入标准:(1)研究类型为RCT;(2)研究对象为PCI术后运用P2Y12抑制剂的患者;(3)干预措施为CYP2C19基因引导的个性化疗法,对照措施为标准氯吡格雷疗法;(4)主要结局指标为全因死亡、心脏死亡、心肌梗死、脑卒中和出血,次要结局指标为脑卒中、心肌梗死和出血的复合终点事件;(5)随访时长≥180 d。排除标准:(1)重复发表;(2)无法提取数据;(3)未进行临床结局评估。
1.3文献选择 查阅文献标题和摘要,对来自同一临床试验注册号的多篇文章,选取样本量最大的纳入Meta分析。去除综述、病例报告、个案报道和重复发表的文献后,确定符合纳入标准的临床试验。通篇阅读,依据排除标准,去除不符合要求的文献。
1.4数据提取 2名研究者独立提取各项研究的数据。(1)基础资料:第一作者、文章标题、发表年份、发表期刊;(2)试验设计和方法学资料:分组依据、随机方式、盲法设计与实施、样本量估计、研究场所;(3)研究对象基本特征:国籍、年龄、性别、吸烟史、糖尿病史;(4)干预及对照措施、随访时限、终点事件发生率。如遇分歧通过讨论或由第3位研究者决定。
1.5文献质量评价 文献质量评价由2名研究者分别参照Cochrane风险偏倚评价工具,对照偏倚评估条目对入选的临床试验进行随机序列生成方法、分配方案是否隐藏、实施和参与者盲法、结局的评估盲法、是否存在不完整结局数据及对其的处理方式、是否存在报告偏倚及其他未说明的偏倚6方面的详细评估。如遇分歧通过讨论或由第3位研究者决定。
1.6终点临床结局指标 本研究的主要结局指标为最长随访时间内,研究对象发生全因死亡、心脏死亡、心肌梗死、脑卒中和出血;次要结局指标为脑卒中、心肌梗死和出血的复合终点。
1.7统计学处理 应用I2检验评估异质性,I2>50%时,表明异质性显著,使用随机效应模型;I2<50%时,使用固定效应模型。当各项试验存在显著异质性时,采用亚组或敏感性分析明确异质性来源。合并终点临床结局指标,运用Mantel-Haenszel统计方法计算RR及其95%CI,检验水准设为0.05。采用Cochrane Review Manager 5.4.1进行数据分析。
2 结 果
2.1纳入研究的基本情况及质量评价 共检索出513篇RCT,筛选程序如图1。最终纳入5项RCT[25-29]的7 328名研究对象,其中3 673名接受CYP2C19基因引导的个性化治疗,3 655名接受标准治疗。临床试验中位随访时限为12个月,涵盖亚洲、欧洲、美洲地区,一般信息汇总于表1。各试验均为开放标签试验,Cochrane风险偏倚评价见表2。

表1 纳入研究一般信息
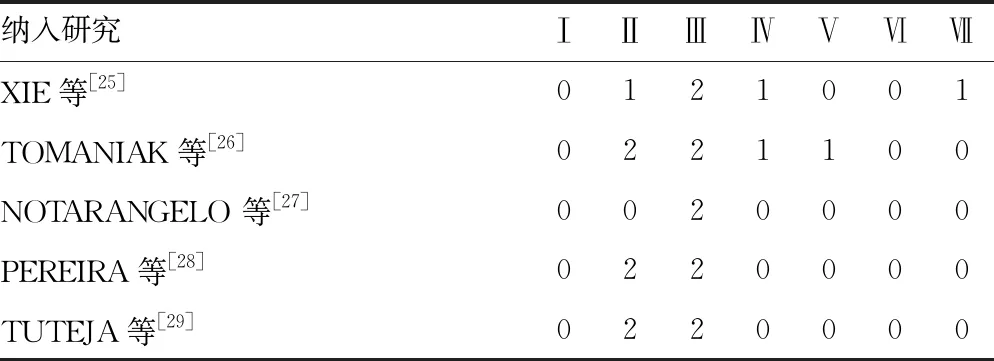
表2 Cochrane系统评价纳入研究质量
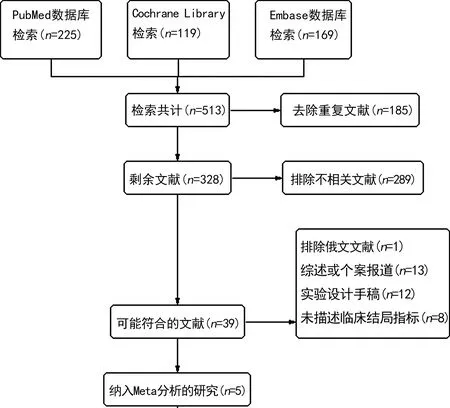
图1 文献检索及纳入流程
2.2Meta分析
2.2.1基线资料 入选的7 328名研究对象中女性占25.3%;29.5%的研究对象曾经有过或当下有吸烟史;糖尿病患病率27.9%。各项研究的基线资料见表3。

表3 纳入研究的研究对象基线资料
2.2.2临床结局 CYP2C19基因引导组和标准治疗组,全因死亡率分别为1.09% (35/3 225)和1.34%(43/3 215)(RR=0.81,95%CI:0.52~1.26,P=0.360);心脏死亡率分别为1.46% (50/3 424)和1.79%(61/3 400)(RR=0.81,95%CI:0.56~1.16,P=0.250);脑卒中发生率分别为0.49%(18/3 639)和0.63%(23/3 629)(RR=0.78,95%CI:0.42~1.44,P=0.430);心肌梗死发生率分别为1.74%(64/3 673)和3.12%(114/3 655)(RR=0.55,95%CI:0.41~0.75,P<0.001);出血发生率分别为1.77%(65/3 673)和2.11%(77/3 655)(RR=0.84,95%CI:0.61~1.16,P=0.290);脑卒中、心肌梗死与出血复合发生率为3.96%(144/3 639)和5.84%(212/3 629)(RR=0.63,95%CI:0.43~0.93,P=0.020);亚组分析显示亚洲地区主要心血管不良事件发生率分别为2.64%(18/682)和6.18%(43/696)(RR=0.43,95%CI:0.25~0.73,P=0.002)。见表4。
2.2.3异质性检验 纳入的5项RCT的全因死亡、心脏死亡、脑卒中、心肌梗死和出血发生率在各研究间无显著异质性,I2<50%(P>0.1)。见表4。

表4 异质性检验及Meta分析结果
3 讨 论
本研究共纳入5项RCT,Cochrane风险偏倚结果显示,各项研究均不符合盲法的设计要求。原因在于,CYP2C19基因引导组是在已知研究对象CYP2C19基因型情况的前提下制订的。其次,参与制订治疗方案的医生在决策前已知CYP2C19功能缺陷的个体在运用氯吡格雷治疗过程中可能会发生氯吡格雷抵抗,在选择替代治疗药物时易受主观因素影响。各项研究中CYP2C19基因引导组与标准治疗组均采用1∶1随机对照设计。两组年龄、性别比例、吸烟史、糖尿病史等基线资料具有可比性,5项研究无显著异质性。单中心研究在总体的代表性上稍差,各项研究均有效降低了报告偏倚和部分选择偏倚。
5项研究分别来自全球8个地区和国家;CYP2C19基因型在种族分布中有差异。有横断面研究显示CYP2C19基因频率在不同人种、不同地理区域间差异很大[30-31]。在整个非洲、欧洲和美国,氯吡格雷中代谢和慢代谢的平均患病率相似,约30%携带功能缺陷基因。然而,在亚洲人群中,70%以上的人群携带功能缺陷基因。亚组分析表明基因引导的个性化抗血小板治疗在亚洲地区具有一定的临床效果,有效降低了主要不良心血管事件的风险。
本研究针对纳入文献原始资料中的主要不良心血管事件进行单项拆分,在确保临床结局指标定义一致后,进行定量综合分析。基因引导的个性化治疗显著降低了PCI术后再次心肌梗死的发生率,且基因引导下的个性化抗血小板治疗在减少出血、缺血事件的总体发生率上优于传统治疗。
本研究尚存在一定局限性。本研究试图纳入高质量RCT,以说明CYP2C19基因引导的个性化治疗与“一刀切”式的传统治疗的差异。纳入的RCT中存在单中心研究、随访时间不一致、个性化治疗方案不统一等问题。不同试验的干预措施存在差异,基因引导的个性化治疗方案通常依据研究对象CYP2C19基因型制订,但治疗方案不完全相同。CYP2C19基因引导组中CYP2C19*1/*1型多选用氯吡格雷;CYP2C19*2/*2、*2/*3或*3/*3突变者倾向于选用替格瑞洛替代治疗,仅XIE等[25]的研究对功能缺陷基因者选用高剂量氯吡格雷。各项研究未给出各组不同基因型患者的临床结局事件发生率,无法比较两方案在各基因型亚组中的有效性和安全性,对于纳入的高质量RCT的资料利用不充分。CYP2C19基因引导组与标准治疗组结局受多方因素干扰,其终点临床结局是所有因素的综合作用结果。有研究表明质子泵抑制剂、钙通道阻滞剂、华法林等可在肝脏CYP450酶介导的药物代谢途径中阻碍或竞争细胞色素酶,影响氯吡格雷体内代谢[32]。血糖代谢紊乱者活化血小板水平较高,未成熟血小板的比例更高,可减弱氯吡格雷的抑制作用,且糖尿病与围术期并发症相关[33-34]。研究对象的糖尿病严重程度和吸烟状况可能影响体内血小板的基础反应性。
精准医疗是当今医药卫生事业前进的方向,针对特定人群的最优治疗对于减少不良反应、提高药物安全性、保证疗效有着不可忽视的作用。基于药物代谢基因或表型引导的个性化治疗能否带来“因地制宜”的临床优势,尚需要进一步探索。本研究对于今后CYP2C19基因引导的个性化治疗的RCT提供了借鉴之处。考虑到药物在体内发挥疗效的过程中易受到研究对象内环境、遗传变异、生活习惯、合并症、药物配伍等多方因素的影响,在设计临床试验时,应尽可能采用随机区组控制混杂因素,防止人为干扰。明确个性化治疗和标准治疗的具体内容,包括剂量、剂型、给药方式及频率等。提高研究对象依从性,定期随访、敦促复诊,以减少不依从或依从性低带来的影响。制订标准化测量方法,采用发病率、发生率等直接证据,避免采用中间结局替代指标以减少信息偏倚。在评价抗血小板药物疗效时应力求血栓与出血保持动态平衡,既预防血栓形成又避免血小板功能低下导致出血。当运用新型P2Y12抑制剂时,患者出血风险可能提高[35],同理,抗血小板疗效不佳亦可发生血栓。以心肌梗死、缺血性脑卒中、支架内血栓形成为代表的缺血事件和出血事件作为血栓与出血的结局观测指标,两者彼此关联,其复合发生率可以更好地代表体内抗血小板药物的实际临床疗效,更全面地评估抗血小板治疗方案的安全性和有效性。
综上所述,CYP2C19基因引导的个性化治疗与标准治疗相比可明显降低PCI术后1年内再发心肌梗死风险,减少脑卒中、心肌梗死和出血的发生。

