血清IL-33水平及其基因多态性与HBV感染临床转归的相关性
刘婷婷, 林玉婷, 米 拉, 李晓勤
(乌鲁木齐市妇幼保健院检验科,新疆 乌鲁木齐 830001)
目前,全球范围内约有3亿人感染或携带乙型肝炎病毒(hepatitis B virus,HBV),亚洲和非洲为高发地区[1]。流行病学调查结果显示,我国约有2 300万例慢性乙型肝炎(chronic hepatitis B,CHB)患者,而HBV感染人数则高达1.3亿[2]。机体感染HBV后会产生抗病毒免疫应答,一方面可控制病毒的复制,清除病毒,促使部分患者病情得到缓解甚至康复;另一方面,抗病毒免疫应答会诱使机体发生炎性反应,导致部分患者肝脏受到损伤,甚至进展为肝硬化或肝癌[3]。有研究结果显示,有10%~30%的HBV感染者会发展为肝硬化或肝癌[4]。因此,分析肝硬化的发病机制,探讨特异性生物学指标具有十分重要的临床意义。白细胞介素33(interleukin 33,IL-33)是白细胞介素家族成员之一,主要通过参与辅助性T细胞(T helper cell,Th)介导的免疫应答及促进炎性反应来调节Th1/Th2平衡[5]。HBV的清除及感染的慢性化与Th1/Th2平衡密切相关[6]。为此,本研究拟探讨血清IL-33水平及其基因多态性与HBV感染临床转归之间的相关性。
1 材料和方法
1.1 研究对象
在2017年1月—2020年1月乌鲁木齐市妇幼保健院婚检或因不孕不育而就诊的患者中选取341例HBV感染患者,其中自限性HBV感染者93例(自限性感染组,其中男60例、女33例,年龄35~47岁)、无症状慢性HBV携带者91例(HBV携带组,其中男56例、女35例,年龄36~47岁)、CHB患者90例(CHB组,其中男55例、女35例,年龄34~46岁)、乙型肝炎相关肝硬化患者67例(肝硬化组,其中男40例、女27例,年龄35~47岁)。各组间年龄和性别差异均无统计学意义(P>0.05)。女性患者在乌鲁木齐市妇幼保健院完成随访;男性患者转院至综合性医院(合作单位)进行治疗并完成随访。本研究经乌鲁木齐市妇幼保健院伦理委员会批准[批准号:(2016)022]。
1.2 纳入及排除标准
1.2.1 纳入标准 (1)HBV携带者为血清乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)阳性,且1年内随访3次,每次间隔3~4个月,每次随访丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平均正常;(2)自限性HBV感染者为无急性或慢性乙型肝炎史,且未接种过乙型肝炎疫苗,HBsAg和乙型肝炎e抗原阴性,血清乙型肝炎表面抗体和/或乙型肝炎核心抗体或乙型肝炎e抗体阳性,ALT水平正常;(3)肝硬化及CHB诊断符合《慢性乙型肝炎防治指南(2015更新版)》中的诊断标准[7];(4)年龄≥18周岁;(5)研究对象及其家属知情同意。
1.2.2 排除标准 (1)既往有手术史者;(2)合并其他肝炎病毒感染或肝脏疾病者;(3)合并严重其他疾病者;(4)精神状态异常或依从性差者。
1.3 方法
1.3.1 样本采集 采集所有对象入组次日清晨空腹静脉血12 mL,平均分成4份,其中2份置于枸橼酸钠抗凝管中,用于ALT、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TB)检测及外周血DNA提取;2份置于无添加剂真空管中,立即分离血清,用于IL-33及HBV DNA检测。
1.3.2 生化指标检测 ALT、AST及TB检测试剂盒购自美国R&D公司,检测仪器为AU5800全自动生化分析仪(美国贝克曼库尔特公司)。严格按仪器和试剂盒说明书操作。
1.3.3IL-33基因rs10975519位点单核苷酸多态性检测 采用DNA提取试剂盒[伊艾博(武汉)科技股份有限公司]提取外周血DNA,采用聚合酶链反应(polymerase chain reaction,PCR) 检测IL-33基因rs10975519位点单核苷酸多态性。检测仪器为ABI 7500型荧光定量PCR扩增仪(美国ABI公司)。引物由北京鼎国生物科技有限公司设计并合成,上游引物序列为5'-ACCTTTATGCCACTGCTATGA-3',下游引物序列为5'-GAATCTAAGGTTTTACCATGAGC-3'。反应条件为:95 ℃预变性30 s,变性95 ℃ 10 min,退火60 ℃ 1 min,循环35次。严格按仪器和试剂盒说明书操作。
1.3.4 血清IL-33水平检测 采用酶联免疫吸附试验检测血清IL-33水平,试剂盒购自上海碧云天公司,检测仪器为Microlab STAR多功能酶标仪(瑞士Hamilton公司)。严格按仪器和试剂盒说明书操作。
1.3.5 血清HBV DNA检测 采用PCR检测血清HBV DNA载量。试剂盒购自上海江莱生物科技有限公司,检测仪器为DA7600实时荧光定量PCR仪(杭州安誉科技有限公司)。严格按仪器和试剂盒说明书操作。
1.4 统计学方法
采用SPSS 22.0软件进行统计分析。采用Shapiro-Wilk检验对计量资料进行正态分布检验。呈正态分布的计量资料以±s表示,多组间比较采用方差分析;两两比较时,若方差齐性,采用LSD-t检验,若方差不齐则采用Dunnett-t3检验。计数资料以例或率表示,组间比较采用χ2检验。采用Pearson相关分析评估IL-33与ALT、AST及TB的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 各组各项指标的比较
自限性感染组、HBV携带组、CHB组、肝硬化组ALT、AST、TB及IL-33水平依次升高,各组间差异均有统计学意义(P<0.05)。见表1。
表1 各组各项指标的比较 ±s

表1 各组各项指标的比较 ±s
注:与自限性感染组比较,*P<0.05;与HBV携带组比较,#P<0.05;与CHB组比较,△P<0.05;空白表示无此项。
组别 例数 ALT/(U/L) AST/(U/L) TB/(μmol/L) IL-33/(pg/mL)自限性感染组 93 31.34±5.92 33.29±6.03 59.47±9.95 39.21±7.35 HBV携带组 91 36.26±3.35* 50.22±10.94* 89.58±13.34* 84.56±17.83*CHB组 90 125.57±34.13*# 131.48±30.93*# 123.89±15.92*# 128.74±34.72*#肝硬化组 67 355.31±102.58*#△ 294.87±86.34*#△ 189.72±23.21*#△ 198.71±45.66*#△F值 711.151 606.994 435.298 969.724 P值 <0.001 <0.001 <0.001 <0.001
2.2 IL-33水平与ALT、AST及TB水平的相关性
Pearson相关分析结果显示,IL-33水平与ALT、AST及TB水平均呈正相关(r值分别为0.447、0.459、0.512,P值分别为<0.001、<0.001、0.018)。
2.3 CHB组及肝硬化组不同亚组血清IL-33水平比较
根据HBV DNA、ALT、AST及TB参考区间上限分别将CHB组及肝硬化组进行分组,并比较血清IL-33水平。在CHB组中,HBV DNA>1×105者血清IL-33水平高于HBV DNA≤1×105者(P<0.05),ALT>40 U/L者与ALT≤40 U/L者之间、AST>40 U/L者与AST≤40 U/L者之间、TB>20 μmol/L者与TB≤20 μmol/L者之间血清IL-33水平差异均无统计学意义(P>0.05),见表2。在肝硬化组中,HBV DNA>1×105者、ALT>40 U/L者、AST>40 U/L者及TB>20 μmol/L者血清IL-33水平分别高于HBV DNA≤1×105者、ALT≤40 U/L者、AST≤40 U/L者及TB≤20 μmol/L组(P<0.05),见表3。
表2 CHB组不同亚组之间血清IL-33水平比较pg/mL,±s

表2 CHB组不同亚组之间血清IL-33水平比较pg/mL,±s
注:与HBV DNA≤1×105 拷贝/mL比较,*P<0.05;空白表示无此项。
项目 例数 IL-33 HBV DNA≤1×105 拷贝/mL 33 122.94±16.21>1×105 拷贝/mL 57 124.76±12.35*ALT≤40 U/L 39 122.46±15.03>40 U/L 51 123.87±16.12 AST≤40 U/L 34 121.71±15.67>40 U/L 56 124.25±13.78 TB≤20 μmol/L 31 121.54±15.22>20 μmol/L 59 124.21±13.45
表3 肝硬化组不同亚组之间血清IL-33水平比较pg/mL,±s

表3 肝硬化组不同亚组之间血清IL-33水平比较pg/mL,±s
注:与HBV DNA≤1×105 拷贝/mL比较,*P<0.05;与ALT≤40 U/L比较,#P<0.05;与AST≤40 U/L比较,△P<0.05;与TB≤20 μmol/L比较,▲P<0.05;空白表示无此项。
项目 例数 IL-33(pg/mL)HBV DNA≤1×105 拷贝/mL 34 156.78±18.97>1×105 拷贝/mL 33 223.65±24.45*ALT≤40 U/L 31 167.21±14.56>40 U/L 36 209.13±25.56#AST≤40 U/L 29 161.39±22.45>40 U/L 38 211.35±23.11△TB≤20 μmol/L 29 172.34±23.35>20 μmol/L 38 202.94±24.47▲
2.4 各组IL-33基因rs10975519位点基因型及等位基因分布情况
自限性感染组、HBV携带组、CHB组及肝硬化组之间IL-33基因rs10975519位点基因型及等位基因分布频率差异均有统计学意义(P<0.05)。TT基因型在自限性感染组中分布频率最高,肝硬化组最低;而TC和CC基因型在自限性感染组中分布频率最低,肝硬化组最高。见表4。
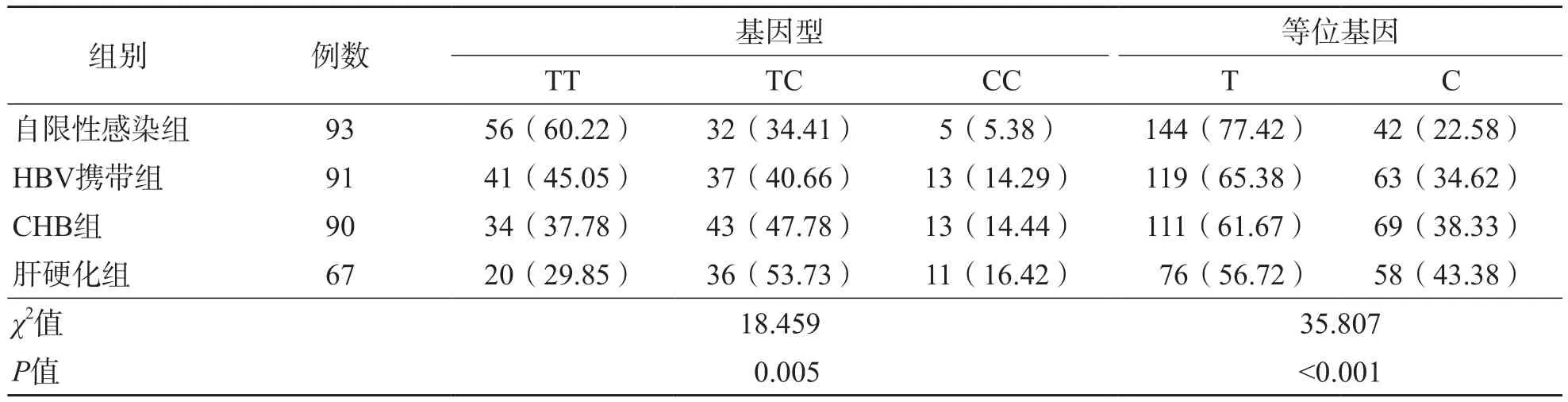
表4 各组IL-33基因rs10975519位点基因型及等位基因分布情况
3 讨论
目前,HBV感染已呈全球流行趋势。由于HBV可在患者体内长期复制,导致机体处于“循环坏死和再生修复”的恶性循环中,促使肝细胞纤维化,若患者未得到及时治疗,肝细胞纤维化过程将进一步发展,并重复坏死和修复过程,最终导致患者发展为失代偿期肝硬化甚至原发性肝癌,而这一过程往往是不可逆的[8]。因此,如何有效预防和阻止HBV感染患者发展为肝硬化是临床关注的重点。
HBV感染的慢性化与疾病的进展密切相关。根据细胞因子的功能可将Th分为Th0、Th1和Th2。当感染HBV后,机体将促进免疫机制活性清除病毒,在此过程中,Th1及Th2起关键作用,且发挥着不同的作用[9]。在机体清除肝细胞中的HBV同时也会导致肝功能出现不同程度的损伤,当HBV未被完全清除时,会进一步发展为慢性HBV感染,这一过程与Th2介导的体液免疫密切相关[10-11]。
目前,病理活检是肝脏疾病诊断和分期的金标准。但病理活检存在一定的不足:(1)取样部位局限,导致检查结果可能存在一定的偏差;(2)属于有创检查,患者接受度较低;(3)难以长期监测病情,无法提供动态结果。因此,寻找可用于乙型肝炎病情监测的特异性生物学指标具有十分重要的临床意义。IL-33参与了机体炎性反应过程及免疫机制,与多种免疫系统疾病的发生、发展密切相关。有研究结果显示,IL-33可同时放大Th1及Th2介导的免疫反应,从而对机体的免疫应答起到调节作用[12]。VOCCA等[13]的研究结果显示,慢性乙型肝炎患者IL-33水平显著上升,并在HBV感染的慢性化进程中起关键作用。本研究结果显示,随着HBV感染患者病情的加重,血清IL-33水平逐渐升高,说明IL-33可能与HBV感染的严重程度有关。本研究进一步将CHB组和肝硬化组根据HBV DNA载量及ALT、AST、TB水平进行分组。结果显示,在CHB组中,HBV DNA载量较高者血清IL-33水平显著升高;在肝硬化组中,HBV DNA载量及ALT、AST、TB水平较高者血清IL-33水平显著升高。Pearson相关分析结果显示,IL-33水平与ALT、AST及TB水平均呈正相关(r值分别为0.447、0.459、0.512,P值分别为<0.001、<0.001、0.018)。这也进一步证实IL-33在HBV感染的慢性化进程中发挥着一定的作用。
IL-33基因rs10975519位点单核苷酸多态性分析结果显示,各组IL-33 rs10975519位点基因型及等位基因分布频率差异均有统计学意义(P<0.05)。TT基因型在自限性感染组中分布频率最高,肝硬化组最低;而TC和CC基因型在自限性感染组中分布频率最低,肝硬化组最高。这提示IL-33基因rs10975519位点与慢性HBV感染有关,且C等位基因可能会增加CHB进展为肝硬化的风险。
本研究尚有不足之处:(1)本研究为单中心研究,样本量较小且来源单一;(2)IL-33基因rs10975519位点的表达在不同地区及种族之间存在一定的差异,但本研究受样本量限制,未进一步对不同地区或种族进行分析;(3)未分析原发性肝癌患者的血清IL-33水平及IL-33基因rs10975519位点单核苷酸多态性。
综上所述,IL-33水平与HBV感染的病情进展密切相关,IL-33基因rs10975519位点C等位基因可能会增加CHB进展为肝硬化的风险。

