东莞地区319例耳聋高危人群耳聋基因筛查及产前诊断
付有晴 娄季武 赵颖 李根洪 骆玥瑜 谭淑娟 刘彦慧
东莞市妇幼保健院(东莞 523000)
听力损失(Hearing loss,HL)是中国最常见的先天缺陷之一,在新生儿中的发生率为1/1000-3/1000[1]。WHO调查显示在3.6亿HL的人群中,儿童占有3200万。HL与很多因素有关,包括有遗传因素和环境因素,或两者之间的相互作用[2]。据报道,50%的HL与遗传因素有关,其中70%为非综合征性听力损失(non-syndromic hearing loss,NSHL),大约80% NSHL是常染色体隐性遗传的[3,4],根据分子病因学表明,GJB2,GJB3,SLC26A4和线粒体12Sr RNA(mtDNA 12Sr RNA)是导致NSHL最常见的4个基因[5-9]。因此,本研究拟对常见的这4个基因进行测序检测,以明确HL病因,并对有生育或再生育要求的遗传性HL家庭进行产前诊断从而有效的避免HL患儿的出生。
1 研究对象与方法
1.1 研究对象
选取2015年6月-2019年9月就诊于东莞市妇幼保健院产前诊断中心和耳鼻喉科门诊的HL高危人群,包括有家族史、曾生育HL患儿史、夫妇一方或双方为HL者、家庭中有成员为耳聋基因筛查阳性者。对所有高危人群进行临床资料采集,包括基本资料、家族史、用药史、患病史、听力筛查及诊断结果、颞骨CT和MRI等结果。
1.2 研究方法
1.2.1 标本的采集与处理
经研究对象知情同意后,抽取外周静脉血3ml,紫色EDTA抗凝。而对于接受产前诊断的孕妇,在超声引导下,根据妊娠的孕周选择适当的取材方法,妊娠约11-13w时行绒毛膜取样,16-22w时行羊膜腔穿刺羊水取样,22-37w时行脐带血穿刺脐血取样。用试剂盒(厦门致善生物技术有限公司)提取样本DNA,紫外分光光度计NanoDrop 2000对DNA进行浓度及纯度测定后进行扩增及测序,整个测序反应由广州凯普生物科技有限公司完成,使用PCR技术对SLC26A4、GJB2、GJB3、mtDNA 12Sr RNA这4个基因的目标区域进行扩增,并采用特异性引物进行Sanger测序检测,特异性引物的设计是专门针对目标位点,并覆盖该位点上下游的序列,将标本检测得到的序列与NCBI所提供SLC26A4基因参考序列(NG_008489.1)/(NM_000441.1)、GJB2基因参考序列(NM_004004.5)、GJB3基因参考序列(NM_001005752.1)、mtDNA 12Sr RNA基因参考序列(NC_012920.1)进行比对。
1.2.2 随访
所有新生儿出生后均随访其听力筛查结果,以确定是否存在HL及HL的性质及程度,包括:①畸变产物耳声发射(Distortion product otoacoustic emission,DPOAE)检测;②听性脑干反应检测(Automated auditory brainstem response,AABR)。
2 结果
2.1 HL高危人群组成情况
在319例HL高危人群中,包括89(252例)个HL高危家庭和67例个人,89个高危家庭中,已生育聋儿家庭48(149例)个,夫妇一方或双方为HL患者的家庭9个,家庭成员为HL基因筛查阳性者或有家族史的家庭共32个;67例个人中,HL患者共43例,有家族史3例,家庭成员为HL基因筛查阳性者6例,要求进行耳聋基因检查者15例。其他31例。
2.2 HL基因检测结果
共发现182人携带致聋基因突变,检出率57.05%。其中GJB2基因突变109例(纯合突变和复合杂合突变24例,杂合85例),占59.89%;SLC26A4基因52例(纯合突变和复合杂合突变8例,杂合44例),占28.57% ;mtDNA 12Sr RNA基因突变13例(1555A>G同质性突变7例,异质性突变1例,1494C>T同质性突变3例,7444G>A同质性突变2例),占7.14%;GJB3基因杂合突变4例,占2.20%;GJB2/SLC26A4双杂合突变型3例,占1.65%;GJB3/SLC26A4双杂合突变型1例,占0.55%。详见表1。
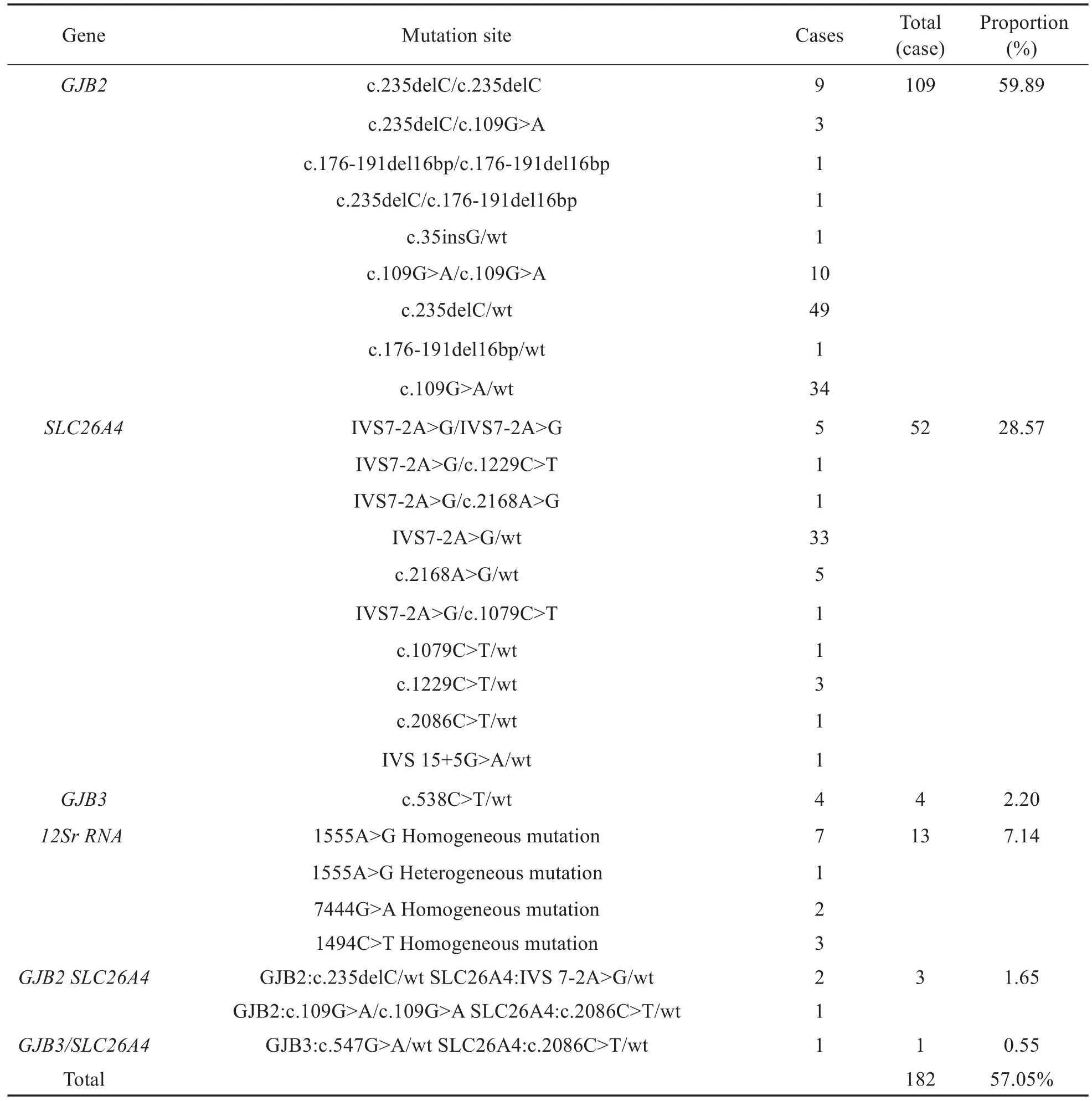
表1 182例HL高危人群携带致聋基因突变的基因型Table 1 Genotypes of deaf-causing gene mutations in 182 high-risk groups of HL
2.2.1 89个高危家庭HL基因检测结果
在已生育聋儿48个高危家庭中,明确HL病因的家庭21个,包括GJB2基因纯合和复合杂合突变15个,SLC26A4基因纯合和复合杂合突变6个;未明确HL病因的家庭27个,包括GJB2基因杂合突变5个,SLC26A4基因杂合突变5个,GJB3基因杂合突变1个,正常的16个。在剩下的41个高危家庭中,携带有HL基因突变家庭29个,其中双方携带HL基因突变家庭8个:包括双方均为GJB2基因杂合突变2个;双方均为SLC26A4基因杂合突变2个;一方为SLC26A4基因杂合突变,一方为SLC26A4基因纯合突变1个;一方为GJB2基因杂合突变,一方为SLC26A4基因杂合突变2个;一方为GJB2基因杂合突变,一方为mtDNA 12Sr RNA同质性突变1个。一方为HL基因携带者家庭21个:包括GJB2基因纯合突变2个,杂合突变5个;SLC26A4基因杂合突变7个;mtDNA 12Sr RNA同质性突变7个,其中5个为女方,2个为男方。正常的12个。
2.2.2 67例个人HL基因检测结果
在67例个人中,携带HL常见基因者共30例。在32例HL患者中,携带HL基因者17例,包括GJB2基因纯合突变2例,杂合突变9例;SLC26A4基因纯合突变1例,杂合突变2例;GJB3基因杂合突变1例;GJB2基因纯合突变合并SLC26A4基因杂合突变1例;GJB2基因杂合突变合并SLC26A4基因杂合突变1例。在其他35例正常个人中,携带HL基因者13例,包括GJB2基因纯合突变1例,杂合突变7例;SLC26A4基因杂合突变4例;GJB3基因杂合突变1例。
2.3 HL产前诊断及随访结果
在89个高危家庭中,夫妇双方均为耳聋同基因型携带者29个,目前6例已妊娠并进入产前诊断流程,其中初次妊娠者3例,再次妊娠者3例。共采集羊水标本4例,绒毛标本2例。结果显示1例胎儿为GJB2纯合突变,在知情同意下已终止妊娠;4例为GJB2杂合突变,1例为正常,随访至出生,均通过了听力筛查检测。详见表2。

表2 6例孕妇的产前诊断结果Table 2 Prenatal diagnosis results of 6 pregnant women
3 讨 论
由于HL的遗传异质性和表型多样性,在临床上为患者提供适当的遗传咨询仍面临着巨大挑战。到目前为止,数百种与遗传性HL相关的基因被确定。而大多数NSHL是由GJB2,SLC26A4,mtDNA 12Sr RNA和GJB3这四个基因突变所引起的[5,7]。以此为HL基因的产前诊断提供了相应的理论基础。在本研究中,用Sanger测序分析了319例HL高危人群中这四个基因的43个突变位点,结果表明,在109例(59.89%)携带GJB2基因突变的患者中,20例为GJB2基因纯合突变,4例为GJB2基因复合杂合突变,85例为GJB2基因单杂合突变。其中235delC最常见,占19.4%(62/319),其次是109G>A和176_191del16bp,分别占15.0%(48/319)和0.94%(3/319)。研究表明在中国人群中[8,9],GJB2基因最常见的突变类型是235delC,299_300delAT和176_191del16bp,本次研究结果与之较一致,但新增了109G>A的突变位点,本次研究发现109G>A纯合突变11例,其HL程度以轻中度为主,有7例表现为单/双耳轻度异常,2例表现为双耳中度异常,2例正常;235delC和109G>A的复合杂合子3例,其中1例为双耳轻度异常,1例为左耳重度异常。在早期研究中,由于109G>A突变在正常人群中的高携带率,故认为是良性多态性[10,11]。然而,在越来越多的HL患者中鉴定出109G>A纯合突变或合并GJB2基因其它致病性位点的复合杂合子,认为109G>A可能增加HL的风险,尤其是导致轻度或中度的HL,并具有不完全的外显率[12-16],目前已明确109G>A是致病变异[17],约65%的109G>A突变患者患有先天性HL,其余35%的患者发病延迟。患者的HL程度从正常到严重HL不等,其严重程度与年龄密切相关[18,19]。
SLC26A4基因突变会引起大前庭导水管综合征(Enlargement of the vestibular aqueduct,EVA),其突变频率仅次于GJB2基因[20]。在东亚和高加索人群中,SLC26A4突变引起5-7%先天性的隐性听力障碍。目前,SLC26A4基因中有超过140个突变被报道,在SLC26A4基因编码区域中和剪接位点检测到大量突变,而较少的突变发现在非编码外显子1和FOX1结合内转录调节元件。Yuan[21]等人研究发现在中国人群中,最常见的突变位点为IVS7-2A>G,2168A>G和1174A>T。在本次研究中,发现最常见的突变位点是IVS7-2A>G,2168A>G和1229C>T,与Yuan等人的发现较一致。本研究中,在48个已生育聋儿家庭中,检测出聋儿SLC26A4基因纯合突变或复合杂合突变6个,其中2个患儿颞骨CT/MRI检测有EVA;SLC26A4基因单杂合突变5个,5个患儿均有EVA,基因型均为IVS7-2A>G单杂合突变。根据文献报道[22,23],大约有70%的SLC26A4单杂合突变合并有EVA,部分学者推测可能在此基因的启动子区域或者具有潜在剪切位点的内含子区存在另一个突变,或与功能性相关的基因(FOX11,KCNJ10)编码区相关,从而导致患儿出现EVA。因此对于SLC26A4单杂合突变者,需密切观察听力变化,并联合影像学检查观察。
本研究中,发现13名患者携带mtDNA 12Sr RNA1555A>G突变,占7.14%。携带mtDNA 12Sr RNA突变可导致氨基糖苷类药物引起的HL[24]。由于临床实践中对氨基糖苷类药物的严格控制,导致因药物引起的HL患者比例很小。在这项研究中,发现4名患者携带GJB3基因突变位点,均为单杂合突变。
本次研究中,已生育聋儿家庭中,有16个HL患儿未检出HL基因突变,考虑患儿可能存在本次检测范围外的其他突变位点的存在。据相关的研究表明,我国非综合征HL患者中约1/3可通过常见HL基因全序列检测明确分子病因及致聋突变,另有1/6可通过二代测序等手段在已知的罕见HL基因中明确病因及突变,而近半数患者经以上检测后仍病因不明[25]。这部分患者可能为一些环境因素所致,如巨细胞病毒感染、头部创伤、耳毒性药物的使用等,通常这种情况下再生育聋儿的风险不会特别的增加。但另一方面,这些患者也可能为目前所未知的一些遗传因素所致,包括未知HL基因突变或已知HL基因的非编码区突变及大片段DNA缺失或改变等所导致,这种情况就给临床上的遗传咨询带来很大的难度,期望未来能有更大范围和深度的基因筛查与临床大数据的积累及基因突变的功能学研究以进行明确的突变致病性判断,从而能有效的降低再生育聋儿的风险。
在这项研究中,对6个父母双方均为HL基因携带者的高危家庭进行产前诊断,遗传分析和遗传咨询表明1个胎儿的基因型是与先证者一致,所以这1个家庭决定终止妊娠。1个胎儿未发现突变,其他4个胎儿的基因型与他们的父母相同,亦为携带者。随访结果显示这5名胎儿出生后听力正常。检测耳聋夫妇GJB2,SLC26A4和mtDNA 12Sr RNA基因以确定基因型并根据基因型估算复发风险。如果父母携带的致病基因位于不同的基因,他们的后代患病的风险较低,不需要产前诊断。如果父母是同种基因突变(GJB2或SLC26A4),它们的后代有25%的耳聋风险,建议产前诊断后进行风险评估。如果母亲携带mtDNA 12Sr RNA突变,他们的兄弟姐妹,母亲和后代应终身禁止服用氨基糖苷类药物,以有效预防耳聋的发生。
在HL高危人群中,HL基因突变携带率较高,因此对高危人群尽早进行HL基因筛查,提供相应的HL基因诊断,对HL病因分析和高危家庭夫妻在孕期的产前咨询和诊断意义重大,可有效降低再生育聋儿的风险。

