Sirtuins家族在感音神经性聋发病机制中的作用研究
梁文琦 柳柯 龚树生
首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(北京 100050)
沉默信息调节因子2(silencing information regulator 2,Sir2)作为一类烟酰胺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖性去乙酰化酶,最早是在酵母菌中被发现的[1]。迄今为止发现的哺乳动物Sir2同源蛋白质有7个,分别为SIRT1~7,称为Sir2-相关酶类(Sir2-related enzymes,Sirtuins)[2]。Sirtuins家族的特征是高度保守的NAD+结合结构域和催化结构域,并含有催化核心外的N-末端和C-末端延伸,不保守的延伸末端使其能与多种底物结合从而完成不同的生物学功能[3]。人类Sirtuins家族的各个成员的染色体信息、翻译后蛋白信息和功能见表1[4-10]。Sirtuins家族参与染色质重塑、DNA修复、衰老、新陈代谢和氧化应激调节等多种生理过程,而这些生理过程大多参与了感音神经性聋的发生与发展,因此,近年来人们发现Sirtuins家族在多种类型的感音神经性聋的发病机制中扮演着重要的角色。
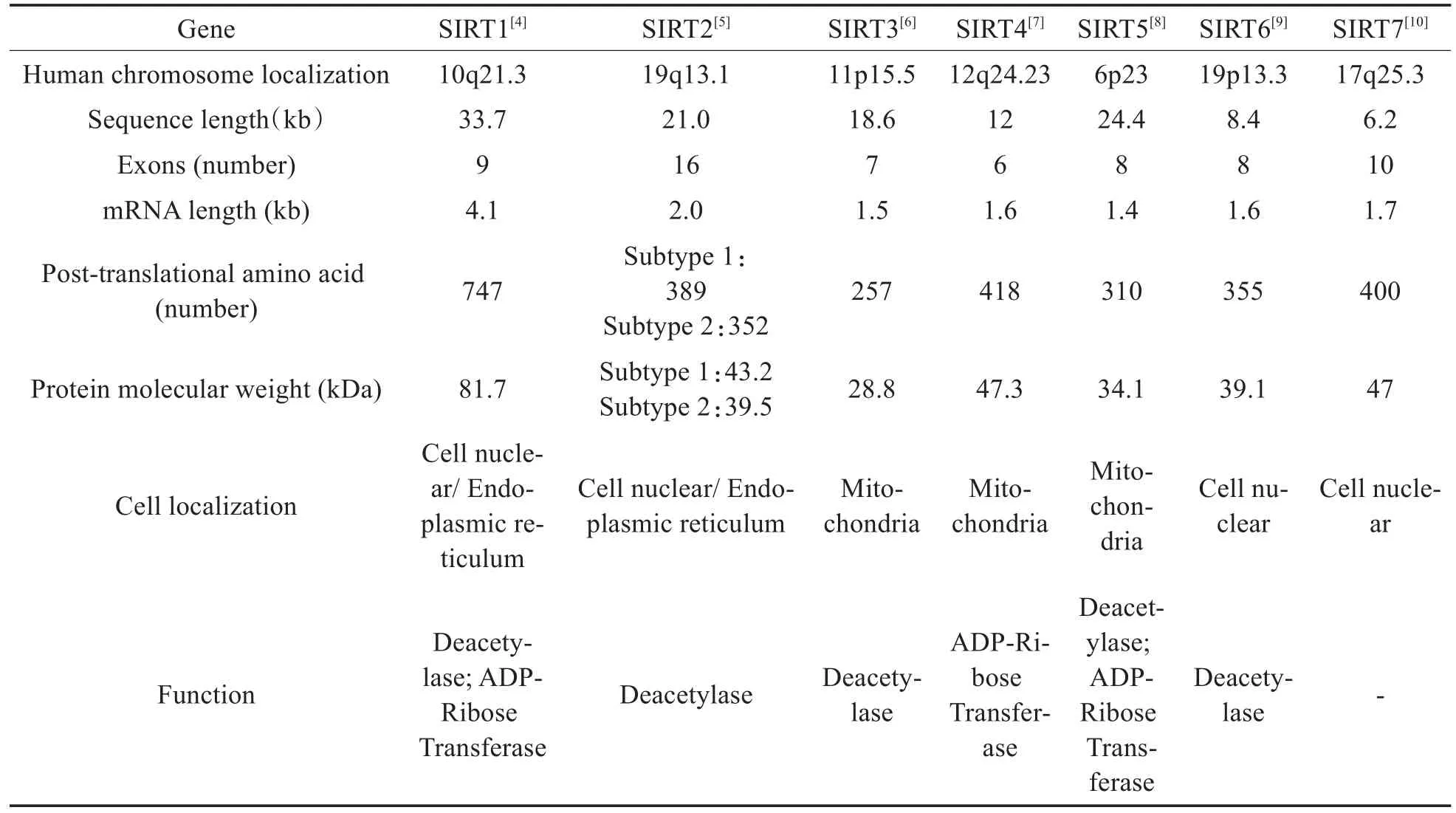
表1 Sirtuins家族各成员的染色体信息、翻译后蛋白信息和功能Table 1 Chromosome information,post-translational protein information and function of Sirtuins family
1 Sirtuins家族在内耳中的表达
在Sirtuins家族中,SIRT1与SIRT2同源性最高,也是研究最多的一员[11]。其基因结构高度保守,蛋白广泛表达于机体的各种组织细胞中[12]。SIRT1在C57BL/6小鼠内耳中大量表达,包括毛细胞、螺旋韧带的纤维细胞、中间细胞、血管纹边缘细胞和螺旋神经节细胞[13]。SIRT1蛋白表达定位于细胞核和细胞质,通过对底物蛋白赖氨酸残基的去乙酰化作用,调节底物蛋白生物活性,广泛参与基因转录、能量代谢和细胞衰老等多个过程[14]。人类SIRT2主要在大脑中表达。有报道认为SIRT2的功能与SIRT1相互拮抗,SIRT2在神经退行性疾病中起到的是破坏的作用[15]。SIRT3、SIRT4和SIRT5定位于线粒体,但SIRT3被认为是主要的线粒体去乙酰化酶,因为与SIRT4和SIRT5缺陷小鼠相比,SIRT3缺陷小鼠肝脏和棕色脂肪组织中的线粒体蛋白表现出高度乙酰化[16]。SIRT3基因编码的蛋白定位于细胞线粒体中膜[17]。在内耳中,SIRT3分布于负责将机械振动转换成神经信号的耳蜗毛细胞,将神经信号从耳蜗上皮传递到大脑的螺旋神经节的神经细胞,以及负责供应营养、组成血管的血管内皮细胞[18]。
2 Sirtuins家族与感音神经性聋的发病机制
2.1 Sirtuins家族与内耳细胞凋亡
Sirtuins家族通过多种途径参与了内耳细胞损伤:(1)SIRT1的表达量随着听力丧失和毛细胞丢失而减少,表明SIRT1可能具有保护听觉功能的作用[13];(2)SIRT1可以通过miR-34a/SIRT1/p53信号通路调控老年性耳蜗毛细胞凋亡。当过表达miR-34a时,抑制SIRT1的表达,其对p53蛋白的去乙酰化能力下降,从而导致p53活性上升,最终促进了内耳细胞的凋亡。而反过来,使用白藜芦醇激活SIRT1,能够有效地缓解因miR-34a过表达而引起的毛细胞凋亡[19];(3)miR-34a过表达能抑制SIRT1的表达,从而促进毛细胞凋亡。miR-34a通过负性调节SIRT1/HIF-1α信号通路而发挥有害作用,为糖尿病听力障碍的治疗提供了新的靶点[20];(4)微小RNA-29b (microRNA-29b,miR-29b)过表达能抑制SIRT1和过氧化物酶体增殖物激活受体γ共激活因子 1α(peroxisome proliferator-activated receptor γ coactivator-1,PGC-1α)的表达,导致线粒体功能障碍、毛细胞凋亡增加。抑制miR-29b基因可增加SIRT1和PGC-1α的表达,从而减少毛细胞凋亡[21]。另外,心肌梗死相关转录本(myocardial infraction association transcript,MIAT)可下调miR-29b含量,从而上调SIRT1/PGC-1α的表达。SIRT1/PGC-1α含量降低能通过促进耳蜗毛细胞凋亡从而促进年龄相关性听力损失的发生[22];(5)SIRT1的沉默通过抑制自噬促进了毛细胞凋亡,而SIRT1激活能恢复自噬,减少毛细胞凋亡,从而延缓年龄相关的听力损失[23];(6)SIRT2抑制剂AK-7可减少耳蜗细胞凋亡,减轻噪声所致的听力损失,表明SIRT2对耳蜗细胞凋亡的调控作用参与了噪声性聋的发病机制[24];(7)Someya等[25]发现衰老会导致野生型和SIRT3缺陷小鼠的听力损失。然而,虽然卡路里限制减少了野生型小鼠与年龄相关的神经元和毛细胞的丢失,延缓了听力损失的进展,但这种影响在SIRT3缺陷的动物中完全消失。该研究表明SIRT3是调节年龄相关性听力损失对卡路里限制反应的关键分子。其后他们发现,SIRT3表达量增多能保护细胞免受氧化应激诱导的细胞死亡,并抑制了年龄相关螺旋神经节神经元和毛细胞的凋亡[26]。
2.2 Sirtuins家族与氧化损伤
Sirtuins家族在氧化损伤中也扮演着多种重要的角色。(1)在顺铂处理的耳蜗组织中,p53上调miR-34a表达量,聚(ADP-核糖)聚合酶1(poly(ADP-ribose)polymerase 1,PARP-1)激活引起 NAD+减少,从而导致SIRT1的蛋白水平和活性水平均下降,加剧了顺铂的耳毒性[27];(2)miR-34a过表达能抑制SIRT1的表达,增加了高糖诱导的缺氧诱导因子-1α(hypoxia-inducible factor-1alpha,HIF-1α)的表达,通过氧化损伤促进糖尿病听力障碍的发生发展[20];(3)在小鼠噪声性聋模型中,SIRT2在耳蜗中的表达量增多。并且用一种SIRT2抑制剂AK-7抑制SIRT2的表达,可减少DNA氧化损伤,从而减轻噪声所致的听力损失[24];(4)SIRT3 表达减少使SOD2乙酰化增加、活性下降,引起氧化产物累积,从而导致听皮层氧化损伤[28];(5)热量限制促进了SIRT3的表达,导致线粒体异柠檬酸脱氢酶2(iso‐citrate dehydrogenase 2,IDH2)去乙酰化并激活,导致线粒体中NADPH水平的升高和还原型谷胱甘肽与氧化型谷胱甘肽比率的增加,从而提高了年龄相关螺旋神经节神经元和毛细胞对氧化应激的抵抗力[26];(6)SIRT3过表达减少了噪声暴露引起的轴突变性,从而使小鼠对噪声性聋具有抵抗力,而SIRT3的缺失降低了烟酰胺核苷的保护作用和NAD+生物合成酶的表达[29];(7)丙烯醛显著降低SIRT3的表达,诱导耳蜗核神经元线粒体功能障碍和氧化应激,而慢病毒转染过表达SIRT3可部分阻止丙烯醛诱导的耳蜗核神经元损伤。这些结果表明SIRT3在丙烯醛耳毒性中起保护作用[30]。
2.3 Sirtuins家族与内耳自噬
目前关于Sirtuins家族通过自噬途径参与感音神经性聋发病机制的研究较少。有研究发现,在早期阶段,顺铂能够通过诱导HEI-OC1细胞中SIRT1的增加从而调节自噬,提示SIRT1通过自噬激活参与了顺铂所致感音神经性聋的发病机制[31]。SIRT1通过去乙酰化核心自噬蛋白ATG9A参与了年龄相关的听力损失的发病机制。ATG9A不仅参与自噬体膜的形成,而且是内质网应激诱导自噬的感受器[23]。
2.4 Sirtuins家族其他成员与感音神经性聋
目前关于SIRT4、SIRT5和SIRT6和感音神经性聋之间的因果联系仍不确定。SIRT4和SIRT5在线粒体中有着特异的底物,关于它们在感音神经性聋中的作用机制还需要进一步的研究。SIRT7的主要生物学活性尚不清楚。据报道,SIRT7是选择性组氨酸H3K18脱乙酰酶[32]和RNA聚合酶I转录激活剂[33]。SIRT7介导的GABPβ1的脱乙酰化促进了GABPα与GABPα的复合物形成和GABPβ/GABPβ异四聚体的转录激活,从而影响了线粒体动态平衡,故SIRT7基因敲除小鼠出现多系统线粒体功能障碍,其中包括年龄相关性听力损失[34]。
3 Sirtuins家族的激动剂和抑制剂
目前,在感音神经性聋领域中,对Sirtuins家族中SIRT1和SIRT3的激动剂和抑制剂研究较多。SIRT1的功能激动剂主要包括白藜芦醇、SRT1720、银杏叶提取物EGb761和云芝等。(1)SIRT1的天然激动剂白藜芦醇,能改变12月龄C57BL/6小鼠的自噬损害,延迟年龄相关的听力损失[23];(2)特异性SIRT1激活剂SRT1720能有效地减少顺铂诱导的HEI-OC1细胞听觉细胞系、斑马鱼侧线和C57BL/6小鼠耳蜗毛细胞丢失,提示SIRT1可作为治疗顺铂所致感音神经性聋的潜在治疗策略[31];(3)银杏叶提取物EGb761对3-硝基丙酸所致急性耳毒性动物模型有明显的听力保护作用,其机制可能是3-硝基丙酸降低了SIRT1的表达,而EGb761能维持SIRT1在耳蜗中的表达,从而保护螺旋韧带和螺旋神经节细胞内的纤维细胞[35];(4)梅尼埃病患者的SIRT1水平以及血浆中还原谷胱甘肽与氧化型谷胱甘肽的比值显著升高,梅尼埃病患者处于全身氧化应激状态,而在梅尼埃病加云芝治疗组中,SIRT1含量和血浆中还原谷胱甘肽与氧化型谷胱甘肽的比值均下降,表明云芝能通过SIRT1诱导对细胞内促氧化状态的反应[36]。
SIRT3活性在NAD+含量升高或NADH含量降低时被激活,反之当NAD+含量降低或NADH含量升高时被抑制[37]。NAD+耗尽时产生的大量活性氧(ROS),从 而 介 导 了 线 粒 体 SIRT3 含 量 升 高[38]。Adjudin是SIRT3的激活剂,它可以上调SIRT3,抑制ROS产生和细胞凋亡[39]。目前在实验过程中激活SIRT3蛋白的方法有热量限制[40],白藜芦醇对SIRT3也有一定的激活作用[41]。研究人员也会通过直接过表达SIRT3的方法对其作用进行研究。另外,SIRT1在多种转录激活和翻译后修饰活动中参与调控SIRT3信号通路[42]。
4 结论
Sirtuins家族作为具有多种生物学功能的重要因子,在能量代谢、生长发育、修复损伤及凋亡等多种生理活动中发挥着重要的调控作用,但关于Sirtuins家族和感音神经性聋的研究数量并不多。目前研究中涉及到的Sirtuins家族成员有SIRT1、SIRT2和SIRT3。在图1中,我们阐明了这三位成员在感音神经性聋发病机制中的重要作用。但是,现有的研究对Sirtuins家族生物学功能的理解并不全面,需要进一步对其上下游分子进行探讨。总之,Sirtuins家族是感音神经性聋发生发展机制研究中一个非常具有前景和科学价值的着眼点和切入点。

图1 SIRT1、SIRT2和SIRT3通过多种上下游分子,调节毛细胞凋亡和听皮层损伤。Fig.1 SIRT1,SIRT2 and SIRT3 regulate hair cell apoptosis and auditory cortex damage through a variety of upstream and downstream molecules.

