转录因子和启动子互作分析技术及其在植物应答逆境胁迫中的研究进展
王 雪,王盛昊,于 冰
(1黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150500;2黑龙江大学生命科学学院,黑龙江省普通高校分子生物学重点实验室,哈尔滨 150080)
0 引言
自然界中,植物通常会遭受各种逆境胁迫,对其生长及发育造成非常不利的影响,甚至会引起植物死亡。植物的逆境胁迫主要包括生物胁迫和非生物胁迫两大类,前者主要是由细菌、真菌、病毒、线虫等引起的病虫灾害,后者则主要包括干旱、高盐、低温、重金属和机械损伤等[1]。在长期进化过程中,植物形成了一系列防御机制,如ROS清除系统、SOS途径等;不同途径中各基因有着不同的调控能力,而基因转录水平调控在植物应答逆境胁迫的防御途径中起重要调节作用[2-3]。转录因子(Transcription factor,TF)通过与各种生物及非生物胁迫应答基因启动子区的顺式作用元件相互作用,调控下游逆境胁迫应答靶基因的表达参与防御反应,促使植物在分子、生理生化等水平做出调节以适应各种逆境[4]。因此开展转录因子调控靶基因启动子应答逆境胁迫的研究对揭示植物应答逆境胁迫分子机制十分必要。
近年来,转录因子与启动子相互作用的研究技术在植物逆境基因表达调控方面的应用研究备受关注。通过酵母单杂交技术(Yeast one-hybrid system,Y1H)和ChIP(Chromatin immunoprecipitation,ChIP)鉴定到怪柳中ThHSFA1启动子通过直接调节ThWRKY4来调节活性氧清除,从而赋予植物盐胁迫耐受性[5]。通过凝胶阻滞分析(Electrophoretic Mobility Shift Assay,EMSA)鉴定到苹果中MdMYB108L通过与MdCBF3启动子结合从而增强苹果的耐冷性[6]。随着对转录因子与启动子相互作用研究愈加深入,其分析技术也不断地改良,但对于各分析技术的针对性以及分析技术结合使用的互补性还没有具体论述。本文介绍了4种转录因子和启动子互作分析技术,包括染色质免疫共沉淀技术、DNase I足迹法(DNase I footprinting)、凝胶阻滞分析和酵母单杂交技术,重点介绍了转录因子和启动子互作分析技术在植物应答逆境胁迫中的研究进展、各分析技术优缺点、偏好性以及联合使用的互补性等特点,为全面、深入开展植物逆境胁迫条件下转录因子对靶基因的转录水平调控分子机理研究奠定坚实的理论基础。
1 参与逆境胁迫的主要转录因子家族
近年来,转录因子在植物的生长发育、植物体内次生物质的代谢以及逆境胁迫调控等多种生理过程中扮演的角色不断被揭开[7],转录因子的研究成为植物应答逆境胁迫分子机制中的一个研究热点。NAC、WRKY、bHLH(basic helix-loop-helix protein)、AP2/ERF以及MYB等转录因子作为植物中普遍存在的转录因子家族,在植物生长发育及逆境胁迫调控过程中发挥着重要作用。
NAC转录因子是植物中最大的特异性转录因子家族之一,其名字是根据矮牵牛(Petunia hybrid)中NAM基因、拟南芥(Arabidopsis thaliana)中ATAF1/2和CUC基因的首字母命名[8-9]。NAC转录因子在植物的生长发育过程中发挥重要作用,如参与分生组织的细胞分裂、侧根生长、开花、衰老等过程;在植物响应低温、干旱及盐碱等非生物胁迫的过程中也起着重要的调节作用[8,10-11]。
WRKY转录因子家族具有十分显著的结构特点,各成员均含有1~2个由60个高度保守的氨基酸残基组成的结构域[12],WRKY转录因子家族名称也是由此得来。WRKY转录因子家族广泛地参与植物的生物、非生物胁迫应答反应,在植物激素信号传导途径中起调控作用,在糖类合成、种子休眠、植物衰老等一系列生理活动中也参与调控[13-14]。
bHLH转录因子家族是真核生物中存在最广泛的一大类转录因子,因含有bHLH结构域而得名[15-16]。bHLH转录因子在植物中的信号传导、非生物胁迫应答、种子萌发、细胞分化等过程发挥重要作用[17-19]。
AP2/ERF转录因子家族是植物中普遍存在的一类转录因子超家族[20];作为一类广泛参与植物生命活动过程的转录因子,AP2/ERF转录因子不仅与种子萌发有关,还参与了植物的初生代谢以及次生代谢;AP2/ERF转录因子作为连接植物激素信号的关键调节器,可以反馈调节激素的生物合成,如乙烯、细胞分裂素、赤霉素和脱落酸,同时也能响应生长素、茉莉酸甲酯等激素信号;一些AP2/ERF基因异源表达可以提高植物体应对胁迫的能力,包括抵抗高盐、干旱、缺氧及低温胁迫等[21-24]。
MYB转录因子家族是存在于所有真核生物中的一类十分保守的转录因子家族,由位于N端的MYB结构域得名[25-26]。植物中MYB转录因子几乎参与了多个发育过程,如根毛发育、花粉形成、种子萌发等方面;在植物遭受冷胁迫、糖胁迫、金属胁迫等非生物胁迫时,MYB转录因子参与其中并进行调节;MYB转录因子在泛素化、糖基化、磷酸化等蛋白翻译后修饰调控方面,也起着至关重要的作用[26-28]。
2 转录因子的转录激活活性鉴定
转录因子一般都具有DNA结合域(DNA-binding domain,BD)和转录调控域(activation domain,AD)两个区域,前者靠近羧基端(C端),决定和DNA顺式作用元件结合的特异性;后者可与RNA聚合酶Ⅱ相互作用,提高RNA聚合酶Ⅱ的活性;BD和AD可以完全独立的发挥作用[29]。转录因子的转录激活活性一般通过酵母系统进行鉴定,单独的BD可以与GAL4的上游激活序列(upstream activating sequence,UAS)结合;将转录因子构建到含有BD的载体上,若该转录因子具有转录激活活性,其表达产生的BD就会与UAS相结合,引起下游报告基因的转录。通常要构建转录激活表达载体并转入酵母中,在营养缺陷型培养基上观察菌落的生长情况,并在X-α-gal染色下观察菌落是否变蓝确定转录因子是否具有转录激活活性。Liang等[30]将青杄(Picea wilsonii Mast.)PwNAC30转录因子分为全长、C端和N端进行转录激活活性检测,结果显示只有PwNAC30转录因子C端能够在三缺培养基(SD/-Trp-His-Ade)上生长,并且在 X-α-gal染色下变蓝,表明PwNAC30转录因子的C端具有转录激活活性,而PwNAC30转录因子的全长和N端没有转录激活活性。
在植物应答逆境中,具有转录激活活性的转录因子,不仅能与靶基因启动子结合,还能通过调节组蛋白修饰水平变化,调节靶基因转录。在毛果杨(Populus trichocarpa)干旱胁迫条件下,PtrAREB1-2转录因子、PtrGCN5-1、PtrADA2b-3两两互作的关系使得三者间可以形成蛋白三聚体,共同实现对下游含有ABRE元件的干旱胁迫响应基因的转录调控。这种蛋白三聚体的形成使PtrAREB1-2转录因子将组蛋白乙酰化酶复合体招募到下游干旱胁迫响应基因的ABRE元件上,从而增加组蛋白H3的第9位赖氨酸K上的乙酰化水平。这种乙酰化的修饰使染色质处于一个更加开放松散的状态,允许更多的RNA聚合酶II进入,从而促进基因的转录[31]。
3 转录因子和启动子互作分析技术
转录因子和启动子互作分析技术本质上是研究蛋白质与DNA相互作用的技术。主要包括染色质免疫共沉 淀 技术 (Chromatin immunoprecipitation,ChIP)、DNase I足迹法(DNase I footprinting)、凝胶阻滞分析(Electrophoretic Mobility Shift Assay,EMSA)和酵母单杂交技术。这几种方法都有自己独特的优势和不足,每种技术研究的侧重点也不同,在实际实验中应选择更为合适的分析技术才能有效的进行转录因子和启动子相互作用研究。
3.1 染色质免疫共沉淀技术(Chromatin immunoprecipitation,ChIP)
ChIP技术由Orlando等[32]于1997年开始应用,是利用甲醛使活细胞内的染色体和蛋白质通过希弗(Scihff)键交联在一起,通过超声波将细胞进行破碎,然后利用目的蛋白的特异性抗体将交联后的复合物进行富集,最后将在低PH的条件下得到单一的DNA片段[33],如图1所示。ChIP技术除了可以在体内研究转录因子和启动子的相互作用,真实地反映两者结合的状况[34-35]。

图1 ChIP技术原理图
ChIP-seq技术是在ChIP技术的基础上,与第二代测序技术相结合发展起来的技术,能够高效地在全基因组范围内检测与转录因子互作的DNA区段[37]。一个ChIP-seq可以输出上千个峰值,每一个峰值的位置都反应转录因子同DNA片段所结合的位置。ChIP-seq技术能够实现对全基因序列的分析,所需要的样品量小,其数据分析后得到的DNA序列能够精确到10~30 bp,具有较高的敏感性[38]。但目前ChIP-seq技术还不能同时获得多个转录因子对同一启动子结合位点的信息。
ChIP-qPCR技术是利用实时定量PCR检测ChIP样品的常用手段。ChIP-qPCR技术实现了在候选靶基因启动子上找到与转录因子结合的直接证据,是细胞内真实、原位的结果[39-40]。
ChIP技术是在体内研究转录因子和启动子相互作用的技术,通常在已知特定转录因子蛋白的情况下,鉴定与已知转录因子互作的靶基因启动子。能在基因组水平上大规模检测已知转录因子和靶基因启动子的动态结合,与体外实验相比更具有说服力,但不能准确地的定位到转录因子和启动子的结合位点。
3.2 DNase I足迹法(DNase I footprinting)
DNase I足迹法于1978年应用于科研领域[41],通过使用DNase I切割单链末端有放射性标记的待测双链DNA,在进行电泳时,DNA与蛋白结合位点受到蛋白的保护,不发生断裂,形成空白区域,即代表目标蛋白与DNA结合的区域[42-43]。DNase I足迹法可以精确地判断蛋白质与DNA片段的结合位点,精确到单碱基水平。但在实验过程中涉及到的操作方法较为复杂,因此在其基础上发展了固相DNase I足迹法。固相DNase I足迹法省略了原有方法中蛋白纯化等步骤,并采用生物素进行标记,避免放射性元素的使用,减少危害[44]。目前还出现了自由羟基足迹实验、菲咯啉铜足迹实验及硫酸二甲酯(DMS)足迹实验等改良版实验,其中DMS足迹实验切割鸟嘌呤(G)残基,可以鉴定到转录因子与DNA结合的特异碱基[45]。
DNase I足迹法是在体外研究转录因子和启动子相互作用的技术,用于进行启动子和转录因子一对一互作验证。DNase I足迹法与ChIP相比可以更为精确的鉴定转录因子与启动子序列的结合位点,能够精确到单碱基水平。
3.3 凝胶阻滞分析(Electrophoretic Mobility Shift Assay,EMSA)
EMSA又称电泳迁移率变动分析,是根据不同分子量的物质在聚丙烯酰胺凝胶电泳中的迁移速率不同而来的。根据基因启动子中的特定顺式作用元件设计探针与转录因子蛋白结合,由于分子量以及电荷发生变化,会比转录因子蛋白单独在凝胶中迁移的速率慢上许多,于是便形成滞后的条带,从而判断蛋白质与启动子特异元件的相互作用关系[46-47]。还可以通过滞后带的有无和量的多少,来反映蛋白质与DNA的结合活性,并可以计算出两者的结合常数或解离常数[48]。传统EMSA实验中探针常用同位素进行标记,对实验环境的要求较高,存在放射性污染。随着实验技术的发展,探针标记也寻找到较为安全的替代物,如地高辛和生物素标记[49]。同时在EMSA的基础上又进行优化,发展出特异性更高的超迁移率变动分析以及分辨率更高的毛细管凝胶阻滞电泳。
EMSA法是在体外研究转录因子和启动子相互作用的技术。一种情况用于启动子和转录因子一对一互作验证,另一种情况用于研究某基因转录起始点上游一定范围内是否存在与潜在的转录因子相结合的顺式作用元件。将研究目的基因启动子中的20~30 bp大小的顺式作用元件设计为探针,将提取的细胞核蛋白与标记的启动子探针之间进行EMSA实验,确定是否有特定的转录因子与启动子中顺式作用元件相结合。在探究转录因子与启动子相互作用的实验中EMSA常常与DNase I足迹法在体外结合使用,前者可以鉴定与启动子特异结合的转录因子,后者可以进一步确认转录因子与启动子的结合位置,并得到相应的顺式作用元件序列。
3.4 酵母单杂交技术(Yeast one-hybrid system,Y1H)
Y1H由Li J J和Herskowitz I从酵母双杂交技术(Yeast two-hybrid system,Y2H)发展而来[50],是在酵母体内研究转录因子和启动子之间相互作用的技术。Y1H是将已知的特定顺式作用元件构建到最基本启动子(minimal promoter,Pmin)上游,并在下游连接报告基因。进行cDNA融合表达文库筛选时,编码目的转录因子的cDNA融合表达载体被转化进入酵母细胞后,其编码产物(转录因子)与顺式作用元件结合,就可以提高RNA聚合酶Ⅱ的活性,促使报告基因表达[51],由此筛选出与已知顺式作用元件结合的转录因子,如图2所示。Y1H操作简单快捷,在酵母中表达的与启动子结合的真核生物蛋白可正确折叠和翻译后修饰,具有天然的构象,反映真实的体内表达调控情况[53]。在实际操作中常出现假阴性和假阳性现象,因此假阳性较低的酵母单-双杂交体系也由此衍生而来,该体系将酵母单杂交和双杂交两种体系的原理融合,又同时应用DNA-蛋白质以及蛋白质-蛋白质之间的两种相互作用筛选cDNA文库[54],降低试验中的假阳性,提高试验结果的准确性,但必须已知DNA序列以及相互作用的转录因子。
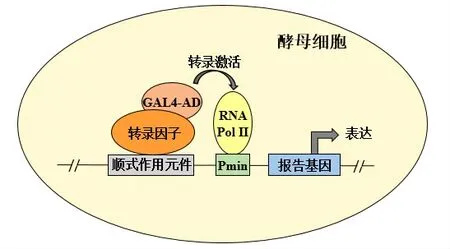
图2 Y1H技术原理图
Y1H技术是在体内研究转录因子和启动子相互作用的技术。在已知某基因启动子片段的情况下鉴定与之结合的转录因子。用于在酵母体内进行转录因子和启动子互作验证,可以真实的体现二者间的表达情况,既能进行转录因子和启动子互作的一对一鉴定,也可以利用cDNA文库筛选与启动子互作的转录因子,实现高通量筛选。
4 转录因子和启动子互作分析技术在植物逆境胁迫中的应用
4.1 ChIP技术在植物逆境胁迫中的应用
ChIP技术在植物逆境胁迫中的应用情况见表1。ChIP可以验证已知转录因子与启动子间的相互作用,Qiu等[55]使用ChIP研究了辣椒(Capsicum annuum L.)感染青枯雷尔氏菌(Ralstonia solanacearum)后的2个上调基因,发现候选转录因子CaWRKY40通过与CaC3H14基因启动子的相互作用,调节SA(水杨酸)和JA/ET(茉莉酸/乙烯)信号转导之间拮抗作用,增强了辣椒对青枯雷尔氏菌的防御反应。ChIP与测序技术相结合可以对全基因组进行分析,Li等[56]通过ChIPSeq分析干旱条件下过表达编码转录因子OsSNAC1基因的水稻(Oryza sativaL.)中所有启动子定位的峰序列,推测转录因子OsSNAC1结合靶基因启动子的NACRS和ABRE元件序列在植物中具有保守性。将ChIP-qPCR和其他分析技术相结合可以高效准确的定位到转录因子与启动子DNA的结合位点,Zhao等[57]通过ChIP-qPCR结合EMSA和Y1H发现转录因子MdWRKY15通过直接与异氰酸酯合酶基因MdICS1启动子的W-box结合以激活其转录,促进了SA的积累,从而激活了SA诱导的病原体相关基因,增强了对葡萄座腔菌(Botryosphaeria dothidea)的抗性。Yang等[58]使用ChIP-qPCR及Y1H分析表明,在高温条件下核桃(Juglans regiaL.)中JrDof3与JrGRAS2基因具有相似的表达模式,转录因子JrGRAS2特异性结合DOFCOREZM基序,从而调节靶基因JrDof3在高温下的表达。

表1 CHIP在植物逆境胁迫中的应用
4.2 DNase I足迹法在植物逆境胁迫中的应用
DNase I足迹法可以在单碱基水平上定位到启动子与转录因子结合位点,为了研究小麦(Triticum aestivumL.)致病性真菌颖枯壳针孢(Parastagonospora nodorum)的效应基因调控机制,Shao等[59]通过DNase I足迹实验精准定位了小麦真菌颖枯壳针孢效应基因Tox3转录所必需的启动子中的25 bp区域,为揭示小麦致病机制奠定基础。Grec等[60]研究发现烟草(Nicotiana tabacumL.)中的NpABC1基因受到烟草叶片表面的抗真菌二萜类物质香紫苏醇的诱导表达,通过DNase I足迹法和EMSA结合分析,鉴定出NpABC1基因启动子的3个顺式作用元件(SB1、SB2和SB3)在该基因响应香紫苏醇中发挥主要调节作用。
4.3 EMSA在植物逆境胁迫中的应用
EMSA一般用于启动子和转录因子的一对一互作验证中,Wang等[61]通过EMSA一对一验证苹果转录因子MdMYB108L与MdCBF3基因启动子,发现二者的相互作用可从提高苹果(Malus domestica(Suckow)Borkh.)耐寒性。Zhang等[62]应用EMSA一对一验证了小麦转录因子TaWRKY40与干旱响应基因TaGAPC1启动子的相互作用,表明二者通过ABA信号转导途径正调控TaGAPC1基因的表达水平,从而提高植物在干旱下的胁迫耐受性。EMSA还与其他技术结合使用定位启动子上与转录因子相结合的顺式作用元件,常用于细胞核蛋白的验证中,Zheng等[63]通过EMSA和DNase I足迹法联用,表明酰基辅酶结合蛋白编码基因ACBP3的启动子与光处理的拟南芥(Arabidopsis thaliana(L.)Heynh.)的叶核蛋白相互作用并结合于该基因启动子的GT-1顺式作用元件,而暗处理时叶核蛋白除了与ACBP3基因启动子的GT-1顺式作用元件结合外,还与Dof-box顺式作用元件结合,这表明了Dofbox和GT-1顺式作用在介导ACBP3基因参与拟南芥昼夜节律调节具有重要作用。由葡萄座腔菌引起的苹果腐烂病是损害苹果的重要疾病,Zhao等[64-65]通过EMSA及Y1H分析发现,苹果在受到葡萄座腔菌侵染后,转录因子MdWRKY31与MdHIR4基因启动子中的W-box2基序结合,转录因子MdWRKY15与MdICS1启动子相互作用,从而调节了苹果的SA信号传导途径,增强了果树对葡萄座腔菌的抗性。Zhang等[66]使用EMSA及Y1H在小麦中鉴定到转录因子TaMYB与TaGAPCp2P/3P基因启动子的干旱响应元件5'-AACTAAA/C-3'结合,可提高小麦的耐旱性。
4.4 Y1H在植物逆境胁迫中的应用
Y1H技术在植物逆境胁迫中的应用情况见表2。Hu等[67]为了探究miRNA在棉花(Gossypium hirsutumL.)黄萎病中发挥的功能,通过Y1H一对一验证了棉花转录因子GhNAC100与GhPR3基因启动子的相互作用,发现GhNAC100与GhPR3基因启动子的CGTA-box结合并抑制其表达,从而负调控棉花的防御作用。

表2 Y1H在植物逆境胁迫中的应用
Dong 等[68]对大豆(Glycine max(L.)Merr.)转录因子GmWRKY31与GmSAGT1基因启动子进行了Y1H一对一验证,发现二者通过W-box结合,从而调节GmSAGT1基因的表达参与SA介导的大豆免疫反应。Yong等[69]通过Y1H一对一验证表明虎百合(Lilium lancifoliumL.)转录因子LlMYB3能够结合LlCHS2基因的启动子,通过参与花青素的生物合成途径,以调节虎百合在冷胁迫中的耐受性。Almeida等[70]通过Y1H技术在水稻cDNA文库中以OsNHX1基因启动子为诱饵大规模筛选,鉴定到5个转录因子(3个家族)——转录因子OsPCF2(TCP家族),OsCPP5(CPP家族)和OsNIN-like2、OsNIN-like3、OsNIN-like4(NIN-like家族),这些转录因子可能调节水稻耐盐和耐旱功能。
4 展望
本文介绍的转录因子和启动子互作技术是目前较有代表性研究方法,在进行转录因子与启动子相互作用研究之前,首先通过转录因子转录激活实验对转录因子的活性进行验证,再进一步对转录因子的功能及下游调控基因进行研究。但目前的几种转录因子和启动子互作技术还具有局限性:(1)ChIP技术在研究转录因子和启动子的相互作用时,只能通过已知转录因子的特异性抗体鉴定与转录因子结合的靶基因启动子,不能从已知的启动子获得与之结合的转录因子蛋白;而且转录因子可能间接地与染色质结合。(2)EMSA不能反映转录因子和启动子在体内结合的真实状况;对于低亲和力结合的转录因子和DNA也很难识别。(3)DNase I活性所需的Mg2+和Ca2+会破坏转录因子和启动子特异性的相互作用;DNase I足迹法的不足之处是只能进行蛋白质和DNA点对点的相互结合研究,在进行大规模转录因子和启动子互作研究中受到限制。(4)Y1H中某些与DNA相互作用的转录因子可能对酵母本身有毒性;不能研究与内源性酵母激活蛋白相互作用的DNA结合位点,因此在实验过程中假阳性比较高。每种技术都具有相应的优点和局限性,具体研究时应采用不同的实验方法组合进行交叉验证,提高结果的准确性。随着分子生物学方法的快速发展以及物理学、化学和生物信息学等学科的交叉合作,转录因子和启动子互作技术的研究手段将不断发展和完善,使植物应答逆境胁迫下的基因表达调控机制研究更深入。

