小麦中带有核定位信号NAC 转录因子的鉴定及分析
耿怀民,张艳俊,2,李聚贤,崔钟池,王 菲,王海燕,刘大群
(1.河北农业大学 植物保护学院/河北省农作物病虫害生物防治技术创新中心,河北 保定 071000;2.邢台职业技术学院 资源与环境工程系,河北 邢台 054000)
关 键 字:小麦;NAC 转录因子;核定位信号;生物信息学分析;叶锈菌
1997 年,Aida 等人首先报道了NAC 结构域,并取编码蛋白N 端的保守序列首字母命名为 NAC(矮牵牛花NAM、拟南芥ATAF1/2、CUC2)[1]。1 个典型的NAC 转录因子携带2 个结构域,1 个保守的N 端结构域和1 个高度多样化的C 端结构域。C 端结构域具有反式激活特性[2],C 端结构域的多样性使NAC 转录因子具有多种生物功能[3];N 端结构域具有DNA 结合特性,保守结构域大约有150个氨基酸[4],分为A-E 5 个亚区[5],A 参与二聚体的形成,B 和E 与功能多样性相关,C 和D 与DNA 结合[6]。
NAC 作为植物特有的一类转录因子,在植物的生长发育、激素调节、抗逆胁迫等方面发挥着重要作用[7]。在单子叶植物中,水稻OsNAP可以促进叶片的衰老[8];高粱SbSNAC1可增强转基因玉米的抗旱性[9];玉米ZmNAC126在拟南芥和玉米中过表达,可以加速叶片衰老[10]。在双子叶植物中,甘薯IbNAC72通过在烟草中的过表达,使根系更为发达,增强抗旱能力[11];苹果Md NAC29受干旱、盐、赤霉素、生长素、脱落酸等胁迫诱导,并在植物抗旱和耐盐中起负调控作用[12];黄瓜CsATAF1使过表达植株的根伸长,在拟南芥中,过表达该基因提高了植株存活率,在黄瓜中干扰CsATAF1基因的表达,使抗氧酶活性降低,从而导致抗旱能力降低[13]。
小麦作为我国重要的粮食产物,开展作物抗逆抗病机理的研究对抗病育种及保证小麦产量有重大意义。本研究前期在小麦中鉴定了1 个NAC 类转录因子,TaNAC069,并明确其参与了小麦抗叶锈病防御反应[14]。研究表明,转录因子多在细胞核内发挥功能,条锈菌效应因子PstGSRE1通过破坏TaLOL2的核定位抑制ROS 介导的细胞死亡,从而使小麦更感病[15];拟南芥SPL9基因的核定位信号突变破坏了拟南芥在营养期变化中的正常功能[16];拟南芥RPW8.2在细胞质中的积累可以引起细胞坏死,加强核定位信号,增强了抗白粉能力[17]。本研究拟通过分析小麦基因组中NAC 序列,筛选带有核定位信号的NAC 转录因子,对其进行生物信息学分析,以期获得与抗病相关的候选NAC 转录因子,为NAC 转录因子在小麦与病原物互作的研究提供基础。
1 材料与方法
1.1 小麦核定位NAC 转录因子的鉴定及理化性质分析
通过在线软件HMMER(https://www.ebi.ac.uk/Tools/hmmer/search/hmmscan) 和NCBI(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)对小麦基因组中NAC 结构域进行分析,通过NLStradamus 在线工具(http://www.moseslab.csb.utoronto.ca/NLStradamus/opennewwindow)预测核定位信号,利用 ExPASY-ProtParam 在线工具(https:// www.expasy.org)分析理化性质。
1.2 小麦核定位NAC 转录因子的特征分析
利用MEGA7.0 软件对带有核定位信号的NAC氨基酸序列进行多序列比对,用邻近法构建进化树。
利用蛋白质保守基序在线搜索程序MEME(http://meme-suite.org)分析候选转录因子的保守结构。
1.3 小麦核定位NAC 转录因子的启动子分析
从小麦基因组中提取NAC 基因转录起始位置上游2 000 bp 序列,查找启动子顺式作用元件。利用在线软件 PlantCARE(http://bioinformatics.psb.ugent. be/webtools/plantcare/html)预测分析其启动子顺式元件组成情况。
1.4 抗病相关的核定位NAC 转录因子的筛选
为明确带有核定位信号NAC 的表达模式,利用在线分析工具(http://www.wheat-expression.com) 分析它们在小麦与赤霉菌(Fusarium graminearum)、条锈菌(Puccinia striiformisf. sp.tritici)互作过程中核定位NAC 的表达量变化。
1.5 叶锈菌诱导后抗病相关的核定位NAC 转录因子的表达分析
采用撒粉接种法接种叶锈菌07-10-426-1(PHNT) 后, 取接菌后 0、12、24、48、72、96、144 和168 h 的叶片,用于实时荧光定量PCR(quantitative real-time PCR, qPCR)试验。
以TaNACL-A1、TaNACL-B1和TaNACL-D1序列为靶标设计引物(表1),检测3 个基因的表达模式。

表1 qPCR 引物序列Table1 Primers used for qPCR
2 结果与分析
2.1 小麦NAC 转录因子的理化性质分析及核定位信号预测
在中国春数据库中,通过Pfam ID(PF02365)查询到460 个NAC 转录因子,通过NLStradamus在线工具分析,筛选有核定位信号的NAC 转录因子,在3A 染色体上发现2 个NAC 转录因子TraesCS3A02G485500、TraesCS3A02G486500, 分别命名为TaNAC3-A1、TaNAC3-A2;在3B 染色体上发现2 个NAC 转录因子TraesCS3B02G534500、TraesCS3B02G533200,分别命名为TaNAC3-B1、TaNAC3-B2;在3D 染色体上发现2 个NAC 转录因子TraesCS3D02G481900、TraesCS3D02G480900,分别命名为TaNAC3-D1、TaNAC3-D2; 在5A、5B、5D 染色体上发现3 个NAC 转录因子,TraesCS5A02G099000、TraesCS5B02G104200、TraesCS5D02G111300 分 别 命 名 为TaNACL-A1(TaNAC-like-A1)、TaNACL-B1(TaNAC-like-B1)、TaNACL-D1(TaNAC-like-D1)。理化性质分析显示,这9 个NAC 转录因子中最长序列有270 个氨基酸残基,最短的有 177 个氨基酸残基,分子量的范围在19.63 ~28.92 kD 之间,等电点的范围在8.40 ~9.87之间,它们的平均疏水性均为负值,都是亲水蛋白(见表2)。

表2 核定位NAC 转录因子蛋白的理化性质分析及核定位信号预测Table 2 Analysis of physicochemicalproperties and prediction of nuclear localization signal of 9 NAC transcription factors proteins
2.2 小麦NAC 家族成员的系统发育分析
在水稻和拟南芥中已将NAC 分为18 个亚族[18],有相似研究报道,大豆[19]和茶树[20]所有NAC 家族成员均可分类到这18 个亚族中,辣椒[21]、马铃薯[22]和番茄[23]部分NAC 成员被分到18 个亚族之外的茄科特有的T-NAC 家族中。为了研究TaNAC蛋白与双子叶植物(拟南芥)和单子叶植物(水稻)模式植物系统的亲缘关系,通过MEGA7 软件将拟南芥和水稻18 个亚族的代表性NAC 转录因子和这9 个带有核定位信号的NAC 转录因子进行聚类分析,根据全长NAC 蛋白序列构建了系统发育树,发现这9 个NAC 转录因子并不属于任何亚族(图A)。根据核定位信号序列进行分类,TaNACL-A1、TaNACL-B1和TaNACL-D1的核定位信号具有较高的相似性(>90%),TaNAC3-A1、TaNAC3-B1、Ta N A C 3-D 1、Ta N A C 3-A2、Ta N A C 3-B2 和TaNAC3-D2的核定位信号具有较高的相似性(>70%)(图B)。

图1 核定位信号NAC 转录因子的聚类分析及核定位信号序列比对Fig. 1 Clustering analysis of nuclear localization signals NAC transcription factors
2.3 小麦NAC 家族成员保守结构域分析
利用在线软件MEME 对 9 个小麦NAC 成员、水稻和拟南芥中18 个NAC 亚族成员序列进行保守基序分析,在同一亚族的成员具有相似的保守基序,且均含有保守基序Motif 3、Motif 5、Motif 8。与水稻和拟南芥中18 个NAC 亚族成员相比,Motif 7、Motif 10、Motif 14 只 存 在 于TaNACL-A1、TaNACL-B1、TaNACL-D1中;Motif 4、Motif 6、Motif 9 只 存 在 于TaNAC3-A1、TaNAC3-B1、TaNAC3-D1、TaNAC3-A2、TaNAC3-B2、TaNAC3-D2中(见图2),各亚家族之间基序分布的差异表明这些基因在进化过程中可能存在功能分歧。

图2 核定位信号NAC 转录因子家族的保守基序分析Fig. 2 Conservative motif analysis of NAC transcription factor family with nuclear localization signal
2.4 小麦NAC 转录因子的启动子分析
顺式作用因子是启动子上调控基因表达所必需的功能元件,分析这9 个小麦NAC 启动子上的作用元件,可初步预测小麦NAC 基因的生物学功能。分析9 个小麦NAC 基因家族上游2 kb 启动子区域,其中参与植物激素相关的顺式作用元件包括:茉莉酸甲酯响应元件(CGTCA-motif、TGACGmotif)、脱落酸响应元件(ABRE)、赤霉素响应元件(GARE-motif、P-box、AuxRR-core)、水杨酸响应元件(TCA-element)、生长素响应元件(AuxRR-core、TGA-element);参与植物生长发育相关的顺式作用元件包括:玉米醇溶蛋白代谢调控的顺式调控元件(O2-site)、胚乳表达的顺式调控元件(GCN4-motif)、种子特异性调控的顺式调控元件(RY-element)、分生组织表达相关的顺式调控元件(CAT-box);参与胁迫相关的顺式作用元件包括:厌氧诱导所必需的顺式调节元件(ARE)、低温响应的顺式作用件(LTR)、脱水、低温、盐胁迫的顺式作用元件(DRE)、防御和应激反应的顺式作用元件(TC-rich repeats)(见图3),表明9 个NAC转录因子在小麦生长发育以及激素和多种胁迫应答中具有一定作用。

图3 核定位信号NAC 转录因子家族的保守基序分析Fig. 3 Conservative motif analysis of NAC transcription factor family with nuclear localization signal
2.5 小麦NAC 转录因子的表达谱分析
为了初步筛选小麦NAC 转录因子的抗病性,基于小麦- 病原物模拟接种的转录组数据库,分析了核定位信号NAC 转录因子在小麦与赤霉菌(Fusarium graminearum) 和条锈菌(Puccinia striiformisf. sp.tritici)互作过程中表达量的变化。数据库利用850 个小麦RNA 测序样本,以及注释的基因组,来确定在一系列组织、发育阶段和品种中同源表达之间的相似性和差异性[24],可以可视化和比较整个实验中的RNA-seq 数据,有助于分析来自多种物种的基因表达数据[25]。分析结果显示,在接种赤霉菌后,TaNACL-B1在36 h 和48 h 表达量均显著上调,约为对照组的10.2 倍和11.0 倍,TaNACL-A1在48 h 表达量达到最大,约为对照组的8.6 倍,TaNACL-D1在48 h 表达量达到最大,约为对照组的6.9 倍(见图4),表明TaNACL-A1、TaNACL-B1和TaNACL-D1受赤霉菌的诱导。
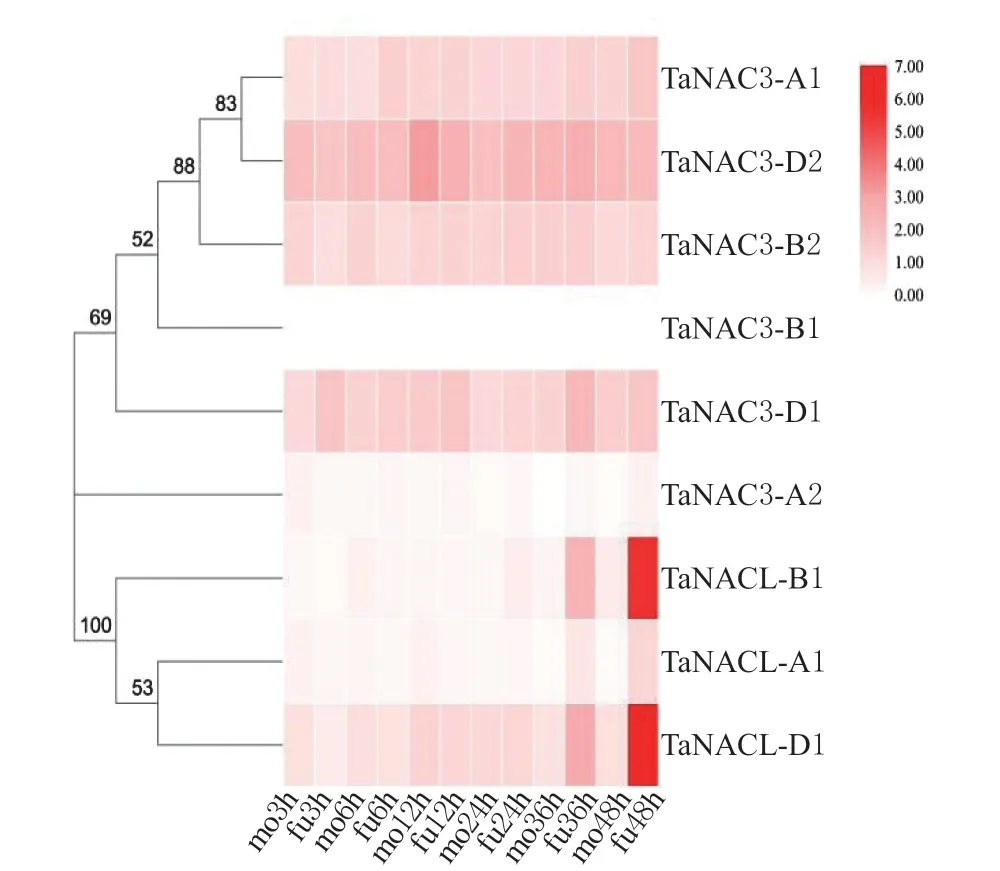
图4 带有核定位信号NAC 转录因子与赤霉菌互作的表达谱分析Fig. 4 Expression profile analysis of NAC transcription factor with nuclear localization signal interacting with Fusarium graminearum
接种条锈菌后TaNAC3-A1在7 d 和11 d 表达量均显著上调,约为对照组的8.1 倍和7.0 倍;TaNAC3-D1在7 d 表达量达到最大,约为对照组的4.9 倍;TaNACL-B1在9 d 表达量达到最大,约为对照组的20.1 倍;TaNACL-D1在11 d 表达量达到最大,约为对照组的15.7 倍(见图5)。表明TaNAC3-A1、TaNACL-B1和TaNACL-D1的表达受条锈菌的诱导。

图5 带有核定位信号NAC 转录因子与条锈菌互作的表达谱分析Fig.5 Expression profile analysis of NAC transcription factor with nuclear localization signal interacting with Puccinia striiformis f. sp. tritici
2.6 叶锈菌诱导后TaNACL-A1、TaNACL-B1 和TaNACL-D1 基因表达分析
在数据库中发现TaNACL-B1、TaNACL-D1受赤霉菌和条锈菌共同诱导,且TaNACL-A1、TaNACL-B1和TaNACL-D1互为同源基因。为明确它们是否受叶锈菌诱导,以小麦抗病品种TcLr19接种小麦叶锈菌PHNT 为非亲和组合,和感病品种Thatcher 接种小麦叶锈菌PHNT 为亲和组合,利用qPCR 检测TaNACL-A1、TaNACL-B1和TaNACL-D1三个基因的表达模式。结果显示,在非亲和组中,168 h 时表达量达到最大,约是对照组(0 h)的9.0倍;在亲和组中,12 ~72 h 呈上升趋势,且亲合组中的表达均高于非亲和组,并在48 h 表达量达到最大,约是对照组(0 h)的9.6 倍。这一结果表明它们可能在小麦和叶锈菌互作过程中发挥负调控作用(见图6)。

图6 TaNACL(TaNACL-A1,TaNACL-B1 和TaNACL-D1)基因在接种叶锈菌PHNT 后的表达分析Fig.6 Expression analysis of TaNACL(TaNACL-A1,TaNACL-B1 and TaNACL-D1) inoculated with PHNT
3 结论与讨论
随着高通量测序技术越来越发达,多种植物的基因组测序已经日益增多,根据数据库里的基因序列,通过多种生物信息学技术来鉴定和分析这些基因,已经成为筛选候选基因的主要途径。目前已有多种转录因子家族通过生物信息学分析被筛选出来,例如马铃薯中的CRK 家族[26],苹果中的NLP 家族[27]和玉米中的TCP 家族[28]。但对小麦中带有核定位信号NAC 家族成员的分析研究较少。本研究从小麦数据库的460 个NAC 转录因子中,鉴定出9 个C末端带有核定位信号的NAC 转录因子,对其理化性质、系统发育、以及保守基序进行了分析。当对这9 个NAC 转录因子与水稻和拟南芥中的18 个NAC亚族成员聚类分析时,发现它们并不属于任何亚族,可能是基因在进化过程中发生了突变,也可能是它们在对小麦适应环境的进化中具有特定的作用,从而导致没有分到任何一个亚族。
NAC 转录因子在生物胁迫的研究较少,本研究通过在线数据库及qPCR 技术最终筛选出3 个带有核定位信号的NAC 转录因子,TaNACL-A1、TaNACL-B1和TaNACL-D1。由于转录因子大多数在细胞核内发挥作用,所以突变和加强转录因子的核定位信号可能会影响它本身的功能以及定位。其中TaNACL-D1存在核定位信号,且只定位在细胞核中,当破坏了核定位信号后,它在细胞核和细胞质中均表达[29]。TaNACL-A1、TaNACL-B1和TaNACL-D1在亲合组和非亲合组中均存在高表达,表明它们受叶锈菌诱导,后续可以通过突变核定位信号后接种病原菌,对比有无核定位信号的基因对小麦叶锈菌的抗性,进一步明确核定位信号是否可以影响基因的抗病性,为进一步研究NAC 转录因子家族成员在生物胁迫中的功能提供参考。

