甲状旁腺激素水平在原发性醛固酮增多症及肾上腺无功能瘤患者鉴别诊断中的应用价值
李亚楠,张赛春,臧 丽,谷伟军,李 冰,陈 康,裴 育,杜 锦,郭清华,巴建明,吕朝晖,窦京涛,母义明
1 解放军总医院第一医学中心 内分泌科,北京 100853;2 青海省人民医院 内分泌二科,青海西宁810001
原发性醛固酮增多症(primary aldosteronism,PA)是肾上腺自主过量分泌醛固酮所引起的以高血压、低血钾和碱血症为特征的临床综合征。近年来多项研究发现血清甲状旁腺激素(parathyroid hormone,PTH)水平升高可能是PA 患者的一个临床特征[1-4]。PTH 是由甲状旁腺细胞分泌的调节钙、磷代谢的一种肽类激素,与醛固酮存在相互作用[4-5]。PTH 依赖钙离子通道和PTH/PTHrP 受体直接作用于肾上腺,促进醛固酮分泌,PTH 也可通过刺激入球小动脉上皮细胞使肾素分泌增多,间接促进醛固酮分泌[3,6-7]。PA 患者低血钾、代谢性碱中毒可促进血清游离钙与白蛋白结合,使血钙下降,导致继发性PTH 分泌增多[7]。醛固酮亦可与甲状旁腺盐皮质激素受体结合直接调控PTH 分泌[7]。目前对不同亚型PA 患者PTH 水平的研究结果存在差异。有研究发现醛固酮瘤(aldosterone-producing adenoma,APA)和特发性醛固酮增多症(idiopathic aldosteronism,IHA) 患者PTH 水平均升高[8]。但也有研究表明PTH 升高是APA 所特有[9]。不同类型PA 患者的治疗方案存在差异,APA 首选手术治疗,IHA 多采用口服药物治疗。肾上腺静脉取血(adrenal venous sampling,AVS)是区分PA 患者单侧病变与双侧病变的金标准。但由于AVS 存在风险高、成本高、操作者需有一定技术熟练度等局限性,不宜广泛推广。故本研究分析PA、APA、IHA 和肾上腺无功能瘤(nonfunctional adrenal tumors,NFAT) 患者血清PTH 水平,为PA 患者的诊断、分型寻找更加简便的方法。
资料与方法
1 资料 收集解放军总医院第一医学中心2016 -2020 年收治的PA 患者414 例(APA 患者263 例,IHA 患者151 例) 和NFAT 患者275 例。纳入标准:1)年龄 ≥ 18 周岁;2)符合PA 的筛查人群[10]:①持续性高血压(>150/100 mmHg)者;使用3 种常规降压药(包括利尿剂) 无法控制血压(>140/90 mmHg)的患者;使用 ≥ 4 种降压药才能控制血压(<140/90 mmHg)的患者及新诊断的高血压患者;②高血压合并自发性或利尿剂所致的低钾血症的患者;③高血压合并肾上腺意外瘤的患者;④早发性高血压家族史或早发(<40 岁)脑血管意外家族史的高血压患者;⑤原醛症患者中存在高血压的一级亲属;⑥高血压合并阻塞性呼吸睡眠暂停的患者。排除标准:1)继发性高血压,如库欣综合征、肾血管性高血压、肾实质性高血压等;2) 4~ 6 周内服用治疗剂量的钙或维生素D;3)严重心、肾功能不全;4)合并原发性甲状旁腺功能亢进及其他可能干扰血浆醛固酮与肾素浓度比值结果的因素,如糖皮质激素、甘草制剂等;5)严重骨质疏松;6)合并有先天性疾病或恶性肿瘤病史;7)妊娠和哺乳期妇女。
2 原发性醛固酮增多症诊断标准及分型 1) PA的诊断:根据2020 年中华医学会内分泌学分会“原发性醛固酮增多症诊断治疗的专家共识”[10],立位血浆醛固酮与肾素浓度比值>3.7,卡托普利试验后2 h 血浆醛固酮>11 ng/dL 和(或)盐水输注试验后血浆醛固酮>10 ng/dL。2) 分型:对所有符合PA 诊断标准的患者进行分型。①APA(满足以下任一条件):AVS 提示单侧病变;体位实验:立位醛固酮不升反降和(或)地塞米松联合ACTH 兴奋实验,醛固酮峰值 ≥ 77.9 ng/dL[11],同时结合肾上腺影像或术后病理提示单侧腺瘤进行综合分析。②IHA(满足以下任一条件):AVS 提示双侧病变;体位实验:立位醛固酮较卧位醛固酮升高>33%[12]和(或)地塞米松联合ACTH 兴奋实验,醛固酮峰值<77.9 ng/dL[11],同时结合肾上腺影像综合分析。
3 方法 所有患者在入院前停用利尿剂4 周以上,停用血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂、钙离子拮抗剂等类药物2 周以上,维持正常钠盐摄入,纠正低血钾,给予α-受体阻滞剂及非二氢吡啶类钙离子拮抗剂药物维持血压稳定。对所有患者进行系统的PA 筛查,包括血电解质(钾、钠、钙、镁、磷)、尿电解质(24 h 尿钾、尿钠、尿钙)、血浆肾素浓度、血浆醛固酮、PTH、25 羟维生素D3、肌酐等。符合纳入标准的患者根据PA 的诊断及分型标准,分为APA、IHA 和NFAT 三组,比较三组患者血清PTH、血电解质、尿电解质、血浆肾素、血浆醛固酮、尿醛固酮水平的差异并探讨影响PTH 的因素。分析PTH鉴别PA 与NFAT以及APA与IHA的最佳切点。
4 统计学方法 采用SPSS 24.0 统计软件进行分析。计量资料均先行正态性检验,符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t法;偏态资料以中位数Md(P25,P75) 描述,多组比较为Kruskal-Wallis 秩检验(Kruskal-Wallis test for independent samples),两两比较为Wilcoxon 秩检验(Wilcoxon’srank sum test)。计数资料以例数或率表示,各组间比较采用χ2检验;相关性分析采用Pearson 相关;诊断预测价值分析为接收者工作特征曲线(receiver operation characteristic,ROC)分析,计算曲线下面积确定最佳切点值及相应的敏感度与特异性。P< 0.05 为差异有统计学意义。
结果
1 三组一般资料比较 三组患者男女比例、血压、PTH、25 羟维生素D3、血钾、血钠、血钙、血磷、血镁、尿钾、尿钠、尿钙、卧位肾素、卧位醛固酮、立位肾素、立位醛固酮、尿醛固酮均存在统计学差异(P< 0.05),肌酐无统计学差异(P> 0.05)。APA 组血钾、尿钠、尿钙、血浆肾素低于IHA 组,APA 组PTH、血浆醛固酮、尿醛固酮高于IHA 组(P< 0.05)(表1)。
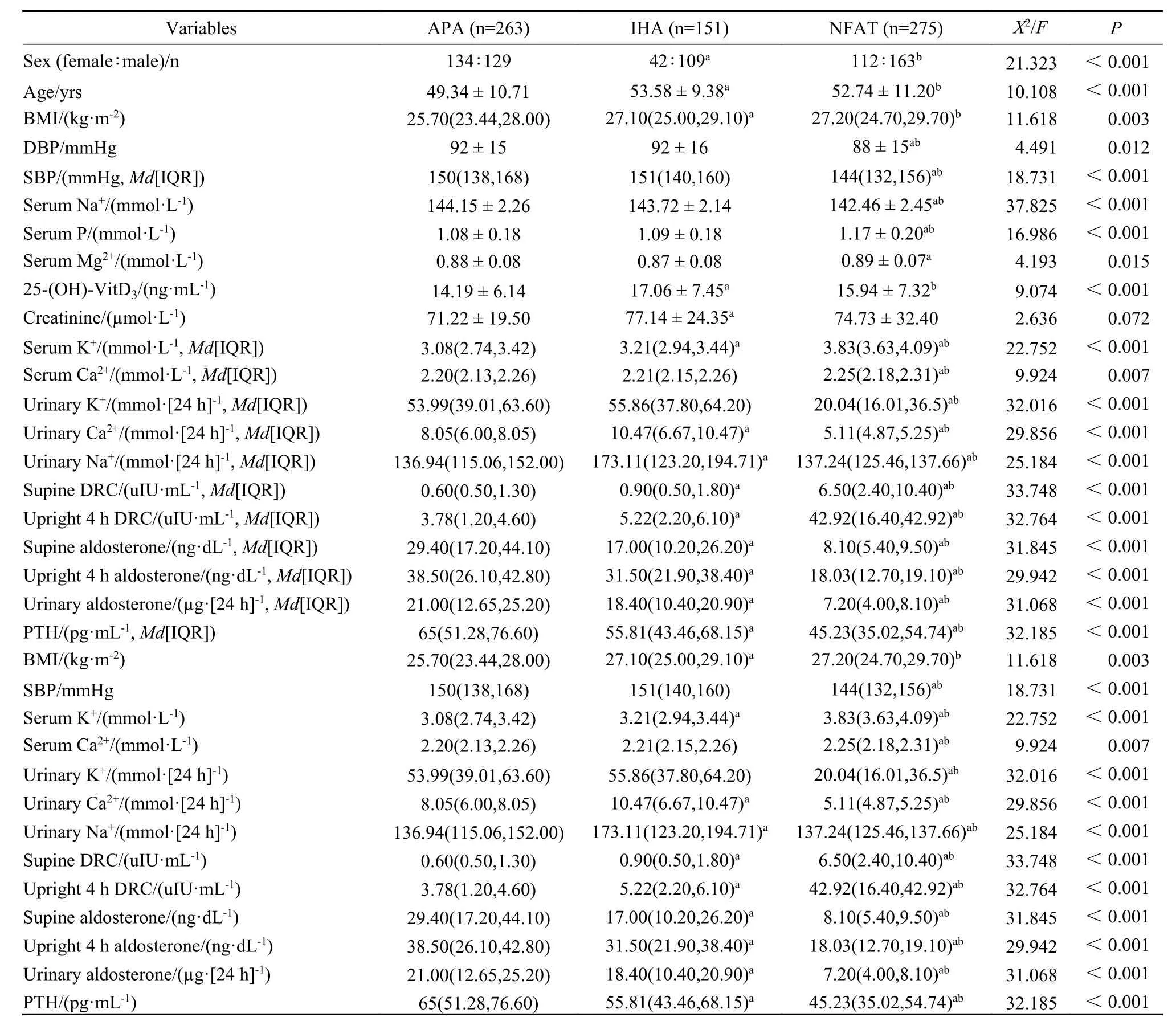
表1 三组患者一般资料比较Tab.1 Baseline characteristics of patients with PA,NFAT,APA or NFAT
2 PTH相关因素分析将414 例PA患者的PTH 进行Pearson 相关性分析,显示PTH 水平与血钾、血钙、血磷呈负相关,与血钠、尿醛固酮、血浆醛固酮呈正相关(表2)。

表2 PTH 与实验室指标的相关因素分析(n=414)Tab.2 Correlation analysis of PTH with laboratory indicators (n=414)
3 ROC 曲线分析 进一步行PTH 指标对PA 的诊断评估价值分析(分析结果见表3,ROC 分析曲线见图1),如下。1) 以鉴别PA 与NFAT 为诊断评估目标:以PA 组为阳性样本(n=414),以NFAT 组为阴性样本(n=275),建立ROC 曲线诊断分析模型,再以软件拟合之ROC 曲线读取约登指数最大值点,对应计算理论阈值和各项参数。并按实测样本计算敏感度、特异性、准确度。经ROC 分 析 知:PTH 鉴 别PA 与NFAT 的ROCAUC(95%CI) 为0.742(0.526~ 0.948),理论阈值为52 pg/mL。2)以鉴别PA 患者中APA 与IHA 两分型为诊断评估目标:以APA 分型患者为阳性样本(n=263),以IHA 分型患者为阴性样本(n=151),方法同上。经ROC 分析知:鉴别PA 患者中APA 与IHA 两分型的ROC-AUC(95%CI)为0.674(0.375~0.967),理论阈值为60 pg/mL。

表3 PTH 鉴别PA 与NFAT、APA 与IHA 的诊断性分析结果Tab.3 Diagnostic performance of PTH in differentiating PA from NEAT,APA from IHA
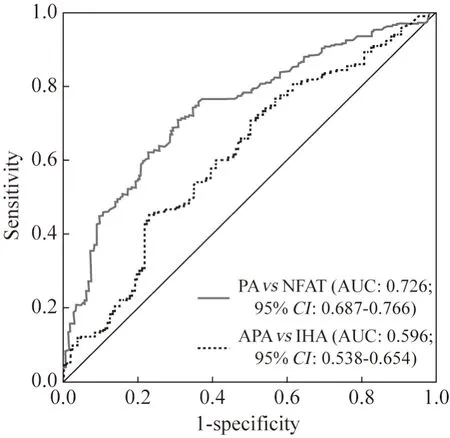
图1 ROC 分析曲线Fig.1 ROC curve analysis
讨论
PA 是继发性高血压的常见病因,临床上以高血压、低血钾、高醛固酮、低肾素为主要表现。PA 的分型中以APA 和IHA 最为常见[13-14]。APA切除后可使血钾水平恢复正常、血压下降或完全恢复正常[2,15];IHA 则以药物治疗为首选。故明确APA 与IHA 分型在临床工作中尤其重要。目前多项研究发现,醛固酮与PTH 存在相互作用,二者共同作用导致PA 患者的靶器官损害,尤其是心血管疾病风险的增加[1-2,16]。既往已有研究表明,PA 与NFAT 患者PTH 水平存在差异[17-18]。
本研究显示,PA 组的PTH、血钠、尿钾、尿钙、血浆醛固酮、尿醛固酮水平高于NFAT 组,血钾、血钙低于NFAT 组。PA 组存在高PTH、低血钙、高尿钙的特点,符合继发性甲状旁腺功能亢进的表现,且相较于NFAT 组25 羟维生素D3无明显差异。PA 组PTH 水平升高可能的机制为:1)PA 患者醛固酮分泌增多,肾远端排钾增加,血钾降低,钠-氢交换增加,导致代谢性碱中毒,血浆中的结合钙增多,游离钙减少,导致继发性甲状旁腺功能亢进[3]。2) 正常肾上腺球状带细胞及醛固酮瘤细胞可表达PTH1 受体和PTHrP受体,活化的PTH/PTHrP 受体通过与多种G 蛋白结合,启动腺苷酸环化酶/蛋白激酶A 和胞质钙/肌醇磷酸酯/蛋白激酶C 途径,增强醛固酮对肾素-血管紧张素Ⅱ的反应,以浓度依赖的方式刺激醛固酮的分泌[6]。与本研究相关性分析中血清PTH 水平与尿醛固酮、血浆醛固酮呈正相关的结果相符,提示PA 患者PTH 水平升高与PA 的严重程度相关,可作为评估PA 患者严重程度的参考指标[4]。
Rossi 等[9]研究发现PA 患者行盐水输注试验后尿钙排出增多、血钙下降、PTH 水平上升,考虑是钠负荷增多的急性变化[19]。本研究同样显示PA 组血钠高于NFAT 组,PTH 与血钠呈正相关。既往有研究表明低血钾是PA 患者PTH 升高的独立影响因素[20]。可能与长期低血钾导致肾小管细胞空泡样变性,肾小管浓缩功能障碍致尿钙排出增加,PTH 清除作用减弱有关。本研究也显示PA 患者血钾与PTH 相关。因此,对于手术后或口服药物治疗后血钾恢复正常的患者,可以考虑通过PTH 的变化来判断疗效。
目前PTH 在PA 分型中的研究缺乏一致性。Rossi 等[9]对58 例PA 患者(APA 46 例,IHA 12 例)PTH 水平研究发现,以PTH 80 ng/L 作为切点可用于区分PA 患者单侧病变与双侧病变,敏感度为74%,特异性为82%。孙致连和李红晖[18]对29 例PA 患者(APA 9 例,IHA 10 例、NFAT 10 例) PTH水平研究发现,以PTH 64.4 pg/mL 作为切点鉴别PA 与NFAT,敏感度为88.9%,特异性为80.0%;以PTH 86.8 pg/mL 作为切点鉴别APA 与IHA,敏感度为77.8%,特异性为78.0%。本研究APA 组PTH 明显高于IHA 组,PTH 鉴别PA 与NFAT 的最佳切点值为49.69 pg/mL,敏感度为71%,特异性为69.1%;鉴别APA 与IHA 的最佳切点值为69 pg/mL,敏感度为44.9%,特异性为76.8%。PTH切点值明显低于上述两项研究,且敏感度与特异性均下降,考虑与样本量增多、患者PTH 水平较上述两项研究减低有关。
综上,PA 与NFAT 患者以及APA 与IHA 患者PTH 水平存在差异,PTH 水平受血钾及醛固酮水平的影响,可作为PA 诊断及分型的辅助参考指标。

